高考化学一轮复习讲义课件+作业1Word文档格式.docx
《高考化学一轮复习讲义课件+作业1Word文档格式.docx》由会员分享,可在线阅读,更多相关《高考化学一轮复习讲义课件+作业1Word文档格式.docx(12页珍藏版)》请在冰豆网上搜索。
9.50
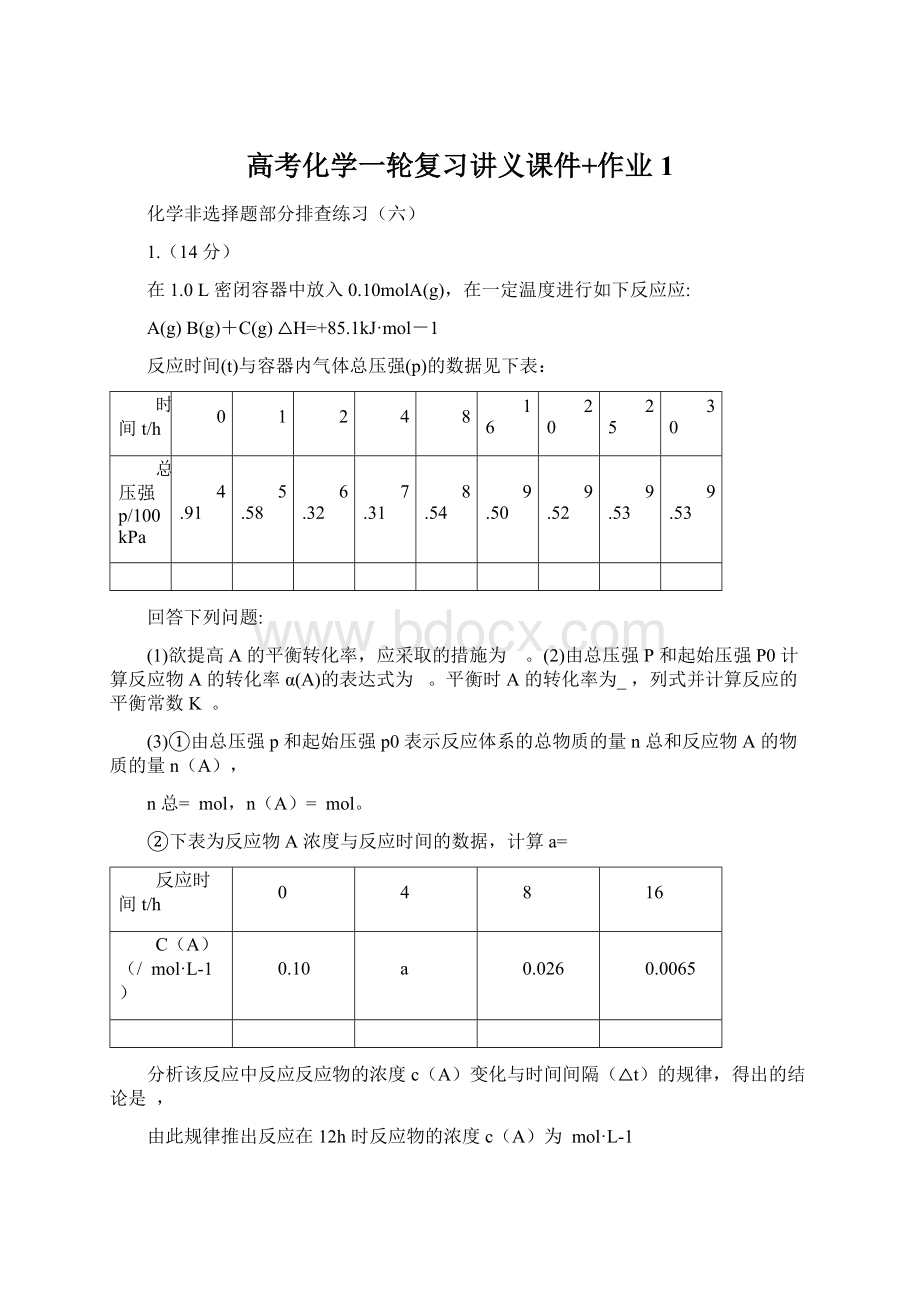
9.52
9.53
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为。
平衡时A的转化率为_,列式并计算反应的平衡常数K。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=mol,n(A)=mol。
②下表为反应物A浓度与反应时间的数据,计算a=
反应时间t/h
C(A)(/mol·
L-1)
0.10
a
0.026
0.0065
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是,
由此规律推出反应在12h时反应物的浓度c(A)为mol·
L-1
【解析】考察化学平衡知识,涉及平衡移动,转化率、平衡常数、平衡计算、反应速率、表格数据分析。
(1)根据反应是放热反应特征和是气体分子数增大的特征,要使A的转化率增大,平衡要正向移动,可以采用升高温度、降低压强的方法。
(2)反应前气体总物质的量为0.10mol,令A的转化率为α(A),改变量为0.10α(A)mol,根据差量法,气体增加0.10α(A)mol,由阿伏加德罗定律列出关系:
0.10pOp9.53
=α(A)=(-1)×
100%;
α(A)=(-1)×
100%=94.1%
0.10+0.10α(A)ppo4.91
平衡浓度C(C)=C(B)=0.1×
94.1%=0.0941mol/L,C(A)=0.1-0.0941=0.0059mol/L,
0.09412
K=
0.0059
=1.5
(3)①0.10pO
n=0.1×
p
;
其中,n(A)=0.1-(0.1×
p-0.1)=0.1×
(2-p)
=
nppo
popo
②n(A)=0.1×
(2
=0.051C(A)=0.051/1=0.051mol/L
每间隔4小时,A的浓度为原来的一半。
当反应12小时时,C(A)=0.026/2=0.013mol/L
【答案】
(1)升高温度、降低压强
(2)α(A)=(p-1)×
94.1%;
0.09412;
po
(3)①0.1p0.1×
(2p
②0.051;
0.013
2.(14分)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。
因此,对PM2.5、SO2、
NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子
K+
Na+
+
NH4
2-
SO4
NO3-
Cl-
浓度/mol·
L-
4×
10-6
6×
2×
10-5
3×
根据表中数据判断PM25的酸碱性为,试样的pH=。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:
H2(g)+1O(g)=H
O(g)
△H=-241.8kJ·
222
C(s)+1O(g)=CO(g)
△H=-110.5kJ·
22
写出焦炭与水蒸气反应的热化学方程式:
。
②洗涤含SO2的烟气。
以下物质可作洗涤剂的是。
a.Ca(CH)2b.Na2CO3c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:
N2(g)+O2(g)2NO(g)△H>
0若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×
10-4mol。
计算该温度下的平衡常数K=。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)
已知该反应的△H>
0,简述该设想能否实现的依据:
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为。
(1)酸性,4
3、(本题共8分)
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。
羰基法提纯粗镍涉及的两步反应依次为:
(a)Ni(S)+4CO(g)
Ni(CO)4(g)+Q
(b)Ni(CO)4(g)Ni(S)+4CO(g)
完成下列填空:
(1).在温度不变的情况下,要提高反应
(1)中Ni(CO4)的产率,可采取的措施有、
。
(2).已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如右图所示。
Ni(CO)4在0~10min的平均反应速率为
(3).若反应
(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时。
a.平衡常数K增大b.CO的浓度减小
c.Ni的质量减小d.v逆[Ni(CO)4]增大
(4).简述羰基法提纯粗镍的操作过程。
.【答案】
(1)增大压强、从反应体系中移走Ni(CO)4(g);
(2)0.05mol/(L·
min)(3)bc(4)在封闭的玻璃管一端放入粗镍,控制温度在50℃,通入CO气体,一点时间后在玻璃管的另一端加热至230℃,即可在该端获得纯净的镍。
【解析】
(1)反应
(1)是气体体积减少的放热反应,因此在温度不变的情况下,采取增大体系压强、从反应体系中移走Ni(CO)4(g)等措施均可使反应正向进行,提高Ni(CO)4的产率。
(2)随反应进行,粗镍减少的质量即为参加反应(a)消耗的镍的质量,在0~10min,生成Ni(CO)4的物质的量=(100g-41g)/59g·
mol-1=1mol,故在0~10min,v[Ni(CO)4]=1mol/(2L
×
10min)=0.05mol/(L·
min)。
(3)由反应(a)为放热反应可知反应
(2)为吸热反应,因此反应(b)达到平衡后,降温,平衡逆向进行,反应平衡常数K变小、CO的浓度与Ni的质量均减小、因温度降低,v逆[Ni(CO)4]减小。
(4)利用信息可知,可采取在低温(50℃)时让粗镍和CO作用,使生成的Ni(CO)4在230℃时分解即可得到纯镍。
4.(14分)化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3—还原为N2,25℃时,反应进行10min,溶液的pH
由7变为12。
①N2的结构式为。
3
②上述反应离子方程式为,其平均反应速率v(NO—)为mol∙L—1∙min—
③还原过程中可生成中间产物NO2—,写出3种促进NO2—水解的方法。
(2)电化学降解NO3—的原理如题11图所示。
①电源正极为(填“A”或“B”),阴极反应式为。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为g。
3222
【答案】11.
(1)①N≡N②2NO-+5H
N+2OH-+4HO0.001③加酸,升高温度,加水
(2)①A,2NO3-+6H2O+10e-=N2+12OH-②14.4
(1)①N2分子中氮原子间通过氮氮三键结合,因此其结构式为N≡N;
②利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式;
利用离子方程式知v(NO3-)=v(OH-)=(10-2-10-7)/10=0.001mol/(L·
min);
③水解是吸热反应,NO2-水解使溶液中c(OH-)变大,因此可促进NO2-水解的措施有加热、加水或加酸等。
(2)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;
在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应
且有OH-生成;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;
阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g。
5.(14分)
某酸性工业废水中含有KCrO。
光照下,草酸(HCO)能将其中的CrO2-转化为
22722427
Cr3+。
某课题组研究发现,少量铁明矾[AlFe(SO)24HO]即可对该反应堆起催化作用。
2442
为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°
C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
27
测得实验①和②溶液中的CrO2-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为(填化学式)。
(3)
实验①和②的结果表明;
实验①中o~t时间段反应速率υ(Cr3+)=
molL-1min-1(用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)424H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:
Fe2+起催化作用;
假设二:
;
假设三:
…………
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有
KSO、FeSO、KSO、Al(SO)24HO、Al(SO)等。
溶液中CrO2-的浓度可用仪
24424243224327
器测定)
实验方案(不要求写具体操作过程)
预期实验结果和结论
(2)CO2
(3)PH越大,反应的速率越慢
c0-c1