华师大九年级上第一章酸碱盐复习提纲第一章复习提纲Word格式文档下载.doc
《华师大九年级上第一章酸碱盐复习提纲第一章复习提纲Word格式文档下载.doc》由会员分享,可在线阅读,更多相关《华师大九年级上第一章酸碱盐复习提纲第一章复习提纲Word格式文档下载.doc(8页珍藏版)》请在冰豆网上搜索。
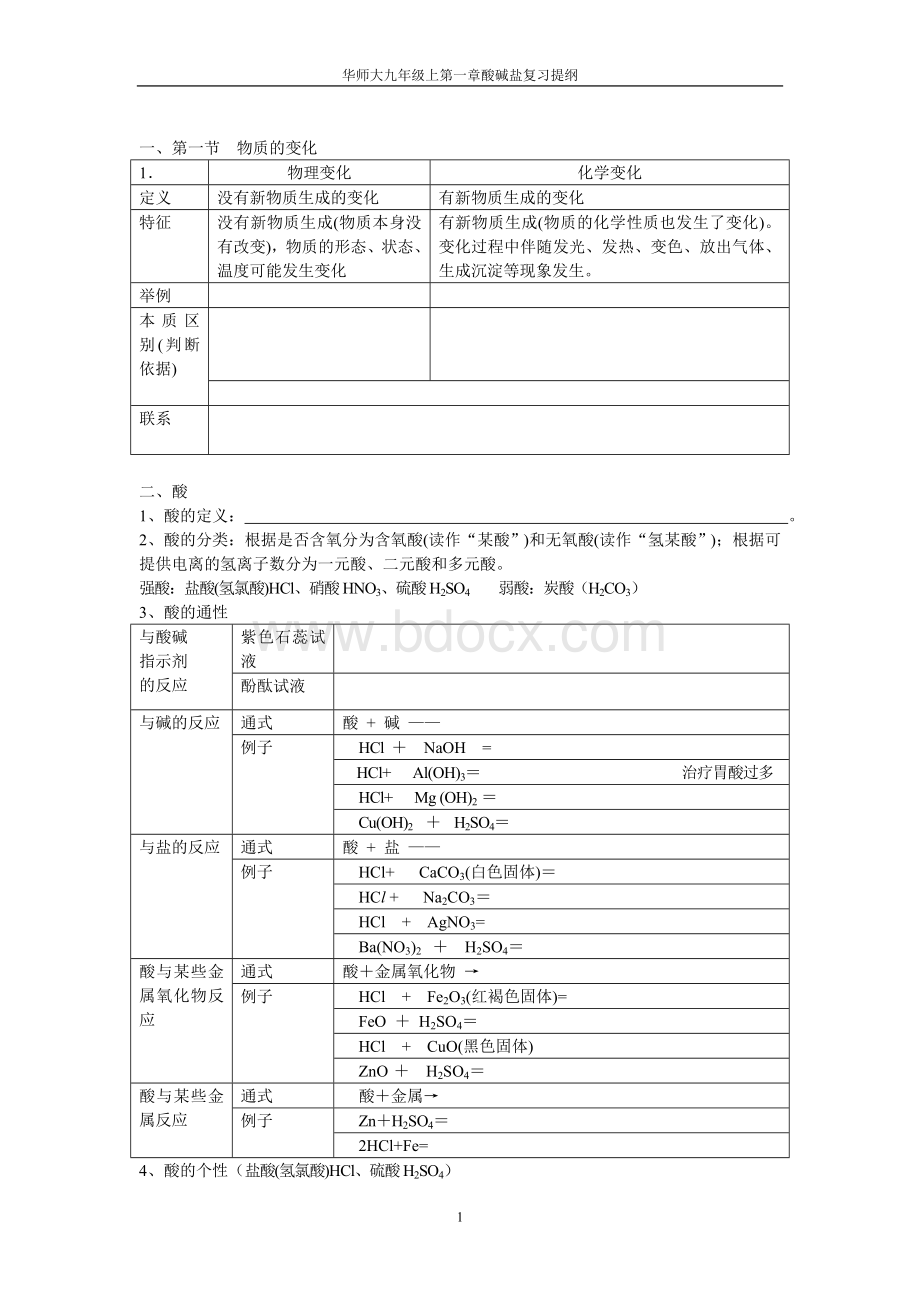
盐酸(氢氯酸)HCl、硝酸HNO3、硫酸H2SO4
弱酸:
炭酸(H2CO3)
3、酸的通性
与酸碱
指示剂
的反应
紫色石蕊试液
酚酞试液
与碱的反应
通式
酸+碱——
例子
HCl+NaOH=
HCl+Al(OH)3=治疗胃酸过多
HCl+Mg(OH)2=
Cu(OH)2+H2SO4=
与盐的反应
酸+盐——
HCl+CaCO3(白色固体)=
HCl+Na2CO3=
HCl+AgNO3=
Ba(NO3)2+H2SO4=
酸与某些金属氧化物反应
酸+金属氧化物→
HCl+Fe2O3(红褐色固体)=
FeO+H2SO4=
HCl+CuO(黑色固体)
ZnO+H2SO4=
酸与某些金属反应
酸+金属→
Zn+H2SO4=
2HCl+Fe=
4、酸的个性(盐酸(氢氯酸)HCl、硫酸H2SO4)
盐酸HCl
物理性质
色味,有性
化学性质
强腐蚀性
浓硫酸
色味状的液体
吸水性
可以用来干燥气体,例如
脱水性
可以将有机物中的氢元素和氧元素“脱出”结合成水
浓硝酸
无色有刺激性气味的液体,具有挥发性,打开浓硝酸的瓶盖,
瓶口出现白雾,为硝酸小液滴
硝酸具有强氧化性,跟金属反应一般不生成氢气而生成水。
具有强腐蚀性
三、碱
1、碱的定义:
2、碱的通性
与酸的反应
碱+酸——
H2SO4+NaOH=
Ba(OH)2+H2SO4=
Ca(OH)2+HNO3=
Fe(OH)3(红褐色固体)+H2SO4=
碱+盐——
CuCl2+NaOH
FeCl3+NaOH=
FeCl3+Ba(OH)2=
Na2CO3+
Ca(OH)2=
碱与某些金属氧化物反应
碱+非金属氧化物→
CO2+Ca(OH)2=
SO2+NaOH=
CO2+NaOH=
3、碱的个性(氢氧化钠NaOH,氢氧化钙Ca(OH)2
氢氧化钠NaOH
色体,有性,易潮解,可以做干燥剂
氢氧化钙
Ca(OH)2
色体,易潮解,可以做干燥剂
水溶液是石灰水,有腐蚀性。
四、盐
1、盐的定义:
2、盐的通性
盐+酸——
盐+盐→
Na2CO3+CaCl2=
(NH4)2SO4+BaCl2=
NaCl+AgNO3=
与金属的反应
金属+盐——
Fe+CuSO4==
Cu+AgNO3==
3、盐的个性
碳酸钠Na2CO3
色体,晶体(Na2CO3●10H2O)在干燥的空气中易风化
往碳酸钠溶液中滴入酚酞试剂,
溶液色
Na2CO3●10H2O==
Na2CO3+HCl=
Na2CO3+Ca(OH)2=
碳酸钙CaCO3
色体
CaCO3+HCl=
CaO+H2O=
五、离子的检验
加入的试剂
反应方程式
Cl-的检验
SO42-的检验
CO32-的检验
NH4+的检验
六、反应类型
化和反应
分解反应
复分解反应
置换反应
7、盐的制取
l制取盐的可能途经:
1.金属+酸→盐+氢气 2.酸+金属氧化物→盐+水3.酸+碱→盐+水
4.酸+盐→新酸+新盐5.碱+盐→新碱+新盐6.碱+酸性氧化物→盐+水
7.盐+盐→新盐+新盐金属+盐→新金属+新盐
写出如何制取ZnCl2的四种方法
八、金属
1、金属的用途是由金属的性质决定的。
金属物理性质
用途
做装饰品
做钻头、机器等
拉铁丝、打锄头、做铝箔等
铝丝、铜丝等做导线、电缆。
铁锅、铝茶壶等
永久磁铁等
分离物质
2、化学性质
(1)金属与氧气的反应:
金属+O2→金属氧化物
(2)金属与酸反应:
金属+酸→盐+氢气
Al+HCl=
Zn+HCl==
Mg+H2SO4=
(3)金属与盐反应:
金属+盐→新金属+新盐
Zn+FeSO4==
金属在金属活动性顺序表中的位置越靠前,它的活动性越强。
金属的金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb [H] Cu Hg Ag Pt Au
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
金属活动性由强逐渐减弱
九、有机物
1.有机物和无机物:
通常将一类含碳的化合物叫有机化合物,简称有机物。
有机物大多含有碳、氢、氧、氮等元素。
碳的氧化物CO和CO2,碳酸H2CO3、碳酸盐CO32-、碳酸氢HCO3-盐归到无机物中。
甲烷CH4
甲烷具有可燃性P40实验:
产生蓝色火焰,同时石灰水变浑浊。
冰融化成水,水气化成水蒸气
铁生锈,食物腐烂,木炭燃烧
分子间的距离发生改变。
构成物质的分子的原子重新组合,形成了新的分子。
在变化中是否有新物质生成
在化学变化过程中一定伴随物理变化,如蜡烛的燃烧。
在物理变化过程中不一定发生化学变化。
电离时生成的阳离子全部是氢离子的化合物叫做酸。
紫色石蕊试液变红
无色酚酞不变色
酸+碱——盐+水
HCl+NaOH=NaCl+H2O
3HCl+Al(OH)3=AlCl3+3H2O治疗胃酸过多
2HCl+Mg(OH)2=MgCl2+2H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
酸+盐——新酸+新盐
2HCl+CaCO3(白色固体)=CaCl2+CO2↑+H2O
2HCl+Na2CO3=2NaCl+CO2↑+H2O
HCl+AgNO3=AgCl↓+HNO3
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
酸+金属氧化物→盐+水
6HCl+Fe2O3(红褐色固体)=2FeCl3+3H2O
FeO+H2SO4=FeSO4+H2O
2HCl+CuO(黑色固体)=CuCl2+H2O
ZnO+H2SO4=ZnSO4+H2O
酸+金属(活动性在H之前)→盐+氢气
Zn+H2SO4=ZnSO4+H2↑
2HCl+Fe=FeCl2+H2↑(注意:
铁与酸反应制取氢气只能生成亚铁盐)
无色有刺激性味,有挥发性
无色粘稠,油状的液体
可用来干燥气体,例CO2、H2、O2等不与硫酸发生反应的气体
三、碱1、碱的定义:
电离时生成的阴离子全部是氢氧根离子的化合物叫做碱。
紫色石蕊试液变蓝
无色酚酞变红
碱+酸——盐+水
H2SO4+2NaOH=Na2SO4+2H2O
Ba(OH)2+H2SO4=BaSO4↓+2H2O
Ca(OH)2+2HNO3=Ca(NO3)2+2H2O
2Fe(OH)3(红褐色固体)+3H2SO4=Fe2(SO4)3+6H2O
碱(溶)+盐(溶)——新碱+新盐
CuCl2+2NaOH==Cu(OH)2↓+2NaCl
FeCl3+3NaOH=Fe(OH)3↓+3NaC