高考频点十七结合元素推断的无机综合题.docx
《高考频点十七结合元素推断的无机综合题.docx》由会员分享,可在线阅读,更多相关《高考频点十七结合元素推断的无机综合题.docx(18页珍藏版)》请在冰豆网上搜索。
高考频点十七结合元素推断的无机综合题
高考频点十七结合元素推断的无机综合题
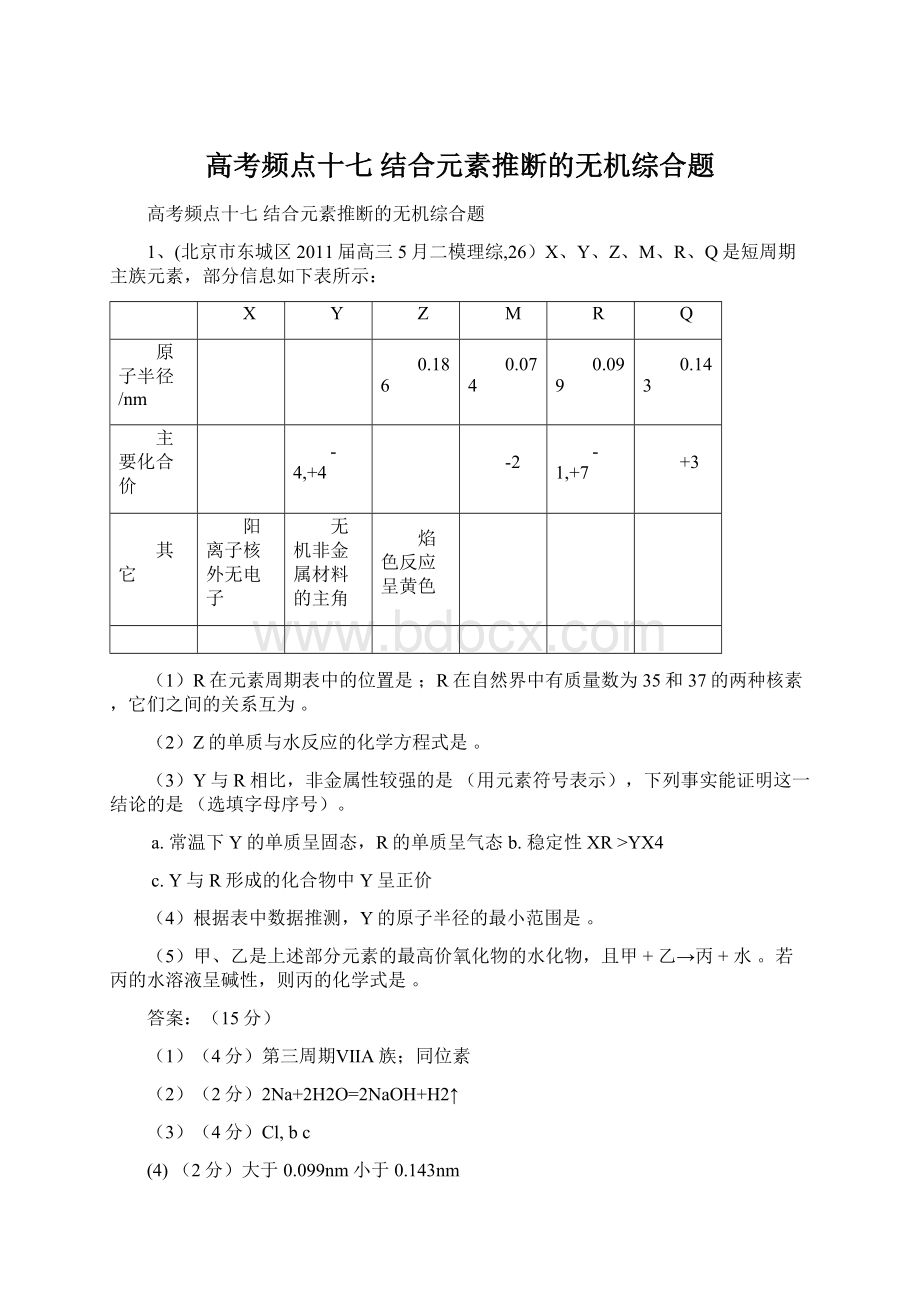
1、(北京市东城区2011届高三5月二模理综,26)X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X
Y
Z
M
R
Q
原子半径/nm
0.186
0.074
0.099
0.143
主要化合价
-4,+4
-2
-1,+7
+3
其它
阳离子核外无电子
无机非金属材料的主角
焰色反应呈黄色
(1)R在元素周期表中的位置是;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为。
(2)Z的单质与水反应的化学方程式是。
(3)Y与R相比,非金属性较强的是(用元素符号表示),下列事实能证明这一结论的是(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是。
(5)甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水。
若丙的水溶液呈碱性,则丙的化学式是。
答案:
(15分)
(1)(4分)第三周期ⅦA族;同位素
(2)(2分)2Na+2H2O=2NaOH+H2↑
(3)(4分)Cl,bc
(4)(2分)大于0.099nm小于0.143nm
(5)(3分)NaAlO2或Na2SiO3
2、(北京市东城区2011届高三4月一模理综,28)欲降低废水中重金属元素铬的毒性,可将
转化为Cr(OH)3沉淀除去。
已知:
氢氧化物开始沉淀时的pH
氢氧化物沉淀完全时的pH
Fe2+
7.0
9.0
Fe3+
1.9
3.2
Cr3+
6.0
8.0
(1)某含铬废水处理的主要流程如图-22所示:
图-22
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是。
②反应池中发生主要反应的离子方程式是
+
+5H+=2Cr3++
+4H2O。
根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是、。
证明Cr3+沉淀完全的方法是。
(2)工业可用电解法来处理含
废水。
实验室利用如图-23模拟处理含
的废水,阳极反应式是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
Fe2+与酸性溶液中的
反应的离子方程式是,
得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是;
。
用电解法处理该溶液中0.01mol
时,至少得到沉淀的质量是g。
答案:
(14分,每空2分)
(1)①Al3++3H2O=Al(OH)3(胶体)+3H+或Al3++3H2O
Al(OH)3+3H+
②Cr3++3OH-=Cr(OH)3↓、H++OH-=H2O。
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全。
(2)
+6Fe2++14H+=2Cr3++6Fe3++7H2O,阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强。
8.48
3、(哈尔滨三中、东北育才、大连育明、天津耀华四校2011届高三4月二模,28)Fe在地壳中的含量虽次于铝,但铁及其化合物在生活、生产中的应用最广泛。
请回答下列问题:
(1)Na2FeO4是一种高效多功能水处理剂,应用前景广阔。
一种制备铁酸钠的方法可用化学方程式表示如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是()
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化物又是还原产物
C.O2是还原产物
D.2molFeSO4发生反应时,反应中共有8mol电子转移
(2)硫酸亚铁晶体(FeSO4·7H2O),俗称“绿矾”,常作医药上的补血剂。
课外研究性小组测定某片状补血药品中铁元素的含量。
实验步骤如下:
请回答下列问题:
①该小组发现将片状补血剂长时间置于空气中,表面“发黄”,请用化学方程式表示
原因。
②课外研究性小组发现在滤液A中滴入少量KClO溶液,并加入适量硫酸,溶液立即变黄。
甲同学推测该反应的还原产物有两种可能:
①Cl2、②Cl-
乙同学结合甲的推测,认为其中一种可能可以排除,你认为可以排除的是(填序号);用离子方程式说明理由。
③若该实验温度下,上述红褐色难溶物质的溶度积为
试计算该物质沉淀完全所需要的pH=(要求保留2位有效数字)(已知溶液中离子浓度小于10-5mol/L时,该离子可看做沉淀完全,lg2=0.3)
④若实验过程中无损耗,最后称量得到mg红棕色的固体,则每片补血剂中含铁元素的质量为g(用含m的式子表示)
⑤丙同学认为蒸干灼烧溶液B,也可以制得红棕色固体C,请结合化学方程式加以说明
。
答案:
4、(北京市海淀区2011届高三4月一模理综,25)甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。
甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。
A元素原子核内质子数比E的少1,D、E处于同主族。
用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入适量NaOH溶液,加热;
④取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
(1)C的元素符号是,D在周期表中的位置。
(2)用离子方程式表示实验②中现象的原因:
。
(3)实验③中出现的现象是。
(4)经测定甲晶体的摩尔质量为392g/mol,其中阳离子与阴离子物质的量之比为3:
2,则甲晶体的化学式为。
答案:
(13分)
(1)Fe………………………………………………………………………(1分)
第3周期VIA族……………………………………………(2分)
(2)2Fe2++Cl2
2Cl-+2Fe3+……………………………………………(2分)
Fe3++3SCN-
Fe(SCN)3(等号给分)………………………(2分)
(3)有白色絮状沉淀生成,迅速变成灰绿色,最终变成红褐色(2分),加热有大量刺激
性气味气体生成(或有能使湿润的红色石蕊试纸变蓝的气体生成,2分)。
…………………………………………………………………(共4分)
(4)(NH4)2Fe(SO4)2·6H2O………………………………………………(2分)
[或Fe(NH4)2(SO4)2·6H2O,未写出结晶水给1分]
5、(北京市朝阳区2011届高三4月一模理综,25)KClO3在农业上用作除草剂,超细CaC03泛用于消光纸、无炭复写纸等。
某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:
I.
①电石与水反应的化学方程式是_________。
②残渣中主要成分是Ca(OH)2和________。
II.将I中的部分灰浆配成池液,通人Cl2,得到Ca(Clo3)2与Cacl2物质的量之比为1:
5的溶液,反应的化学方程式是________________
III.向II所得溶液中加人Kcl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体。
你认为能得到KClO3晶体的原因是________________。
IV.将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。
向所得CaCl2溶液中依次通入NH3、C02,便可获得超细CaCO3,过程如下:
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因________。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是________。
③图示的溶液A可循环使用,其主要成分的化学式是_______
答案:
6、(北京市海淀区2011届高三4月一模理综,27)某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。
该厂拟定如图19所示的废水处理流程。
图19
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是。
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因。
(3)②中反应后无气体放出,该反应的离子方程式为。
(4)③中反应时,每0.4molCr2O72-转移2.4mole-,该反应的离子方程式为。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。
请你使用化学用语,结合必要的文字解释其原因。
答案:
(15分)
(1)氧化还原法……………………………………………………………(2分)
(2)ClO-+H2O
HClO+OH-……………………………………………(3分)
(3)CN-+ClO-
CNO-+Cl-……………………………………………(3分)
(4)3S2O32-+4Cr2O72-+26H+
6SO42-+8Cr3++13H2O………………(3分)
(5)待检水样中还有Cu2+(1分)
Cu2++2OH-
Cu(OH)2↓(1分)
Cu(OH)2(s)+S2-(aq)
CuS(s)+2OH-(aq)
(1分,未标状态给分,或Cu(OH)2
Cu2++2OH-;Cu2++S2-
CuS↓给分)
CuS比Cu(OH)2更难溶(1分,或溶解度更小)………………(共4分)
7、(2011年广东汕头市普通高中高三教学质量测评理综
(一),32)铜陵有色金属集团公司是电解铜产量全国第一的大型企业。
其冶炼工艺中铜、硫回收率达到97%、87%。
下图表示其冶炼加工的流程:
冶炼中的主要反应:
⑴烟气中的主要废气是,从提高资源利用率和减排考虑,其综合利用方式是:
。
⑵电解法精炼铜时,阳极是(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式沉淀在电解槽(填“阳极”或“阴极”)的槽底,阴极的电极反应式是。
⑶在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(Ksp)
物质
Fe(OH)2
Fe(OH)3
Zn(OH)2
Cu(OH)2
Ksp
8.0×10-16
4.0×10-38
3.0×10-17
2.2×10-20
①调节电解液的pH是除去杂质离子的常用方法。
根据上表中溶度积数据判断,含有等物质的量浓度Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是。
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是
。
加入H2O2后发生反应的离子方程式为。
答案:
(16分)
(1)SO2(2分)制硫酸(2分)
(2)粗铜板(2分)阳极(2分)Cu2++2e-=Cu(2分)
(3)①Fe3+(2分)②将Fe2+氧化为Fe3+(2分),Fe2++2H++2H2O2=2Fe3++2H2O(2分)
8、(2011年广州市高中毕业班综合测试
(一),31)亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应1”反应速率的措施有___________、_____________等。
(2)“反应2”的氧化剂是________________,该反应的化学方程式为______________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是________________。
(4)从“母液”中可回收的主要物质是________________。
(5)“冷却结晶”后经________________________(填操作名称)即可获得粗产品。
答案:
9、(安徽省江南十校2011年高考二模冲刺理综卷,27)Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。
钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:
592℃;
③KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9=9-dd
。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:
将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。
试用离子方程式说明提纯原理:
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:
。
(3)该厂结合本厂实际,选用的X为(填序号);
A.BaCl2B.BaCO3C.Ba(NO3)2D.Ba(OH)2
(4)中和I使溶液的pH为4~5目的是;
结合离子方程式简述原理。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是。
(6)测定所得Ba(NO3)2晶体的纯度:
准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为。
答案:
10、(上海市普陀区2011届高三4月质量调研考试化学卷,27)硫酸铁铵[a(NH4)2SO4·bFe2(SO4)3·cH2O]常作为高铁的标准,可用于测定卤素的指示剂。
某工厂实验室用一种硫酸亚铁样品(含少量硝酸钙)和硫酸铵为原料,设计如下工艺过程,制取硫酸铁铵:
(已知:
NaClO、H2O2、KMnO4、K2Cr2O7均具有强氧化性,能氧化Fe2+。
)
请完成下列填空:
(1)写出A、B适宜的化学式:
A、B。
(2)减压过滤得到的滤渣C,其主要成分是(填化学式)。
操作甲的目的是:
。
(3)操作乙、丙的名称分别是:
乙,丙。
(4)检验产品硫酸铁铵中的阳离子,相关的离子方程式有 。
(5)为了用重量法确定产品硫酸铁铵[a(NH4)2SO4·bFe2(SO4)3·cH2O]中a、b、c的值(供选用的试剂:
浓硫酸、碱石灰、氢氧化钠、氯化钡),除了测得取用样品的质量外,至少还需要测定 种物质的质量。
灼烧固体所需要的仪器是 (选填仪器编号)。
(A)玻璃棒(B)大试管(C)坩埚(D)蒸发皿(E)坩埚钳(F)石棉网
答案:
(共12分)
(1)(2分)H2SO4、H2O2
(2)(2分)CaSO4。
检验Fe2+是否已全部被氧化。
(3)(2分)冷却结晶、常温晾干
(4)(2分)NH4++OH-
NH3↑+H2O、Fe3++3SCN-
Fe(SCN)3
(5)(4分)2;A、C、E
11、(广东省佛山一中等三校2011届高三下学期联考理综,32)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。
其工艺流程如下:
(1)溴在周期表中位于_________周期,_________族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,为什么?
。
(3)步骤④的离子方程式:
________________________________________。
(4)步骤⑥的蒸馏过程中,溴出口温度为何要控制在80—900C。
温度过高或过低都不利于
生产,请解释原因__________________________________________。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。
分离仪器的名称是_____________,分离时液溴从分离器的_____(填“上口”或“下口”)排出。
(6)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”___。
答案:
(16分)
(1)4VIIA(2分)
(2)酸化可抑制Cl2、Br2与水反应(2分)
(3)Br2+SO2+2H2O=4H++2Br-+SO42-(2分)
(4)温度过高,大量水蒸气随水排除出,溴气中水增加;温度过低,溴不能完全蒸出,吸收率低。
(2分)
(5)分液漏斗下口(4分)
(6)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高。
(2分)“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程。
(2分)
12、(广东省湛江市2011届高三二模理综,32)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。
其生产工艺如下:
(1)反应①应在温度较低的情况下进行。
因在温度较高时KOH与Cl2反应生成的是KClO3。
写出在温度较高时KOH与Cl2反应的化学方程式,该反应的氧化产物是。
(2)在溶液I中加入KOH固体的目的是(填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为。
(4)如何判断K2FeO4晶体已经洗涤干净。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
____FeO
+___H2O=___Fe(OH)3(胶体)+___O2↑+___OH-。
答案:
(16分)
(1)6KOH+3Cl2
KClO3+5KCl+3H2O(3分);KClO3(2分)
(2)AC(2分)
(3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O(3分)
(4)用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净(3分)
(5)4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-(3分)
13、(北京市昌平区2011届高三二模理综,25)铁元素及其化合物与人类的生产生活息息相关,回答下列问题:
⑴铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+。
①铁酸钠中铁元素的化合价为_____。
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:
______。
(用离子方程式表示)
⑵反应ⅠFe(s)+CO2(g)
FeO(s)+CO(g)△H=akJ・mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g)△H=bkJ・mol-1
测得在不同温度下,K值如下:
温度/℃
500
700
900
K
1.00
1.47
2.40
①写出K的表达式__________________。
②反应Ⅰ中的a____________0(填大于、小于、等于)。
③若500℃时进行反应Ⅰ,CO2起始浓度为2mol・L-1,CO的平衡浓度为____________mol・L-1。
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有____________(填序号)。
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H=______kJ・mol-1。
⑶铁红是一种红色颜料,其成份是Fe2O3。
将一定量的铁红溶于160mL5mol·L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______g。
答案:
(15分)⑴①+6(1分)②Al3++3H2O
Al(OH)3+3H+
⑵①K=c(CO)/c(CO2)②大于
③1mol・L-1④BC⑤2(a+b)kJ・mol-1⑶11.2g
14、(北京市昌平区2011届高三二模理综,26)A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D是所在周期原子半径最大的元素。
又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。
请回答下列问题:
⑴D在元素周期表中的位置是______。
⑵由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为______。
⑶D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为______;若有1mol电子转移,生成Z的物质的量为______mol。
⑷写出实验室制备BA3的化学方程式________________________。
将BA3通入溴水中可发生反应,生成一种单质和一种盐,写出该反应的离子方程式______。
⑸已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。
该电池负极反应是________________________。
以石墨为电极,用该电池电解100mL饱和食盐水,一段时间后,在两极共收集到224mL气体(标准状况下),此时溶液的pH是(忽略溶液体积的变化)________。
答案:
(14分)
⑴第三周期第ⅠA族(1分)
⑵(1分)
⑶2Na2O2+2H2O=4NaOH+O2↑0.5
⑷2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
8NH3+3Br2=N2+6NH4++6Br-
⑸N2H4+4OH--4e-==N2+4H2O13
15、(山西大学附属中学2011届高三下学期模拟考试理综,28)某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。
某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。
所用试剂:
样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
该小组探究过程如下:
●查阅资料:
①镁、铝、锌都是银白色的金属
②锌(Zn)可以与NaOH溶液反应生成H2
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O
④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+
●提出假设:
(1)假设①:
该混合金属粉末中除镁外还含有________元素
假设②:
该混合金属粉末中除镁外还含有________元素
假设③:
该混合金属粉末中除镁外还含有铝、锌元素
●实验探究:
甲同学基于假设③设计实验方案如下:
乙同学同样基