工业流程专项练习一.docx
《工业流程专项练习一.docx》由会员分享,可在线阅读,更多相关《工业流程专项练习一.docx(9页珍藏版)》请在冰豆网上搜索。
工业流程专项练习一
工业流程专项练习
(一)、印刷材料工艺
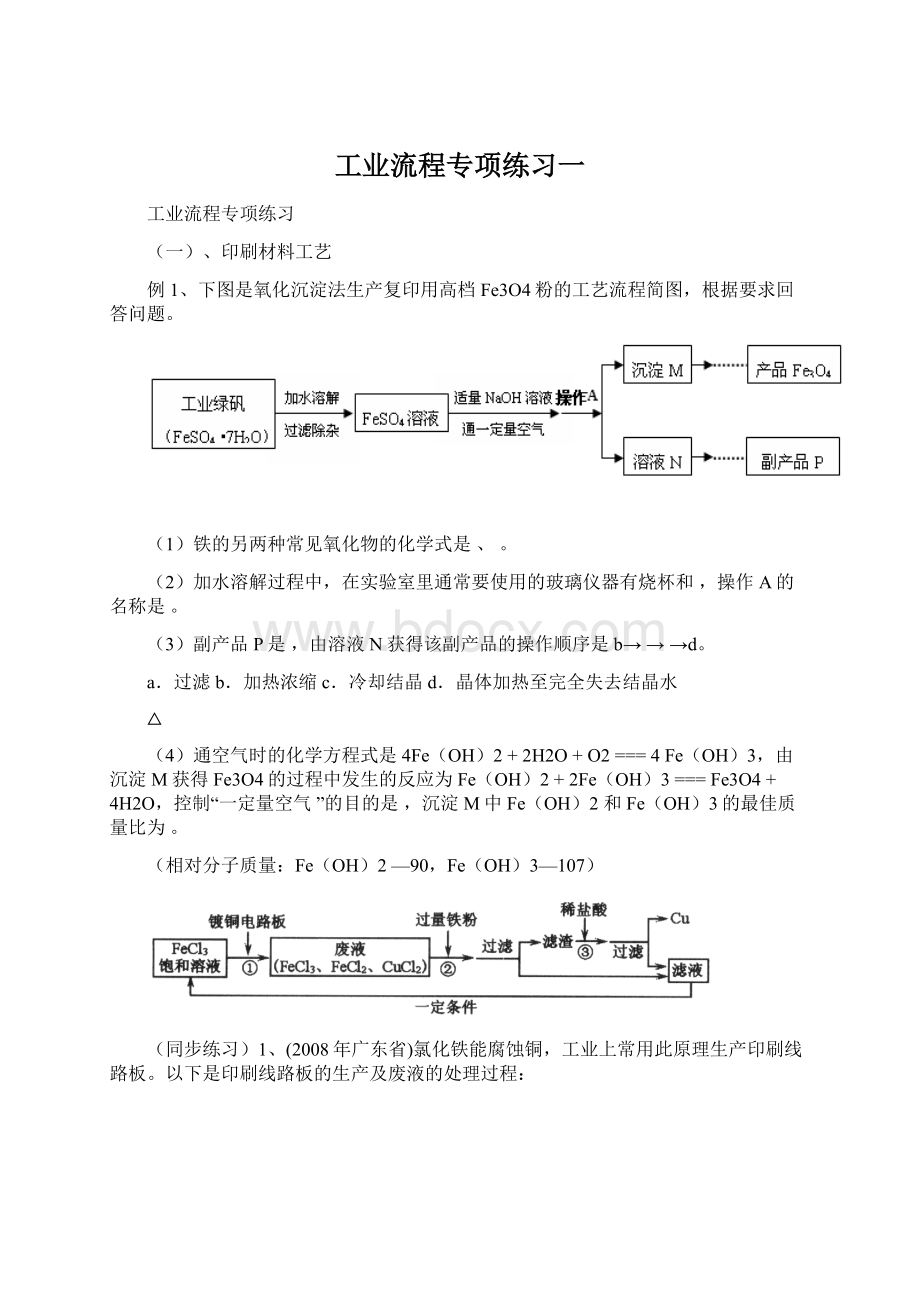
例1、下图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题。
(1)铁的另两种常见氧化物的化学式是、。
(2)加水溶解过程中,在实验室里通常要使用的玻璃仪器有烧杯和,操作A的名称是。
(3)副产品P是,由溶液N获得该副产品的操作顺序是b→→→d。
a.过滤b.加热浓缩c.冷却结晶d.晶体加热至完全失去结晶水
△
(4)通空气时的化学方程式是4Fe(OH)2+2H2O+O2===4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3===Fe3O4+4H2O,控制“一定量空气”的目的是,沉淀M中Fe(OH)2和Fe(OH)3的最佳质量比为。
(相对分子质量:
Fe(OH)2—90,Fe(OH)3—107)
(同步练习)1、(2008年广东省)氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板。
以下是印刷线路板的生产及废液的处理过程:
请回答下列问题:
(1)步骤②中发生了两个反应:
2FeCl3+Fe=3FeCl2和
(2)滤渣的成份有,步骤③中发生反应的化学方程式是
(3)该流程中可以循环、回收利用的物质是:
。
(二)、化肥生产工艺
例2、(2009镇江)(15分)某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程。
【工艺流程及原理】
沉淀池中发生的主要化学反应为:
CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
【讨论交流】
(1)操作a的名称是,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要。
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用。
Y的化学式为。
(3)沉淀池中也可能生成少量NH4HCO3,该反应的化学方程式为此空超纲可不答。
【硫酸铵化肥等级测定】
(1)判断(NH4)2SO4化肥中有无NH4HCO3:
取少量试样溶于水,滴加足量的,无气泡产生,则可判断该化肥中不存在NH4HCO3。
(2)化肥中氮元素含量的测定(已确定该化肥中不存在NH4HCO3杂质):
查阅资料:
①已知:
(NH4)2SO4+2NaOH
Na2SO4+2NH3↑+2H2O
氨气极易溶于水,其水溶液为氨水。
氨水呈碱性,不稳定,易挥发。
②工业判断硫酸铵化肥等级指标如下:
指标
项目
优等品
合格品
氮(N)含量
≥21.0%
≥20.5%
实验设计:
按右图所示装置进行实验。
(1)实验过程中,往烧瓶中加入足量浓氢氧化钠溶液,并加热使硫
酸铵充分反应完全转化为NH3。
(2)烧杯中的试剂是为了吸收产生的氨气,下列最适宜的试剂是
(填序号);
①水②浓HCl③稀H2SO4④NaOH溶液
烧杯中干燥管的作用是。
交流讨论:
实验小组的同学认为,用上述实验装置测得的结果可能会出现
下列情况。
(1)甲同学认为:
应在实验装置A、B之间增加一个装有(填“浓硫酸"或“碱石灰”)的干燥装置,否则实验测得的硫酸铵化肥含氮量可能偏高。
(2)乙同学认为:
在实验装置A、B之间增加正确的干燥装置后进行实验,测得的硫酸铵化肥含氮量可能偏低,理由是。
实验测定:
经讨论后,他们改进了实验装置,排除了可能产生误差的因素,重新进行实验。
取硫酸铵化肥样品13.5g进行实验,测得B装置增重与反应时间的关系如右图所示。
请通过计算判断该化肥的等级。
计算过程:
该化肥的等级为品。
(同步练习)2.(08扬州)某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程:
(1)上述流程中,沉淀池中发生的主要化学反应为:
CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4,煅烧炉中发生的化学反应方程式为。
该工艺中可循环使用的X为(填化学式,下同),副产品Y为。
(2)操作b的过程是、冷却结晶、。
(三)、侯氏制碱工艺
例3(2008年镇江)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品与原理】该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:
将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱。
【生产流程】
【相关资料】
NH4Cl==NH3↑+HCl↑
已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
物质
NaCl
NaHCO3
NH4Cl
NH3
CO2
溶解度
36.0g
9.6g
37.2g
710
0.9
【问题讨论】:
⑴氨碱工业最关键的一步是:
在加压的条件下不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出。
试分析该流程需要加压条件的原因是:
。
(2)反应①中发生了两个反应,写出其中的化学方程式:
。
(3)溶液B中的溶质有。
(4)上述生产流程中可循环使用的是(填序号)。
A.挥发性气体CB.溶液DC.氢氧化镁D.化肥NH4Cl
(四)、海水提取镁工艺
例4、(2008年)(11分)镁合金的强度高、机械性能好。
这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。
海水提镁是国际上的主要趋势,工业流程图如下;
其步骤为:
I.将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳
Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀
Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O
Ⅳ.将MgCl2·6H2O在一定条件下加热得到无水MgCl2
V.电解熔融的无水MgCl2可得到Mg
(1)请根据上述步骤回答问题:
①写出步骤I、Ⅲ的有关化学方程式:
I.贝壳煅烧成生石灰
Ⅲ.Mg(OH)2沉淀中加入盐酸中和
②步骤I~V中有分解反应的是(填写步骤序号):
。
③步骤Ⅲ中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有、、酒精灯、带铁圈的铁架台、坩埚钳等。
④上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?
请写出其中一点:
。
某小组没计下列实验方案:
称取bg镁铝合金,与足量的稀盐酸完全反应。
欲计算镁的质量分数,该实验中还需测定的一种数据是
(同步练习)3.(9分)海水是一种重要的自然资源。
以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。
常用的操作方法是 。
(2)从海水中获得氯化钠。
将海水进行可得到粗盐;为除去粗盐中含有
的SO42-、Ca2+、Mg2+等杂质,有如下操作:
①溶解;②加过量的Na2CO3溶液;③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;
过滤。
正确的操作顺序是 。
(用序号填一种合理组合)。
(3)从海水中得到金属镁。
下图是从海水中提取镁的简单流程。
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
。
(4)海水“制碱”。
下图是海水“制碱”的部分简单流程。
步骤Ⅲ、步骤Ⅳ反应的化学方程式为:
、
。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。
如果反过来,二氧化碳的吸收率会降低。
这是因为 。
中考原题经典
1.(2010成都,16,12分)石笋和钟乳石的形成过程中会发生如下两个反应:
(a)CaCO3+CO2+H2O→Ca(HCO3)2(b)Ca(HCO3)2→CaCO3↓+CO2↑+H2O
下图中,A为单质,常温常压下C为气体,固态时可用于人工降雨。
D溶液为浅绿色,G是发酵粉的主要成分之一。
FG、GF的反应分别类似上述反应a与b。
(部分产物略去)
(1)推断:
F的俗名是____________;x的化学式是______________;
(2)A在氧气中燃烧的现象是____________________________________;
(3)比较反应b与反应⑧,推测反应b发生时的条件为_____________;
(4)写化学方程式:
反应③_______________________________________;
反应④_______________________________________。
(5)将x露置在空气中,其质量会___________(填“增大”、“减小”或“不变”);该现象是否符合质量守恒定律?
___________(填“符合”或“不符合”)。
(6)总结反应⑤、⑨、⑩的特点,可得出的结论是_____________________________________。
【知识模块】
在做实验流程题的过程中,要通过流程图及题目的信息中得到信息进行解答。
由于该类题型主要与高中的知识挂钩,且对于中考而言,算是一种新题型,故学生应该认真对待。
1.分析比较物质在组成、性质等方面的异同,可为物质的分离和鉴别提供依据。
⑴从组成上看,BaCl2、NaCl都含有元素,但BaSO4不含有;
⑵将BaSO4、BaCl2、NaCl三种固体组成的混合物溶于足量的水后,充分搅拌后过滤,留在滤纸上的固体是;
⑶根据BaCl2溶液和NaCl溶液中的金属离子不同,可用稀硫酸将NaCl溶液和BaCl2溶液鉴别开。
请写出稀硫酸和BaCl2反应的化学方程式;
⑷按如下方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是。
A.K2CO3B.Na2CO3C.Na2SO4
2.食盐是人们生活中不可缺少的调味剂,随着人们健康意识的提高,市场上出现
了“加碘盐”、“叶绿素锌钠盐”、“低钠盐”等。
某种低钠盐由NaCl、KCl、MgSO4三
种物质组成,用它进行以下实验(假设每步均恰好完全反应)。
(1)写出步骤①的化学方程式:
(2)当x是AgNO3时,白色沉淀C是,当x是NaOH时,白色沉淀C是
3.(2011南京市质检,27.10分)汽车作为一种常见交通工具,已走进千家万户。
请回答下列问题:
(1)目前汽车使用的燃料是汽油。
将石油加热,利用各成分的沸点不同将它们分离可得到汽油,该过程属于 变化。
我国已推广使用车用乙醇汽油,它是在汽油中加入适量的乙醇,
作为汽车的燃料。
下列叙述正确的是 。
(填字母)
A.乙醇汽油是一种新型的化合物B.乙醇可通过粮食发酵的方法制得
C.使用乙醇汽油能减少有害气体的排放D.乙醇和汽油都是可再生能源
(2)汽车尾气(含有CO、NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,使CO和NO反应,生成两种无毒气体,试写出CO与NO反应的化学方程式 。
(3)汽车生产过程中需要各种金属,其中用量最大的是铁和铝。
①工业上炼铁的简要流程如下:
请写出步骤Ⅰ、Ⅱ、Ⅲ的化学反应方程式 、
、。
②早在西汉时期,我国劳动人民就利用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”,即反应③,若用该方法制得铜16千克,理论上需要溶质质量分数为10%的硫酸铜溶液多少千克?
(写计算过程)