届陕西省黄陵中学高三重点班下学期开学考试化学试题附答案Word文档下载推荐.docx
《届陕西省黄陵中学高三重点班下学期开学考试化学试题附答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《届陕西省黄陵中学高三重点班下学期开学考试化学试题附答案Word文档下载推荐.docx(12页珍藏版)》请在冰豆网上搜索。
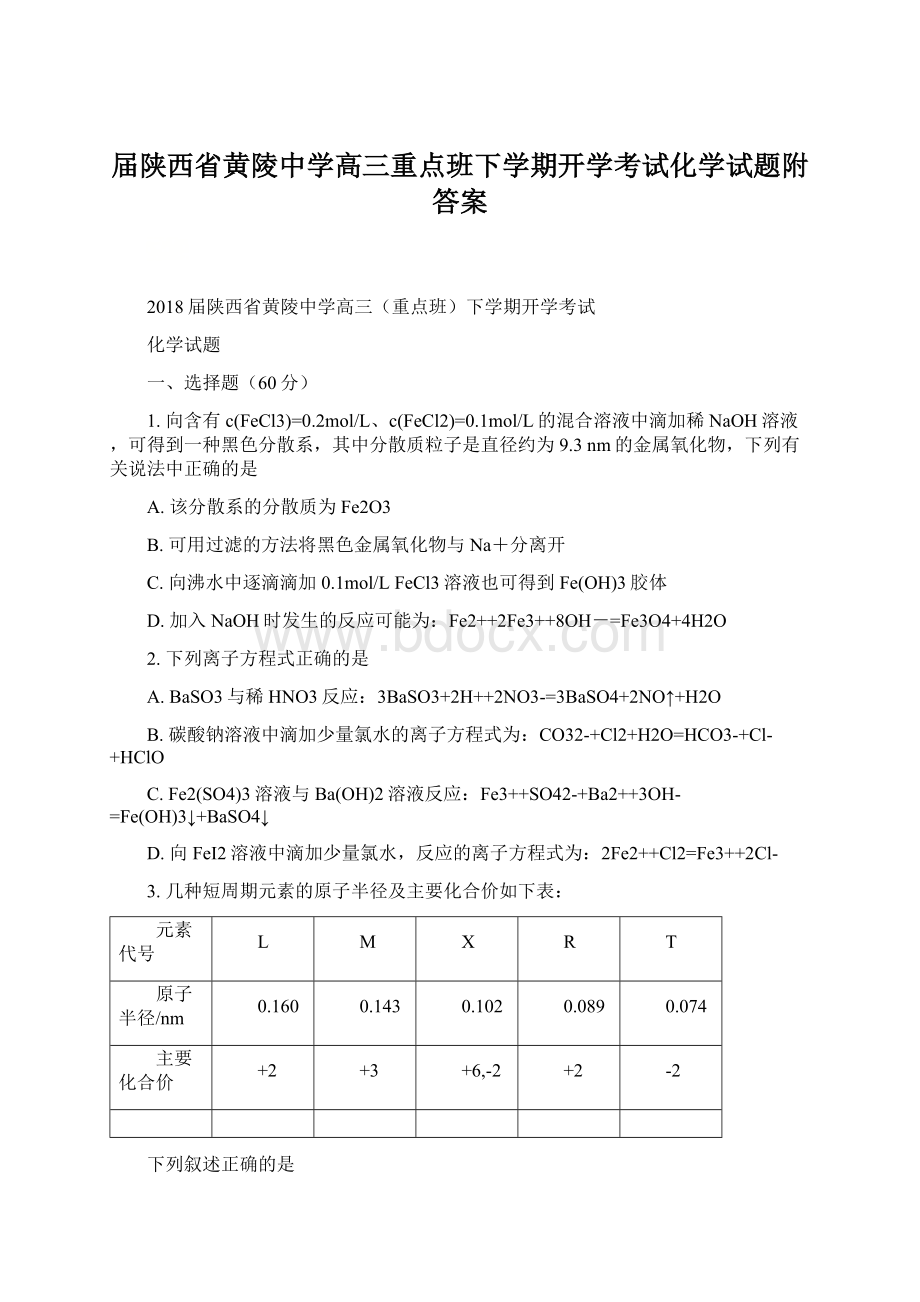
0.074
主要化合价
+2
+3
+6,-2
-2
下列叙述正确的是
A.离子半径大小r(M3+)>
r(T2-)B.R
的氧化物对应的水化物可能具有两性
C.X
单质在氧气中燃烧生成XO3D.L、T形成的简单离子核外电子数不相等
4.有一未完成的离子方程式:
(
)+XO3-+6H+=3X2+3H2O,据此判断下列说法错误的是
A.X
原子最外层电子数为5B.当有3molX2生成时,转移5mol
电子
C.氧化产物和还原产物的物质的量之比为5∶1D.“()”括号中所填的微粒为X-
5.下列实验预期的现象及结论都正确的是
选项
实验
预期现象
预期结论
A
将SO2
气体通入Ba(NO3)2溶液中
有白色沉淀生成
H2SO3与Ba(NO3)2发生复分解反应生成BaSO3
B
向盛有KI溶液的试管中,滴加少量新制氯水和CCl4,振荡、静置
下层溶液显紫色
Cl2氧化性比I2强
C
铜放入稀硫酸中,无明显现象,再加入硝酸钠固体
溶液变蓝,有明显的气泡放出,铜溶解
硝酸钠可以加快铜与稀硫酸的反应速率,起到了催化剂的作用
D
向FeCl3饱和溶液中逐滴滴入足量浓氨水,并加热至沸腾
生成红褐色透明液体
得到Fe(OH)3胶体
A.AB.BC.CD.D
6.化学与人们的生产、生活息息相关.下列有关说法正确的是( )
A.煤的干馏和石油的分馏都属于化学变化
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察其是否变蓝
D.铝制容器不宜用来长时间存放酸性和碱性食物,也不可长时间存放含盐腌制食品
7.设NA为阿伏伽德罗常数的值,下列叙述正确的是()
A.11gT2O含有的电子数为5NA
B.常温下,0.2L0.5molL﹣1NH4NO3溶液的氮原子数小于0.2NA
C.含4molHCl的浓盐酸与足量二氧化锰反应转移的电子总数为NA
D.标准状况下,2.24LH2S全部溶于水所得溶液中HS﹣和S2﹣离子数之和为0.1NA
8.根据海水综合利用的工业流程图(如图),判断下列说法正确的是( )
A.过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质
B.在过程③中将MgCl2·
6H2O真接灼烧即可制得纯净无水MgCl2
C.过程⑥所得的高浓度溴水只需分液即可获得液溴
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀间题
9.铅、二氧化铅、氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为Pb+PbO2+4HBF4
2Pb(BF4)2+2H2O[已知:
HBF4、Pb(BF4)2均是易溶于水的强电解质].下列说法中不正确的是( )
A.充电时,阳极附近溶液的pH增大
B.充电时,阴极的电极反应式为pb2++2e﹣═pb
C.放电时,转移1mol电子时负极减少的质量为103.5g
D.放电时,正极的电极反应式为PbO2+2e﹣+4H+═pb2++2H2O
10.下列有关材料的说法错误的是()
A.铝制品表面有一层致密的氧化膜B.二氧化硅常用于制造光导纤维
C.实验室中经过滤可得到纳米碳酸钙固体D.聚乙烯可作食品包装材料
11.下列反应属于加成反应的是()
A.
+NaCN
+NaBrB.
+Br2
C.
+CH3OH
+H2OD.
+H2O
12.NA表示阿伏加德罗常数的数值。
下列说法正确的是()
A.在标准状况下,11.2L丙烷含极性键数目为5NA
B.7g锂在空气中完全燃烧时转移电子数为NA
C.1mol葡萄糖(C6H12O6)分子含羟基数目为6NA
D.1L0.1mol·
L-1NaHC2O4溶液中HC2O4-与C2O42-数目之和为0.1NA
13.短周期主族元素A、B、C、D的原子序数依次增大。
己知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是
A.简单离子的半径:
B>
C>
D>
AB.B与C形成的化合物在水溶液中能稳定存在
C.C与D不可能形成化合物C2D2D.B与D形成的化合物溶于水所得溶液显酸性
14.下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是
现象
结论或解释
向黄色的Fe(NO)3溶
液中滴加氢碘酸
溶液变为紫红色
氧化性:
Fe3+>
I2
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落下来
铝箔表面有致密Al2O3薄膜,
A12O3且熔点高于Al
向新收集的酸雨中滴加硝酸钡溶液
产生白色沉淀
酸雨中一定含有SO42-
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
15.下列说法正确的是
A.0.1mol/LpH为4的NaHB溶液中:
c(HB-)>
c(H2B)>
c(B2-)
B.如图表示25℃时,用0.1mol·
L-1盐酸滴定20mL0.1mol·
L-1NaOH溶液时,溶液的pH随加入酸体积的变化
C.在pH=2的NaHSO4溶液中c(H+)=c(OH-)+c(SO42-)
D.pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·
L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>
Vy
16.化学与生活、社会发展息息相关,下列有关说法不正确的是
A.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
D.“外观如雪,强烧之,紫青烟起”,该过程中利用了焰色反应
17.下列叙述不正确的是
A.用电子式表示HCl的形成过程:
B.
Ho中的原子核内的中子数是99
C.在空气中加热金属锂:
4Li+O2
2Li2O
D.溴化铵的电子式:
18.下列各组离子在指定条件下可能大量共存的是
A.常温下水电离出的c(H+)水·
c(OH-)水=10-20的溶液中:
Na+、Cl-、S2-、SO32-
B.能与金属铝反应放出氢气的溶液中:
K+、NO3-、Cl-、NH4+
C.不能使酚酞试液变红的无色溶液中:
Na、CO32-、K+、ClO-
D.无色透明溶液:
K+、HCO3-、NO3-、SO42-、Fe3+
19.化学与生产和生活紧密相关,下列说法不正确的是( )
A.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B.家庭用的“84”消毒液与洁厕灵能混合使用,不会发生中毒事故
C.可用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气
D.硅胶可用作食品干燥剂
20.体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子不可能共平面
D.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol和7mol
二、非选择题(40分)
21.氮化镓(GaN)被称为第三代半导体材料,其应用已经取得了突破性的进展。
(9分)
已知:
(i)氮化镓性质稳定,不与水、酸反应,只在加热时溶于浓碱。
(ii)NiCl2溶液在加热时,先转化为Ni(OH)2,后分解为NiO。
(iii)制备氮化镓的反应为:
2Ga+2NH3
2GaN+3H2
某学校化学兴趣小组实验室制备氮化镓,设计实验装置如图所示:
设计实验步骤如下:
①滴加几滴NiCl2溶液润湿金属镓粉末,置于反应器内。
②先通入一段时间后的H2,再加热。
③停止通氢气,改通入氨气,继续加热一段时间。
④停止加热,继续通入氨气,直至冷却。
⑤将反应器内的固体转移到盛有盐酸的烧杯中,充分反应过滤、洗涤、干燥。
(1)仪器X中的试剂是___________,仪器Y的名称是__________________。
(2)指出该套装置中存在一处明显的错误是________________________。
(3)步骤①中选择NiCl2溶液,不选择氧化镍的原因是____________________。
a.增大接触面积,加快化学反应速率
b使镍能均匀附着在镓粉的表面,提高催化效率
c.为了能更好形成原电池,加快反应速率
(4)步骤③中制备氮化镓,则判断该反应接近完成时观察到的现象是____________________。
(5)请写出步骤⑤中检验产品氮化镓固体洗涤干净的操作________________________。
(6)镓元素与铝同族,其性质与铝类似,请写出氮化镓溶于热NaOH溶液的离子方程式:
______________________。
22.钛工厂TiCl4烟尘中含有大量的ScCl3、MgCl2及SiO2小颗粒等物质,某研究所利用上述烟尘回收Sc2O3,并制备钛白粉(TiO2),其工艺流程如下所示:
(12分)
(1)酸浸过程中,HCl的作用是_______________________。
(2)已知Sc3++3HTBP
Sc(TBP)3+3H+,则上述洗脱剂最好选择___________(选填“酸性”、“碱性”或“中性”)溶液。
在实验室模拟完成上述操作Ⅰ和操作Ⅱ所涉及的玻璃仪器有______________。
(3)草酸“沉钪”得到草酸钪的化学反应类型为____________________________。
(4)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为__________________________。
(5)“水相”的主要离子有TiOCl42-、H+、Cl-及________,写出加入大量的水并加热发生的相关离子反应方程式__________________________。
(6)钛的冶炼新法是剑桥电解法(如右图)。
以含少量CaCl2的CaO熔融物作为介质,电解时。
在阴极生成的Ca进一步还原TiO2得钛。
写出阳极电极主要反应方程式:
__________________________;
利用中学所学知识可以预测CaCl2的作用包含增强导电性、___________;
F=96500C/mol,当I=0.5A,通电80分钟,理论上获得Ti的质量为__________g(计算表达式)。
23.硫的化合物是常用的化工原料,但也是大气的主要污染物。
综合治理其污染是环境化学当前的重要研究内容之一。
(10分)
(1)一定温度下,将NH4HS固体放入定容真空容器中,可部分分解为硫化氢和氨气:
NH4HS(s)
H2S(g)+NH3(g)
①可以判断上述分解反应已经达到化学平衡的是_____________(选填字母)
A.
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变
②当上述反应达平衡时:
p(NH3)×
p(H2S)=a(Pa2),则平衡时容器中的总压为_______________Pa(用含a的代数式表示);
(p(NH3)、p(H2S)分别代表NH3、H2S的压强,Pa为压强的单位)
③实验测得不同温度下的平衡数据列于下表:
温度(℃)
15.0
20.0
25.0
30.0
35.0
平衡气体总浓度(×
10-3mol/L)
2.4
3.4
4.8
6.8
9.4
NH4HS分解反应的焓变△H_________0(填“>
”、“=”或“<
”)
④
下图是上述反应过程中生成物浓度随时间变化的示意图。
若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后硫化氢、氨气的浓度随时间的变化曲线.(要有必要标注)____________
(2)一定温度下,反应2SO2+O2
2SO3,达到平衡时,n(SO2):
n(O2):
n(SO3)=2:
3:
4。
缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是____________。
(3)25℃,吸收液Na2SO3溶液在吸收SO2的过程中,pH随n(SO3²
-):
n(HSO3﹣)变化关系如下表:
n(SO32﹣):
n(HSO3﹣)
91:
9
1:
1
91
pH
8.2
7.2
6.2
①当吸收液呈中性时,溶液中离子浓度关系正确的是:
______(选填字母)
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>
c(HSO3-)>
c(SO32-)>
c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
②当吸收液的pH降至约为6时,需送至电解槽再生。
再生示意图如下,请写出HSO3-在阳极放电的电极反应式是___________________。
(4)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-Q1kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-Q2kJ/mol
2H2(g)+O2(g)=2H2O(l)△H=-Q3kJ/mol,
常温下,取体积比4:
1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为_______________________。
24.化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z:
(9分)
①化合物A的结构中有2个甲基
②RCOOR′+R′′CH2COOR′
请回答:
(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是__________,反应类型是___________。
(4)能与NaOH反应的G的同分异构体有_____种
(5)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)_________。
答案
DABABDADACBBDBCBDABD
21.【答案】
(1).浓氨水
(2).球形干燥管(3).装置F中会产生倒吸(4).ab(5).装置F中几乎不再产生气泡(6).取最后的一次洗涤液于试管中,滴加AgNO3溶液,若无白色沉淀,则证明产品氮化镓固体已洗涤干净(7).GaN+OH-+H2O
GaO
+NH3↑
22.【答案】
(1).抑制TiOCl42-的进一步水解(多答Mg2+、Sc3+水解亦给分)
(2).酸性(3).分液漏斗、烧杯(4).复分解反应(5).3O2+2Sc2(C2O4)3
2Sc2O3+12CO2(6).Mg2+(7).TiOCl42-+(1+x)H2O
TiO2·
xH2O+2H++4Cl-(8).2O2--4e-=O2↑(9).降低CaO的熔点(10).
23.【答案】
(1).BC
(2).
(3).>
(4).
(5).0.4mol(6).AB(7).HSO3--2e-+H2O=SO42-+3H+(8).0.4Q1+0.05Q3
24.【答案】
(1).CH2=CH2
(2).羟基(3).
(5).取代反应(6).28(7).取适量试样于试管中,先用NaOH中和,再加入新制氢氧化铜悬浊液,加热,若产生砖红色沉淀则有B存在