高三化学二轮复习非选择题专题练四Word文件下载.docx
《高三化学二轮复习非选择题专题练四Word文件下载.docx》由会员分享,可在线阅读,更多相关《高三化学二轮复习非选择题专题练四Word文件下载.docx(11页珍藏版)》请在冰豆网上搜索。
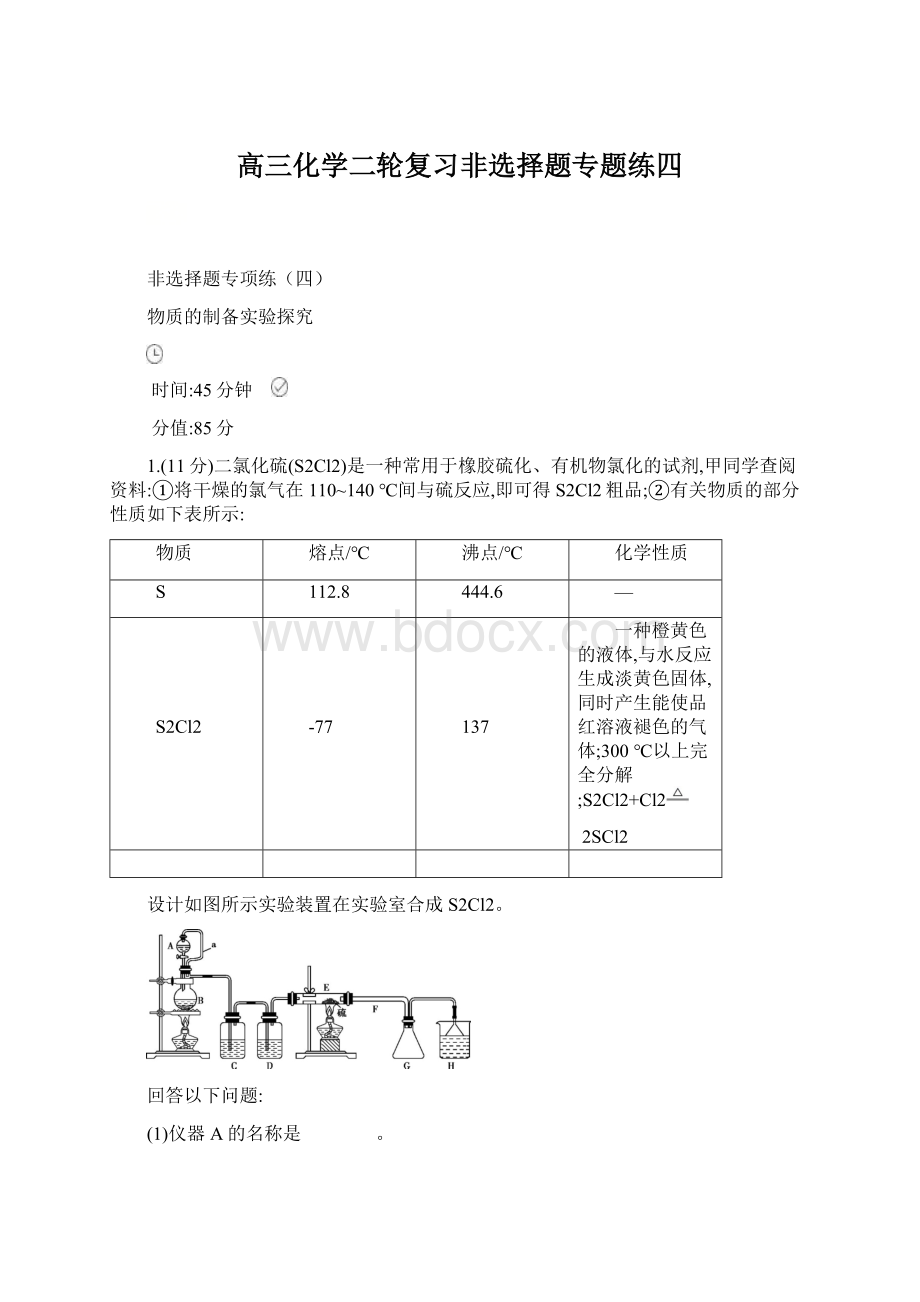
(2)B中所发生反应的离子方程式为 。
(3)C装置的作用是 。
(4)S2Cl2粗品中可能混有的杂质是 。
(5)乙同学发现,该装置中除了E处的温度不能过高外,还有一处重大缺陷需改进,否则会导致S2Cl2的产率大大降低,原因是 (用化学方程式表示);
请简要提出改进方案 。
(6)H中的溶液可以选择下列试剂中的 (填序号)。
①碳酸钠溶液②氯化铁溶液
③亚硫酸钠溶液④高锰酸钾溶液
2.(15分)Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置如图所示。
回答下列问题:
(1)C仪器的名称是 ;
FeCO3在 中生成(填字母),该装置中发生的主要反应的离子方程式为 。
(2)实验时首先打开活塞3,关闭活塞2,其目的是 ,然后关闭活塞3,打开活塞2,其目的是 。
Ⅱ.乳酸亚铁晶体([CH3CH(OH)COO]2Fe·
3H2O,Mr=288)是常用的补铁剂。
乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应。
结束后,无需过滤,除去过量铁粉的反应方程式为
。
(4)从上述(3)所得溶液中获得乳酸亚铁晶体的方法是 、 、洗涤、干燥。
(5)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数。
发现产品的质量分数总是大于100%,其原因可能是
。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。
取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·
L-1的Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2标准溶液19.70mL。
滴定反应为Ce4++Fe2+
Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为 。
3.(15分)酯化反应是有机化学中一种重要的反应类型,某化学兴趣小组通过酯化反应,以苯甲酸和甲醇为原料合成苯甲酸甲酯,其原理与实验装置如图(部分夹持装置以及加热装置已省略):
+CH3OH
+H2O
可能用到的数据如下:
苯甲酸
甲醇
苯甲酸甲酯
122.4
-97
-12.3
249
64.3
199.6
相对密度/(g·
cm-3)
1.2659
0.792
1.0888
水溶性
微溶
互溶
不溶
(1)仪器B的名称是 。
(2)实验前仪器B中加入适量的碎瓷片,作用是 ,冷水应从仪器C的 (填“a”或“b”)口进入。
(3)实验开始时,将15g苯甲酸和过量的甲醇加入仪器B中,通过仪器A加入一定量浓硫酸,浓硫酸的作用为 ;
为了提高酯的产率,可以采取的措施有 (写两条)。
(4)利用下列步骤提纯产品:
①加适量水后分液;
②加适量固体Na2CO3分液;
③加无水CaCl2干燥;
④蒸馏得产品10.9g。
分液过程中,使目标产物离开相应仪器的操作是 ;
洗涤过程中加入碳酸钠的目的是 ;
进行蒸馏提纯时,收集 ℃时的馏分即为苯甲酸甲酯;
实验制得的苯甲酸甲酯的质量低于理论产量,可能的原因是 (填序号)。
a.蒸馏时,从100℃开始收集产品
b.苯甲酸实际用量多了
c.制备粗品时苯甲酸甲酯蒸发
(5)本实验的产率是 (保留一位小数)。
4.(16分)无水MgBr2可用作催化剂。
实验室采用镁屑与液溴为原料制备无水MgBr2,装置如下图,主要步骤如下:
步骤1 三颈烧瓶中装入10g镁屑和150mL无水乙醚;
装置B中加入15mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈烧瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:
①Mg与Br2反应剧烈放热;
MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5
MgBr2·
3C2H5OC2H5。
请回答:
实验中不能用干燥空气代替干燥N2,原因是
。
(2)如将装置B改为装置C,可能会导致的后果是
。
(3)步骤3中,第一次过滤除去的物质是 。
(4)有关步骤4的说法,正确的是 。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式为:
Mg2++Y4-
MgY2-
①滴定前润洗滴定管的操作方法是
。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol·
L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是 (以质量分数表示)。
5.(14分)四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。
实验室制备四氯化锡的操作是将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中,再向反应器中缓慢地通入干燥的氯气。
Ⅰ.图甲是实验室制备干燥氯气的实验装置(夹持装置已略)。
甲
(1)A仪器的名称为 ,该装置制备氯气选用的药品为漂粉精固体[有效成分为Ca(ClO)2]和浓盐酸,B中发生反应的化学方程式为
。
(2)装置C中饱和食盐水的作用为 ;
同时装置C亦是安全瓶,能检测实验进行时D中是否发生堵塞,请写出发生堵塞时C中的现象:
。
(3)试剂X可能为 (填写字母)。
A.无水氯化钙B.浓硫酸
C.碱石灰D.五氧化二磷
(4)四氯化锡在潮湿空气中水解的化学方程式为 。
(5)用锡花代替锡粒的目的是 。
Ⅱ.图乙是蒸馏SnCl4的装置。
乙
(6)①蒸馏前若发现烧瓶中液体呈黄色,可采取的措施是 。
②该装置尚有两处不当之处,它们分别是 , 。
③写出Ⅲ中发生反应的离子方程式:
。
6.(14分)我国化工专家侯德榜改革了国外的纯碱生产工艺,其生产流程可简要表示如下:
(1)沉淀池中发生反应的化学方程式是 。
(2)上述流程中X物质的分子式是 。
(3)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(4)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:
将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
①甲中发生反应的离子方程式是 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
第二位同学:
用图中戊装置进行实验(其他装置未画出)。
④为提高二氧化碳在此反应液中被吸收的程度,实验时,须先从a管通入 ,再从b管中通入 。
⑤装置c中的试剂为 (选填字母)。
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学方程式来描述):
。
答案精解精析
1.
答案
(1)分液漏斗(1分)
(2)MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O(2分)
(3)除去Cl2中的HCl杂质(1分)
(4)S、SCl2、Cl2(2分)
(5)2S2Cl2+2H2O
3S↓+SO2↑+4HCl(2分) 在G和H之间增加干燥装置(如盛有浓硫酸的洗气瓶)(1分)
(6)①③(2分)
解析
(1)由装置图可知A为分液漏斗。
(2)在B中制取氯气,离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O。
(3)在E中干燥纯净的Cl2与S发生反应,而B中制取的Cl2中含有HCl和水蒸气,故C中盛有饱和食盐水以除去HCl,D中盛有浓硫酸以干燥氯气。
(5)观察装置图可知,H中的水蒸气可进入G中,发生反应:
2S2Cl2+2H2O
3S↓+SO2↑+4HCl,导致S2Cl2产率降低,可在G和H之间增加干燥装置。
(6)H是除氯气的装置,氯化铁和高锰酸钾都不与氯气反应。
2.
答案
(1)三颈烧瓶(1分) C(1分)
Fe2++2HC
FeCO3↓+CO2↑+H2O(2分)
(2)排出装置中的空气,防止+2价铁被氧化(2分) 使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中(2分)
(3)2CH3CH(OH)COOH+Fe
[CH3CH(OH)COO]2Fe+H2↑(1分)
(4)冷却结晶(1分) 过滤(1分)
(5)乳酸根离子中含有羟基,能被酸性高锰酸钾溶液氧化(2分) 98.5%(2分)
解析
(1)由C仪器的结构特征可知C为三颈烧瓶。
FeCO3在C中生成,FeCl2和NH4HCO3发生反应的离子方程式为Fe2++2HC
FeCO3↓+CO2↑+H2O。
(2)实验时首先打开活塞3,关闭活塞2,其目的是排出装置中的空气,防止+2价铁被氧化;
然后关闭活塞3,打开活塞2,其目的是使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
(3)除去过量的铁粉可直接加入适量的乳酸,反应方程式为2CH3CH(OH)COOH+Fe—→[CH3CH(OH)COO]2Fe+H2↑。
(4)在75℃下搅拌,充分反应制得乳酸亚铁,从热溶液中获得乳酸亚铁晶体,应经过冷却结晶、过滤、洗涤、干燥等操作。
(5)乳酸根离子中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗酸性高锰酸钾溶液的量增多,故乳酸亚铁晶体的质量分数总是大于100%;
由Ce4++Fe2+
Ce3++Fe3+可得,20.00mL溶液中n(Fe2+)=n(Ce4+)=0.1000mol·
L-1×
0.0197L=0.00197mol,故100mL溶液中含有n(Fe2+)=0.00197mol×
=0.00985mol,故产品中乳酸亚铁晶体的质量分数为
×
100%=98.5%。
3.
答案
(1)三颈烧瓶(1分)
(2)防止暴沸(1分) a(1分)
(3)作催化剂、吸水剂(2分) 增大甲醇的用量、将生成的苯甲酸甲酯及时蒸出等(只要合理就给分,2分)
(4)从分液漏斗的下口放出(1分) 除去多余的硫酸和未反应的苯甲酸(2分) 199.6(2分) c(1分)
(5)65.2%(2分)
解析
(2)加入碎瓷片可以防止暴沸。
冷凝管下口进水,上口出水,冷凝效果更好。
(3)浓硫酸在酯化反应中,一方面起到催化作用,另一方面可以吸收反应生成的水,有利于反应向生成酯的方向进行。
(4)由于苯甲酸甲酯的密度比水大,故苯甲酸甲酯应从分液漏斗的下口放出。
(5)15g苯甲酸完全反应,理论上应生成16.72g苯甲酸甲酯,所以产率为10.9g÷
16.72g×
100%≈65.2%。
4.
答案
(1)干燥管(2分) 防止镁屑与氧气反应,生成的MgO阻碍Mg与Br2的反应(2分)
(2)会将液溴快速压入三颈烧瓶,反应过快大量放热而存在安全隐患(3分)
(3)镁屑(2分)
(4)BD(2分)
(5)①从滴定管上口加入少量待装液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2~3次(3分)
②97.5%(2分)
解析
(1)空气中含有氧气,Mg与Br2反应放热,会导致镁屑被氧气氧化,同时生成的MgO会阻碍Mg与Br2的反应。
(2)装置B可使液溴挥发,溴蒸气随氮气进入三颈烧瓶中,而装置C则会导致锥形瓶内气压增大,将液溴快速压入三颈烧瓶中,使反应过快大量放热而存在安全隐患。
(3)由题意可知第一次过滤时,产品未析出,故第一次过滤除去的是未反应的镁屑。
(4)MgBr2具有强吸水性,95%的乙醇中仍含有少量的水,A项不正确;
0℃时晶体能析出,说明0℃时晶体在苯中的溶解度较小,B项正确;
加热至160℃是让三乙醚合溴化镁转化为MgBr2,C项不正确;
乙醚、液溴均易溶于苯中,步骤4可除去杂质得到高纯度的MgBr2,D项正确。
(5)②n(MgBr2)=n(Mg2+)=n(Y4-)=0.0500mol·
(26.50×
10-3L)=(1.325×
10-3mol),产品的纯度=
100%≈97.5%。
5.
答案
(1)分液漏斗(1分) Ca(ClO)2+4HCl(浓)
CaCl2+2Cl2↑+2H2O(2分)
(2)除去Cl2中的HCl(1分) 长颈漏斗中液面上升,形成水柱(1分)
(3)AD(1分)
(4)SnCl4+2H2O
SnO2+4HCl↑(2分)
(5)增大与氯气的接触面积,加快反应速率(1分)
(6)①加入锡花(1分)
②温度计水银球位置不对(1分) Ⅱ和Ⅲ之间缺少干燥装置(1分)
③Cl2+2OH-
Cl-+ClO-+H2O(2分)
解析
(1)A仪器为分液漏斗;
Ca(ClO)2和浓盐酸反应制备氯气的化学方程式为Ca(ClO)2+4HCl(浓)
CaCl2+2Cl2↑+2H2O。
(2)浓盐酸易挥发,制得的氯气中含有杂质HCl,饱和食盐水的作用是除去Cl2中的HCl;
若D中发生堵塞,C中压强增大,长颈漏斗中液面上升,形成水柱。
(3)试剂X为干燥剂,起到干燥氯气的作用,无水氯化钙、浓硫酸和五氧化二磷均不与Cl2反应,可以干燥Cl2,而装置D为U形管,应盛放固体干燥剂,故选择无水氯化钙或五氧化二磷。
(4)SnCl4水解产生白色烟雾,烟为SnO2,雾为HCl与空气中的水蒸气形成的盐酸小液滴,故四氯化锡在潮湿空气中水解的化学方程式为SnCl4+2H2O
SnO2+4HCl↑。
(5)用锡花代替锡粒,可以增大锡与氯气的接触面积,加快反应速率。
(6)①蒸馏前若烧瓶中液体呈黄色,说明含有氯气,氯气可与锡花反应,故可采取的措施是加入锡花。
②蒸馏时温度计测量的是馏分的温度,四氯化锡(SnCl4)在潮湿的空气中易水解,故该装置的不当之处是温度计水银球位置不对、Ⅱ和Ⅲ之间缺少干燥装置。
③Ⅲ中NaOH溶液吸收Cl2,反应的离子方程式为Cl2+2OH-
Cl-+ClO-+H2O。
6.
答案
(1)NH3+CO2+H2O+NaCl
NH4Cl+NaHCO3↓(或NH3+CO2+H2O
NH4HCO3,NH4HCO3+NaCl
NaHCO3↓+NH4Cl)(2分)
(2)CO2(1分)
(3)c(1分)
(4)①CaCO3+2H+
Ca2++CO2↑+H2O(2分)
②饱和NaHCO3溶液(1分) ③过滤(1分)
④NH3(氨)(1分) CO2(二氧化碳)(1分) ⑤C(2分)
(5)用碳酸氢铵与适量饱和食盐水反应:
NH4HCO3+NaCl
NaHCO3↓+NH4Cl(或向NaOH溶液中通入过量CO2:
NaOH+CO2
NaHCO3;
向饱和Na2CO3溶液中通入CO2:
Na2CO3+CO2+H2O
2NaHCO3等。
其他合理方法均可)(2分)
解析 根据制备纯碱(Na2CO3)的生产工艺流程图可知,沉淀池中发生的反应为NaCl+NH3+CO2+H2O
NaHCO3↓+NH4Cl,煅烧NaHCO3可制得纯碱(Na2CO3):
2NaHCO3
Na2CO3+CO2↑+H2O。
(4)④由于CO2在水中的溶解度小于NH3,因此要制得NaHCO3,应先向饱和食盐水中通入NH3,后通入CO2。