单克隆抗体的制备文档格式.docx
《单克隆抗体的制备文档格式.docx》由会员分享,可在线阅读,更多相关《单克隆抗体的制备文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
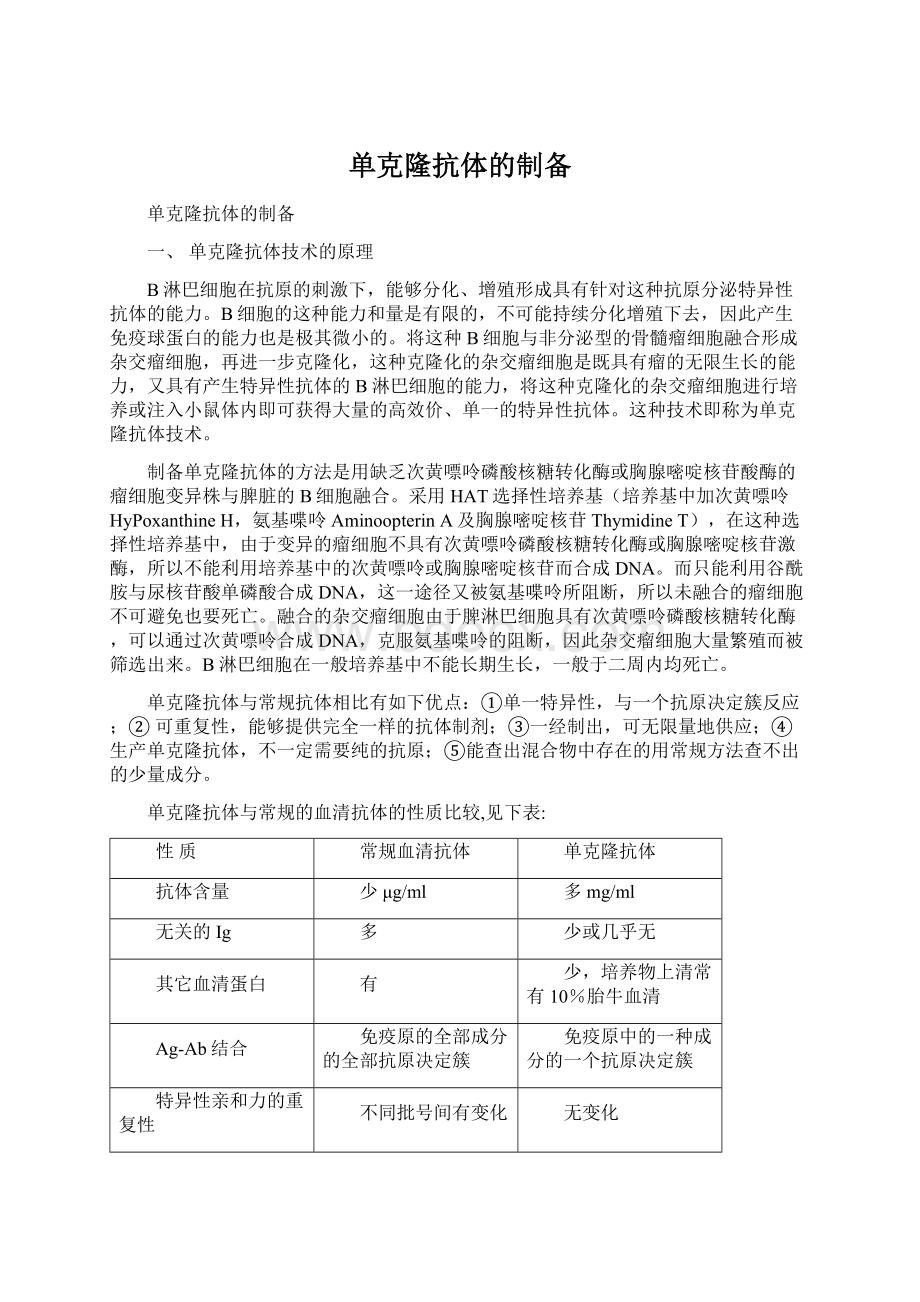
无变化
与其它抗原的交叉反应
与带有共同抗原决定簇的抗原有部分交叉
一般无。
结合到共同决定簇则是完全的
免疫球蛋白的种类与亚类
完全是混合的
只是一种或几种
免疫球蛋白的物理性质
典型光谱
抗体的单一性质
在开展杂交瘤细胞技术制备单抗之前,培养骨髓瘤和杂交瘤细胞必须具备下列设备:
主要仪器:
超净工作台、CO2恒温培养箱、超低温冰箱(-70℃)、倒置显微镜、精密天平或电子天平、液氮罐、离心机(水平转子,4000r/min)、37℃水浴箱、纯水装置、滤器、真空泵等。
主要器械:
100ml、50ml、25ml细胞培养瓶,10ml、1ml刻度吸管,试管,滴管(弯头、直头),平皿,烧杯,500ml、250ml、100ml盐水瓶,青霉素小瓶,10ml、5ml、1ml注射器等,96孔、24孔细胞培养板,融合管(50ml圆底带盖玻璃或塑料离心管),眼科剪刀,眼科镊,血细胞计数板,可调微量加样器(~50ul,~200ul,~1000ul),弯头针头,200目筛网,小鼠固定装置等。
杂交瘤细胞的筛选与检测的仪器设备等。
二、制备单克隆抗体的基本技术流程
1、抗原制备
从纯度上说虽不要求很高,但高纯度的抗原使得到所需单抗的机会增加,同时可以减轻筛选的工作量。
因此,免疫抗原是越纯越好,应根据所研究的抗原和实验室的条件来决定。
一般来说,抗原的来源有限,或性质不稳定,提纯时易变性,或其免疫原性很强,或所需单抗是用于抗原不同组分的纯化或分析等,免疫用的抗原只需初步提纯甚至不提纯,但抗原中混杂物很多,特别是如果这些混杂物的免疫原性较强时,则必须对抗原进行纯化。
检测用抗原可以是与免疫抗原纯度相同,也可是不同的纯度,这主要决定于所用筛检方法的种类及其特异性和敏感性。
2、动物免疫
免疫动物的选择根据所用的骨髓瘤细胞可选用小鼠和大鼠作为免疫动物。
因为,所有的供杂交瘤技术用的小鼠骨髓瘤细胞系均来源于BALB/c小鼠,所有的大鼠骨髓瘤细胞都来源于LOU/c大鼠,所以一般的杂交瘤生产都是用这两种纯系动物作为免疫动物。
但是,有时为了特殊目的而需进行种间杂交,则可免疫其他动物。
Balb/c系小白鼠必须用纯系的,雌雄均可,以8~12周龄为宜。
免疫程序的确定一般而言,抗原的纯度不很重要,特别是免疫原性较强的抗原。
免疫程序、剂量和方法是关系到是否能得到所需要的单克隆抗体的关键之一。
正常小鼠脾脏含有能产生各种不同抗体的B淋巴细胞,一只纯种小白鼠估计能产生1.0×
107~5.0×
107种不同的抗体。
因此一只正常的小白鼠的脾细胞与小鼠骨髓瘤融合,只能有千万分之一的机会获得某一种特定抗体。
所以为了提高得到某种杂交瘤的机会,必须加强免疫,使产生特异性抗体的B淋巴细胞大量增加。
B淋巴细胞的不同发育阶段对获得阳性杂交瘤也有很大影响。
有人认为处在转化时期的B淋巴细胞可能更易于融合,而免疫以后7~8天,虽然是抗体产生的高峰时期,但形成有活力的杂交瘤细胞的可能反而减少。
故一般认为加强免疫后的第三天应杀鼠取脾做细胞融合。
1.可溶性抗原(蛋白质)以1mg/ml~5mg/ml的溶液加等量的弗氏完全佐剂乳化,分多点小鼠皮下注射,总量为0.3ml~0.6ml,间隔3~5周再同样注射一次,10天后,断尾取血一滴,测抗体效价,选滴度高的小鼠做融合试验。
一个月后可以经静脉(尾静脉)给予无佐剂抗原0.2ml~0.4ml,3~4天后,杀死小鼠取脾做融合用。
2.颗粒性抗原如抗原来源方便,可以不加佐剂而增加免疫次数,缩短间隔时间。
例如用羊红血球免疫小白鼠,以1%浓度每只皮下注射0.2ml,每周2次,共免疫5~8次,取脾前3天,再免疫一次即可。
有人认为最后一次免疫剂量要大,大到近于免疫耐受的程度更好。
3、细胞融合
细胞融合是杂交瘤技术的中心环节,基本步骤是将两种细胞混合后加入PEG使细胞彼此融合。
其后把培养液稀释PEG,消除PEG的作用。
将融合后的细胞适当稀释,分置培养板孔中培养。
融合过程中有几个问题应特别注意。
①细胞比例:
骨髓瘤细胞与脾细胞的比值可从1:
2到1:
10不等,常用1:
4的比例。
应保证两种细胞在融合前都具有较高活性。
②反应时间:
在两种细胞的混合细胞悬液中,第1min滴加4.5ml培养液;
间隔2min滴加5ml培养液,尔后加培养液50ml。
③培养液的成分:
对融合细胞,良好的培养液尤其重要,其中的小牛血清、各种离子和营养成分均需严格配制。
如融合效率降低,应随时核查培养基情况。
(1)主要试剂的配制
细胞培养基:
主要有RPMI-1640或DMEM两种基础培养基
培养基种类
培养基成分
不完全RPMI-1640培养基
RPMI-1640培养基原液96ml、100×
L.G.溶液、1ml双抗溶液1ml、7.5%NaHCO3溶液1-2ml
HEPES溶液1ml
不完全DMEM培养基
DMEM13.37g、超纯水或四蒸水980ml、NaHCO33.7g、双抗溶液10ml、100×
L.G.溶液10ml
完全RPMI-1640或DMEM培养基
不完全RPMI-1640或DMEM培养基80ml、小牛血清15-20ml
HT培养基
完全RPMI-1640或DMEM培养基99ml、HT贮存液1ml
HAT培养基
完全RPMI-1640或DMEM培养基98ml、HT贮存液1ml,A贮存液1ml.
溶液种类
配置方法
氨基喋呤(A)贮存液(100×
,4×
10-5mol/L)
称取1.76mg氨基喋呤(AminopterinMW440.4),溶于90ml超纯水或四蒸水中,滴加1mol/LNaOH0.5ml中和,再补加超纯水或四蒸水至100ml。
过滤除菌,分装小瓶(2ml/瓶),-20℃保存。
次黄嘌呤和胸腺嘧啶核苷(HT)贮存液(100×
H:
10-2mol/L,T:
1.6×
10-3mol/L)
称取136.1mg次黄嘌呤(Hypoxanthine,MW136.1)和38.8mg胸腺嘧啶核苷(Thymidine,MW242.2),加超纯水或四蒸水至100ml,置45-50℃水浴中使完全溶解,过滤除菌,分装小瓶(2ml/瓶),-20℃冻存。
用前可置37℃加温助溶。
L-谷氨酰胺(L.G.)溶液(100×
,0.2mol/L)
称取2.92gL-谷氨酰胺(L-glutamine,MW146.15),用100ml不完全培养液或超纯水(或四蒸水)溶解,过滤除菌,分装小瓶(4-5ml/瓶),-20℃冻存。
青、链霉素(双抗)溶液(100×
)
取青霉素G(钠盐)100万单位和链霉素(硫酸盐)1g,溶于100ml灭菌超纯水或四蒸水中,分装小瓶(4-5ml/瓶),-20℃冻存。
7.5%NaHCO3溶液
称取分析纯NaHCO37.5g,溶于100ml超纯水或四蒸水中,过滤除菌,分装小瓶(4-5ml/瓶),盖紧瓶塞,4℃保存。
HEPES溶液(1mol/L)
称取23.83gHEPES(N-2-Hydroxyethylpiperazine-N,-2-ethanesulfonicacid,N-2-羟乙基哌嗪-N,-2-乙基磺酸,MW238.3)溶于100ml超纯水或四蒸水中,过滤除菌,分装小瓶(4-5ml/瓶),4℃保存。
8-氮鸟嘌呤贮存液(100×
称取200mg8-氮鸟嘌呤(8-azaguanine,MW152.1),加入4mol/LNaOH1ml,待其溶解后,加入超纯水或四蒸水99ml,过滤除菌;
分装小瓶,-20℃冻存。
使用时按1%浓度加入到培养液中(即终浓度为20ug/ml)。
⑵骨髓瘤细胞的准备
骨髓瘤细胞悬液的制备方法如下:
a、于融合前48-36小时,将骨髓细胞扩大培养(一般按一块96孔板的融合试验约需2-3瓶100ml培养瓶培养的细胞进行准备)。
b、融合当天,用弯头滴管将细胞从瓶壁瘤轻轻吹下,收集于50ml离心管或融合管内。
c、1000r/min离心5-10min,弃去上清。
d、加入30ml不完全培养基,同法离心洗涤一次。
然后将细胞重悬浮于10ml不完全培养基,混匀。
e、取骨髓瘤细胞悬液,加0.4%台盼蓝染液作活细胞计数后备用。
细胞计数时,取细胞悬液0.1ml加入0.9ml台盼蓝染液中,混匀,用血球计数板计数。
计算细胞数目的公式为:
每毫升细胞数=4个大方格细胞数×
105/4;
或每毫升细胞数=5个中方格细胞数×
106/2
⑶脾淋巴细胞的准备
1.材料
(1)免疫过的血清抗体滴度高的Balb/c鼠。
(2)1640培养液
(3)2.5%FCS-1640营养液
2.操作方法
(1)拉颈或用CO2处死小白鼠。
(2)将小鼠放于70%酒精中浸泡消毒,取出固定于板上,在无菌条件下取脾。
(3)把脾放入5ml含有2.5%FCS的1640液中,冰浴下轻轻洗去脾上的红血球。
(4)用镊子轻轻挤压脾,做成脾细胞悬液,用毛细管将悬液移入小试管中。
(5)直立小试管3min,使大块的结缔组织下沉,把细胞悬液移入离心管中。
(6)以2.5%FCS—1640充满离心管,并以400g离心7min~10min(与此同时应开始制备骨髓细胞)。
(7)把沉淀用约10ml的新鲜培养液再悬浮。
(8)重复⑹、⑺步骤。
(9)计算细胞,以台盼兰染色用相差显微镜检查,活细胞数应高于80%为合格。
(4)饲养细胞(Feedercells)的制备
在体外的细胞培养中,单个的或数量很少的细胞不易生存与繁殖,必须加入其它活的细胞才能使其生长繁殖,加入的细胞称之为饲养细胞(Feedercell)。
在细胞融合和单克隆的选择过程中,就是在少量的或单个细胞的基础上使其生长繁殖成群体,因此在这一过程中必须使用饲养细胞。
许多种类的动物细胞都可以做饲养细胞,如正常的脾细胞、胸腺细胞、腹腔渗出细胞等,常选用腹腔渗出细胞,其中主要是巨噬细胞和淋巴细胞。
应用腹腔渗出细胞的好处是:
一方面做饲养细胞,另一方面巨噬细胞可以吞噬死亡的细胞和细胞碎片,为融合细胞的生长造成良好的环境。
腹腔细胞的来源可以是与骨髓瘤细胞同系鼠。
也可以是其他种类的小鼠,如C57鼠,昆明小白鼠等。
(1)小鼠(Balb/c或C57小白鼠)若干只。
(2)11.6%蔗糖溶液(经10磅30min高压灭菌)。
(1)拉颈处死小鼠。
(2)70%酒精浸泡消毒10min。
(3)用手术剪将小鼠腹部剪开一小口,剥开皮肤,露出腹腔。
(4)用注射器将4ml11.6%蔗糖溶液注入腹腔,用手指轻揉1min仍用该注射器回抽腹腔液体,加入离心管。
(5)1000r/min离心10min。
(6)取上清,以HAT选择培养液将细胞制成悬液。
台盼蓝染色计数活细胞,使每毫升含40万个活细胞。
(7)以1ml吸管将细胞种入微量培养皿,每孔0.05ml,含2万个细胞,放入CO2培养箱培养,即可供细胞融合和克隆化之用。
如果在融合后发现在培养孔中饲养细胞数量少,则可以在细胞换液时再加入一些。
(5)细胞融合与杂交瘤细胞的选择性培养
融合的方法很多,常用的有转动法和离心法。
融合时脾细胞和骨髓瘤细胞的比例为1:
1至10:
1不等。
3:
1或5:
1最为常用。
1.试剂与材料
(1)供融合用的脾细胞及骨髓瘤细胞。
(2)1640培养液100ml。
(3)完全1640液100ml。
(4)2.5%FCS-1640液50ml。
(5)HAT培养液100ml。
(6)50%PEG:
取分子量4000,高纯度的(日本进口或Serva)PEG10g放入25ml瓶中高压灭菌,使用前用预热于40℃的1640液10ml等量(W/V)混合,以酚红检查pH,一般不必调pH。
如pH有改变,可用HCl或NaHCO3调整。
(7)10ml和50ml的灭菌沉淀管或瓶。
(8)40孔塑料培养盘。
⑴准备好脾细胞。
⑵在50ml沉淀管中混合108脾细胞和107小鼠骨髓瘤细胞,并加入50ml2.5%FCS-1640液。
⑶室温400g离心3min,使细胞沉淀。
⑷移去上清液。
⑸轻敲管底部,使沉淀流动,把沉淀管放于40℃水浴中,使其达融合温度。
⑹加预热至40℃的50%PEG0.8ml,用1ml吸管缓慢滴加,边加边摇沉淀管,肉眼观察可见有颗粒出现,滴加过程要求持续2min。
⑺加1ml1640液,边加边摇动,持续1min。
⑻重复⑺一次。
⑼加1ml1640液,边加边摇动,持续0.5min。
⑽重复⑼一次。
⑾加1640液15ml。
⑿室温,400g离心1min,使细胞沉淀。
⒀去上清,轻敲管底部,加25ml含有HAT的完全1640液。
⒁往已于前一日种有饲养细胞的40孔塑料培养盘中滴加融合的细胞液,每孔1滴(约0.05ml)。
⒂轻摇后,放入5%CO2饱和湿度的37℃温箱中培育。
⒃第3、6、9、10日换入含HAT的完全1640培养液。
注意轻轻吸取上清液,勿将固定于孔底的细胞吸出,根据需要加入适量的饲养细胞。
⒄于第12、15日加入含有HAT的完全1640培养液。
在每次换液前用倒置显微镜观察,大约在10天左右就可观察到杂交瘤细胞生长出来。
大多数杂交瘤细胞在10~20天内出现,但也有在1个月左右才能出现的。
杂交瘤细胞出现后,吸取上清液,检查抗体。
⒅对继续生长的杂交瘤细胞进行增殖传代。
在传代过程中,依情况取消HAT液和完全1640液而代之以10%FCS-1640液。
同时保存于液氮和进行克隆化,在这期间每代都要检查抗体,以防止产生抗体细胞的变异和丢失。
细胞融合的关键:
1.技术上的误差常常导致融合的失败。
例如,供者淋巴细胞没有查到免疫应答。
这必然要失败的。
2.融合试验最大的失败原因是污染,融合成功的关键是提供一个干净的环境,以及适宜的无菌操作技术。
4、杂交瘤的筛选
杂交瘤细胞在融合后2周左右即可筛选,即把分泌所需抗体的杂交瘤孔从众多的孔中选出来,通常也称为抗体检测。
抗体检测的方法很多,通常根据所研究的抗原和实验室的条件而定。
常用的抗体检测方法有:
⑴免疫酶技术⑵免疫荧光技术⑶
⑶间接血凝试验⑷放射免疫测定
5、抗体性质检测
用检测抗体的方法从杂交细胞中筛选出生产指定抗体的杂交株是很重要的。
检测抗体的方法很多,从沉淀反应到放射免疫测定。
由于细胞培养液中的抗体浓度通常是很低的,而且传统的检测方法多是以多价抗原与多克隆抗血清相反应。
杂交瘤产生的抗体则是单克隆的,所以并不是每项方法都能适用。
一定要选择敏感的、快速的、一次又能检测多份样品的方法。
常用的检测方法如下:
1.试管溶血反应检测法
(1)材料:
①杂交瘤细胞,换液后至少两天才收取培养液;
②绵羊红血球,洗涤三次后,配成1%悬液;
③豚鼠补体,无菌采取补体,以pH7.2PBS稀释成20%溶液,分装小瓶,于﹣40℃保存。
使用时以补体和压积红血球5:
1(V/V)的量进行吸收,4℃30min,然后2000r/min离心10min,去红血球,取上清液备用;
④0.01Mol/LpH7.2PBS液。
(2)操作方法:
①在小试管中,加入0.1ml杂交瘤细胞用过的培养液,再加入0.1mlpH7.2的PBS液,然后倍比稀释至一定的稀释度;
②加入0.1ml补体和1%绵羊红血球0.1ml,混匀后置37℃水浴1h;
③观察结果,以绵羊红血球完全溶解的杂交瘤细胞培养液的最高稀释倍数为抗体的溶血效价。
2.斑点检测法抗红血球表面的单克隆抗体与浇灌在琼脂板的红血球结合,进而结合补体,而发生溶血斑点,对着光源用肉眼即可判定。
①绵羊红血球,处理同试管法,最后配成25%红血球悬液;
②新鲜豚鼠血清(同试管法处理);
③琼脂糖,配成0.6%PBS液,水浴中溶化;
④0.01Mol/LpH7.2PBS液;
⑤兔抗羊红血球抗体。
①将溶化的0.6%琼脂糖倒入一试管中,置45℃~48℃水浴中;
②加0.1ml25%红血球悬液,0.1ml豚鼠补体,迅速混匀,倾注一干净载玻片上;
③凝固后,在凝胶表面固定区域滴加2ml待测样品,标准阳性血清和对照试液;
④待溶液全部渗入凝胶后,置湿盘;
⑤37℃温育1h~2h,观察并判定结果。
强阳性(+++)中等阳性(++)
弱阳性(+)阴性(﹣)
必要时可置室温过夜,再判定一次。
3.膜荧光检测法
①培养液HEM或RPMI-1640;
②荧光试剂:
异硫氰酸荧光素(FITC)标记的抗小鼠免疫球蛋白;
③50%甘油缓冲液:
1份甘油加1份体积0.05Mol/LpH7.2PBS液混合即成;
④荧光显微镜、载玻片、盖玻片、吸管等。
①用培养液洗涤二次细胞,悬浮成2.0×
107/ml;
②50µ
l细胞悬液加50μl培养上清液混合,置4℃30min,用培养液洗涤3次,1000r/min离心;
③以50µ
lFITC—抗小鼠免疫球蛋白重新悬浮压积细胞,水浴30min~60min;
④用冷培养液洗3次细胞,重新悬浮;
⑤取一滴细胞悬液滴在玻片上,复盖片,用甘油缓冲液封固,置荧光显微镜下观察。
着色细胞也可以在固定后观察,一滴细胞悬液,涂片、风干,用95%酒精固定10min,固定后的载玻片用PBS洗涤,盖上盖玻片,进行观察。
4.免疫球蛋白和亚类球蛋白的检测以琼脂双扩散试验法进行,此法简单易操作,特异性好。
注意必须将培养液浓缩10~50倍,否则做双向琼扩不出现沉淀线。
其检测方法为:
(1)制备各种兔抗小鼠IgG1~4、IgM1~2、IgA1~2和K、λ抗血清,也可直接购买。
(2)取5ml培养物的上清液缓慢加入0.5ml的饱和硫酸铵溶液,混匀,静置3h,离心沉淀,去上清,沉淀加0.05ml蒸馏水溶解。
(3)制成1%琼脂糖凝胶板,打孔。
中间孔加20μl浓缩上清液,周围孔加20µ
l特异性抗血清,以10μl正常小鼠血清作对照。
也可以采用酶联免疫吸附试验、间接血凝试验以及放射免疫等方法检测。
6、杂交瘤的克隆化
经过抗体测定的阳性孔,可以扩大培养,进行克隆,以得到单个细胞的后代分泌单克隆抗体。
克隆的时间一般说来越早越好。
因为在这个时期各种杂交瘤细胞同时旺盛生长,互相争夺营养和空间,而产生指定抗体的细胞有被淹没和淘汰的可能。
但克隆时间也不宜太早,太早细胞性状不稳定,数量少也易丢失。
克隆化的阳性杂交瘤细胞,经过一段时期培养之后,也还会因为细胞突变或特定染色体的丢失,使部分细胞丧失产生抗体的能力,所以需要再次或多次克隆化培养。
克隆化次数的多少由分泌能力强弱和抗原的免疫性强弱而决定。
一般说,免疫性强的抗原克隆次数可少一些,但至少要3~5次克隆才能稳定。
克隆化的方法很多,包括有限稀释法、显微操作法、软琼脂平板法及荧光激活分离法等。
有限稀释法
(1)微量培养盘,盘内各孔于克隆化前一天培养小鼠腹腔细胞(即饲养细胞)每孔2万~4万。
(2)HT培养基
(1)取出抗体阳性孔细胞,用HT培养液制成细胞悬液。
并取样进行台盼兰染色,计数。
(2)用HT培养液将细胞稀释成200个/ml、40个/ml、20个/ml和的悬液。
(3)用吸管将细胞悬液分别种入微量培养盘,每孔0.05ml,细胞含量分别为10个/孔、2个/孔、1个/孔和0.5个/孔。
(4)5%CO2饱和湿度,37℃培养。
(5)每天用倒置显微镜观察克隆生长情况,选择只有一个集落生长的孔,弃掉两个以上和没有细胞生长的孔。
(6)克隆大量繁殖后,布满孔底的1/3~1/2时,测培养液抗体。
(7)抗体阳性孔细胞,移到有饲养层的组织培养瓶中,并传2~4代就可以脱离饲养细胞,建成克隆株。
7、单克隆抗体的冻存与复苏
(1)杂交瘤细胞的冻存当获得产生所需的单克隆抗体的杂交瘤细胞后,必须将一部分杂交瘤细胞保存,否则在连续传代的过程中,可能产生突变或染色体的漂移以至丧失固有特性或丢失产生抗体的特性。
另外在长期的培养过程中,难免不发生污染以至于毁灭。
所以必须冷藏保存一部分。
保存方法如下:
(1)细胞:
取对数生长期的细胞。
(2)10%二甲基亚砜保护液(二甲基亚砜能损坏滤器,而又被高压所破坏,所以不能过滤或高压消毒。
其本身就是毒品,无菌):
含10%二甲基亚砜、20%灭活胎牛血清,70%RPMI—1640液。
(3)20%FCS—1640培养液:
含青霉素100U/ml,链霉素100μg/ml。
(4)灭菌的2ml安瓶等
(1)去掉细胞培养瓶中的旧的培养液,加入10%FCS—1640液,使细胞悬浮。
(3)1000r/min离心10min,去上清。
细胞沉淀用10%二甲基亚砜保护液制成悬液,使成1.0×
107细胞/ml。
(3)取样,台盼兰染色,计数活细胞,应在95%以上。
(4)用注射器将细胞分装安瓶,每瓶0.5ml~1.0ml,熔封安瓶。
(5)放4℃2h。
(6)放液氮罐气态部分(-70℃)15h。
(7)转入液氮部分。
(2)杂交瘤细胞的复苏
1.从液氮罐中取出安瓶立即放37℃水浴中速溶。
2.无菌操作打开安瓶,取出细胞悬液,转入组织培养瓶。
3.逐滴缓慢加入20%FCS-1640培养液3.5ml,这个过程延续3min。
4.5%CO2饱和湿度,37℃培养。
5.4h后弃去培养液上清,加入新鲜的20%FCS-1640培养液。
6.继续培养,换液,以至形成单层。
7、单抗的制备
获得稳定的杂交瘤细胞系后,即可根据需要大量生产单抗,以用于不同目的。
1、单抗的大规模制备
目前大量制备单抗的方法主要有两大系统,一是动物体内生产法