药品生产技术《辰欣药业新员工入厂必备手册生产工艺培训教材 》.docx
《药品生产技术《辰欣药业新员工入厂必备手册生产工艺培训教材 》.docx》由会员分享,可在线阅读,更多相关《药品生产技术《辰欣药业新员工入厂必备手册生产工艺培训教材 》.docx(47页珍藏版)》请在冰豆网上搜索。
药品生产技术《辰欣药业新员工入厂必备手册生产工艺培训教材》
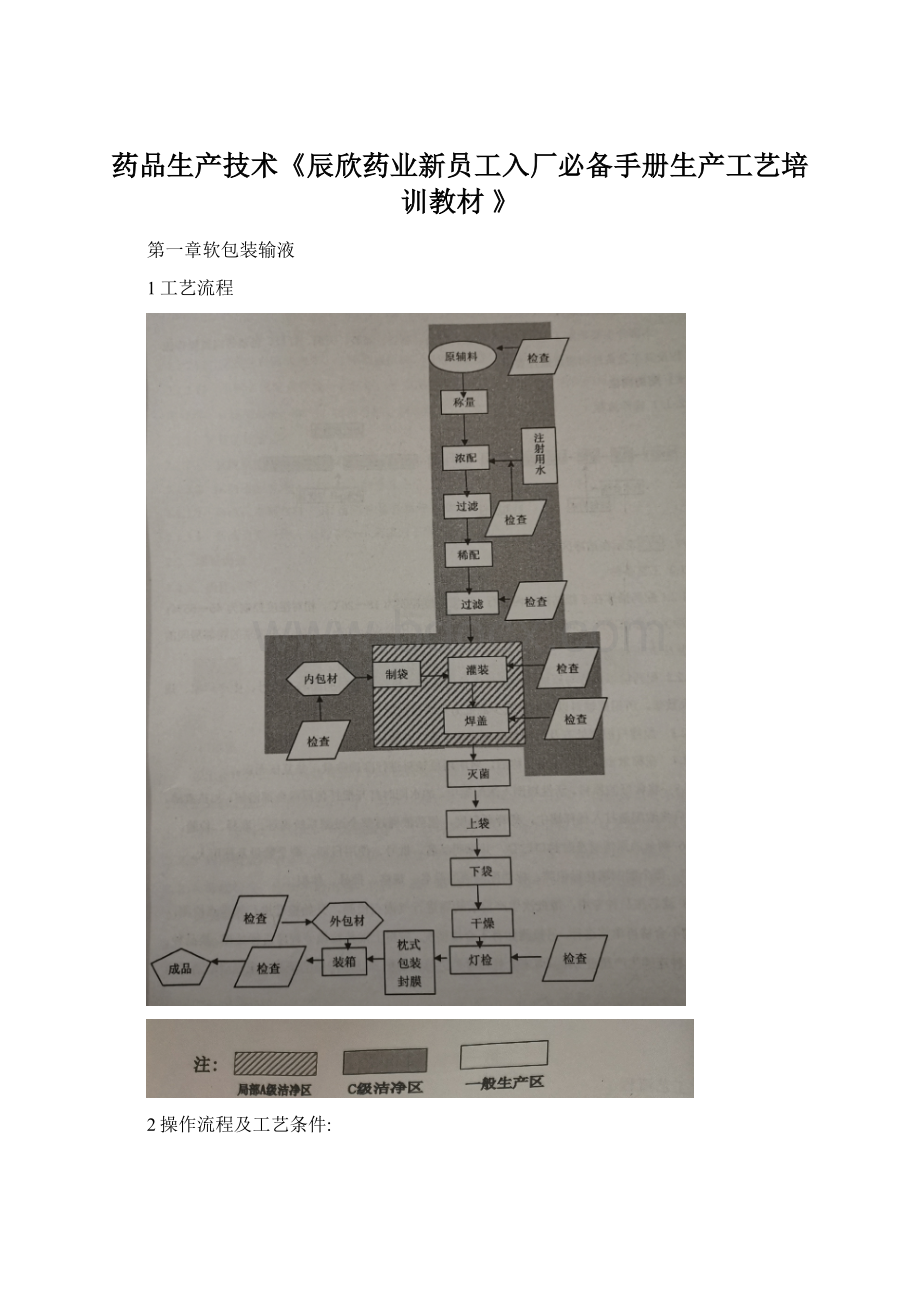
第一章软包装输液
1工艺流程
2操作流程及工艺条件:
本局部主要规定了生产过程中称量、配药、制袋、灌装、灭菌、灯检、包装等岗位操作流程及其工艺条件和质量监控要点。
配药岗位
操作流程
工艺条件
配药操作在C级洁净区内进行。
环境温度控制为18-26℃;相对湿度控制为45-65%;洁净区与非洁净区之间,不同洁净级别的相临房间压差应≥10l药液内不得有任何可见异物等。
灌装岗位
操作流程
以上操作步骤均在C级背景下的A级环境下进行。
制袋检查:
袋子切边应干净、整齐、无毛边、无拉丝、绞合现象,焊缝焊点处不能有脆化、碳化、塑料老化现象。
焊缝强度不低于材料本身强度。
将不合格袋的数量进行记录。
封口检查:
热合应严密、牢固、均匀一致无发泡、起毛现象,坠落试验合格。
印刷检查:
印刷字迹清晰,色泽-致,版面应端正、适中,印字对软袋材质无损伤。
灭菌岗位
操作过程
工艺条件
天曲采用水浴式灭菌柜在一般生产区域内进行。
灭菌过程由微机控制,操作人员要注意监控。
灭菌用水要符合纯化水标准。
灭菌过程中控制的参数:
蒸汽压力,压缩空气压力,
灌装结束至灭菌开始的存放时间;
灭菌温度、时间、F0值;灭菌状态标识。
灭菌岗位关键控制点:
防混淆相关措施整个灭菌操作过程中要求前门、后门不得对开,物流循环生产线运行过程不可逆转,防止灭菌产品混淆。
待灭菌药品经上袋机上至灭菌车上,持一车装满后,操作人员在本车上悬挂黄色的生产状态标识牌来进行标识,标明:
品名、规格、批号、数量、状态、操作人、生产日期,要求每一车待灭菌药品均要悬挂状态标识。
所有灭菌后药品,在灭菌完毕,由灭菌操作人员将药品全部由柜内转移出,同时在每车上面悬挂蓝色状志标识牌,标明:
品名规格、批号、数量、状态、操作人、生产日期,生产状态标明已灭菌。
灭菌时。
灭菌操作人员不得离岗。
灯检岗位
操作流程
工艺条件
检查员目视力应在09以上,至少每年检查一次。
检查方法,按照卫生部规定的标准逐袋目检之后用双手用力挤压,质检员逐批抽查,不符合要求应返工重检。
光源:
照度为2021-3000l的日光灯管,伞棚式装置。
背景:
黑色、白色背景;
检查距离:
供试品距光源2021,距人眼为20215cm,每袋检查按正立、倒立、平视三步共需时间约4-5秒。
检出的缺陷品及时分类,记录,判断缺陷品类别,分色块、
纤维、白块、白点、混浊等,挤压有药液渗漏的。
不合格品集中分区存放,标明品名、规格、批号、不得混药。
更换品种、规格时要清场,做好清场记录。
废品、留样标识明显,应注明品名、规格、日期,以防混批。
质量监控要点:
抽查可见异物,误判率不超过2%,灯检缺陷品每批集中报废一次,必须经质量员的批准在质量员的监督下进行报废处理,并及时填写记录。
包装岗位
操作过程
工艺条件
本工序为一般生产区。
卫生环境及工作服穿戴都应符合该项要求。
枕式包装、封箱、装箱全部采用机械化操作。
每个品种、规格包装结束后要彻底清场,并做好清场记录,严禁混药、混批。
质量监控要点
生产前做好首件复核,检查包装品的品名、规格、批号等信息无误。
箱签与包装品的品名、规格批号相符,字迹要清楚。
装箱数量要正确、封箱要牢固,每箱必须经过检查。
符合拼箱管理规定,只准拼入一个批号,且箱签及合格证均要打上两个正确批号。
第二章固体制剂
生产工艺教学视频\
第三章膏剂
以盐酸金霉素眼膏工艺规程为案例
1术语
操作规程:
经批准用来指导设备操作,维护与清洁、验证、环境控制、取样和检验等药品生产活动的通用性文件,也称标准操作标准。
工艺规程:
为生产特定数量的成品而制制定的一个或一套文件,包括生产处方、生产操作要求和包装操作要求,规定原辅料和包装材料的数量、工艺参数书和条件、加工说明〔包括中间控制〕、考前须知等内容。
批:
经一个或假设干加工过程生产的、具有预期均一质量和特性的一定数量的原辅料、材料或成品。
为完成某些生产操作步骤,可能有必要将一批产品分成假设干亚批,最终合并成为一个均一的批。
在连续生产情况下,批必须与生产中具有预期均一特性确实定数量的产品相对应,批量可以是固定数量或固定时间段内的生产的产品量。
物料:
指原料、辅料和包装材料等。
物转平衡:
产品或物料实际产量或实际用量及收集到的损耗之和与理论产量或理论用量之间的比拟。
并考虑可允许的偏差范围。
原辅料:
除包装材料之外,药品生产中使用的任何物料。
处方:
规定起始原辅料数量的一个文件,该文件必须说明为生产这一数量成状态标识:
指用于指明原辅材料、产品、容器及设备的状态标识。
洁净室区:
需要对尘粒及微生物含量进行控制的房间区域。
其建筑结构、装备及其使用均具有减少该区城内污染源的介入、产生和滞留的功能。
2产品概述
%
眼膏剂
本品为黄色眼膏。
用于细菌性结膜炎、麦粒肿及细菌性眼睑炎。
也用于治疗沙眼。
涂于眼睑内,一日1-2次,
最后一次宜在睡前使用。
密封,在枯燥阴凉处不超过2021存。
3工艺流程图
灌装
操作流程
灌装质检查
装量的检查:
检查方法及标准:
用电子天平称量一支铝管管重=平均管重,进行数据清零后,然后将灌装半成品放在电子天平上称量即为所测装量。
车间控制标准:
**g规格的为**之间,
调节灌装装量**g
检查频次及检查数量:
正常灌装过程中要求每30分钟查一次装量,每次每个灌装头检查2支;生产快结束前10分钟检查一次装量,每次每个灌装头检查2支。
封尾、批号检查
检查方法及标准:
把灌装后的半成品放在拇指和食指之间,封尾朝上,观察封尾以及批号情况:
封尾应严密、整齐、平整,批号应清晰正确、完整、端正,并打在指定位置。
检查频次及检查数量:
正常灌装过程中要求每30分钟查一次,每次每个批号夹检查2支:
生产快结束前10分钟检查一次,每次每个批号夹检查2支。
本局部主要规定特制生产流程中的理瓶、热处理、灌封、灭菌、灯检、包装等岗位的具体操作流程,工艺条件及质量监控要点。
理瓶
操作流程
工艺条件
洗瓶操作在D级洁净区内进行
烘箱内环境为A级洁净区。
2洗瓶用水为注射用水。
洁净空气流程
工艺条件
2配药操作在C级洁净区内进行
配药严格按照工艺卡要求进行,确保含量、
in应返回到精洗岗位重新处理。
2 生产现场的半成品、瓶子、胶塞等物料应分类保管,废品放入 废品框并及时将废品间传出清洁区,防止混淆,换批生产,执行对批号,阀门的双人复核规定
2 灌装A级区软围挡生产过程不得吊起,生产过程不得对灌装机外表清洁,清洁时应停止灌装机和传送带清洁结束后开启
2 暂存的胶塞容器、配料容器应标明内容物名称,状态等。
正在使用的胶塞等物料应标明处理时间、有效期。
对所有速器应标明名称、数量、灭菌时间、有效使用时间、清洁状态等。
微孔滤芯应放在洁净内袋 里。
已灭菌物品与未灭菌物品有明显的状态标识。
管道系统及设备不得有跑冒滴漏现象。
换品种时现场不得存在与本次生产品种无关的物料。
上一品种物料一天内退库。
所有物料均有货位卡,帐卡物一致,货位卡填写标准无空白项。
剩余原料零头应密封,反口扎。
所有岗位的不合格品、不合格物料,必须单独存放,用红色容器或带有红色标识的容器存放,状态标识醒目。
2 岗位文件均是经批准的现行有效文件。
岗位所有记录一律用黑色碳素笔或中性笔填写,不得用圆珠笔。
所有物料、厂名、人名不得简写。
工艺卡和称量卡均有审核人、批准人签字。
实际投料量要和工艺卡致。
岗位批记录、辅助记录、其他记录与操作保持一致、填写及时公司质量员特批除外,不得提前或拖后填写:
空白记录受控发放,要求下发一个班次的记录:
按车间规定上交至记录管理员。
三天不用的物品设备除外应撤出洁净区。
所有物料不得直按触地面,所有的容器具、物料、移动的设备必须定置存放,并有相关的定置标R。
第四节玻璃瓶输液工艺
一、工艺流程图
二、术语
操作规程:
经批准用来指导设备操作、维护与清洁、验证、环境控制、取样和检验等药品生产活动的通用性文件,也称标准操作规程。
工艺规程:
为生产特定数量的成品而制定的一个或一套文件,包括生产处方、生产操作要求和包装操作要求,规定原辅料和包装材料的数量、工艺参数和条件、加工说明包括中间控制、考前须知等内容。
物料:
原料、辅料、包装材料等。
34物料平衡:
产品或物料实际产量或实际用量及收集到的损耗之和与理论产量或理论用量之间的比拟,并考虑可允许的偏差范围。
注射用水系统
注射用水由纯化水经蒸馏制得,用于药液配制和直接接触药液的容器具的清洁。
3注射用水制备过程:
纯化水首先经过格兰高多级过滤高压泵进入冷凝器,再进入六效预热器进行预始至一效,设备预热3-5分钟后,进入升温状态,特一效蒸发器温度升至135C左右时,设各进入产水状态,预热后的一局部水进入一效。
二效蒸发器与工业蒸汽反响,产生的纯蒸汽进入三效蒸发器,蒸馏水进入一效预热器运行至六效预热器最后进入冷凝器:
而预热后的另一局部水进入三效蒸发器蒸发开始蒸发,产生的纯蒸汽作为下一效的热源,为蒸发的料水进入下一效继续蒸发至六效蒸发器,最后被蒸发水进入冷凝器,
未蒸发的浓缩水排放。
从冷凝器出来的水经过在线监测,温度92C以上,电导率低于1Ous/cm进入注射用水贮罐。
323注射用水系统在一般生产区进行
3配制药液用的注射用水应符合企业内控标准。
5注射用水系统应用纯蒸汽121C*30分钟进行消毒,每周消毒一次。
系统因检修或假日停机后,再开机时的第一局部注射用水应弃去,经检验合格的注射用水方可收集使用。
四、操作流程及工艺条件:
本局部主要规定了输液生产程中洗瓶提作,胶塞处理、配药操作、灌装、搭塞,把塞操作,轧盖换作、灭菌操作、灯检操作、包装操作等工艺流程及其工艺条件和质量监控要点。
1、胶塞处理
操作流程
工艺条件
丁基胶塞处理在C级洁净区内进行。
环境温度控制在18-26C,相对湿度控制在4-65C
洁净区与非洁净区之间,不同洁净级别相临房间的压差应≥l0l依据先正立、平放、倒转的顺序进行可见异物检测,检查标准:
2021l内无任何可见异物。
检查丁基胶塞可见异物的取样及检测方法:
取一250ml洁净锥形瓶,参加合格注射用水2021l,翻开丁基胶塞出口,用干净的镊子夹取5个丁基胶塞放入瓶中盖好盖,振摇30秒,静置,待气泡消失后,在可见异物检测仪下检查,2021l注射用水中不得有任何可见异物。
常压化冷却
空冷:
开启回风阀、真空泵、真空电磁阀、真空阀,当箱体内温度降到50C时,关闭回风阀、真空泵、真空电磁阀、真空泵阀。
出料
启动“释放前门〞按钮,按钮闪烁,到塞暂存间,翻开手动锁,翻开前门,装上料斗,把丁基胶塞桶放在出料口的相应位置,在A级层流的保护下按下“出料按钮〞,手动调节电位器使主机反转出料。
出料完毕,弹出“出料按钮",关闭出料机构。
卸料完毕后,放入专用洁净不锈钢桶内密闭存放备用。
关闭A级5层流罩。
处理好的丁基胶塞到使用不超过6小时,否那么重新处理。
结束工作
盖好进、出料口。
将处理罐用注射用水冲洗干净。
关紧各进水进气阀,排空罐内余水,关紧排液阀门。
4用浸清洁液的半干丝光毛巾擦拭罐外壁至洁净。
容器、工具用纯化水冲洗擦拭后,定置存放。
生产结束后丁基胶塞处理人员及时填写丁基胶塞处理交接班记录。
铝塑组合盖处理在C级洁净区内进行。
环境温度控制在18-26C,相对湿度控制在45-65%
洁净区与非清净区之间,不同法洁净级别相临房间的压差应≥10L依据先正立、平放、倒转的顺序进行可见异物检测,检查标准:
2021L水样中无任何可见异物。
热风循环,真空枯燥洗涤合格的铝塑组合盖进入枯燥程序,开热风进口阀、回风阀,翻开风机电加热烘干温度到开始计时,加热时间到,关闭热风进口阀、回风阀、风机,、翻开真空泵、真空电磁阀、真空阀并计时,时间到关闭真空阀、关闭真空泵、真空电磁阀,翻开常压化阀40秒,停主机,-次热风、真空枯燥结束,重复以上动作到达设定次数,结束此工步。
常压化冷却空冷:
开回风阀、真空泵、真空电磁阀、真空阀,当箱体内温度降到“冷却温度〞设定值,关闭回风阀,真空泵、真空电磁阀、真空泵阀。
出料
启动“释放前门〞按钮,前门自锁装置释放。
按钮闪烁,到盖暂存间,翻开前门,装上料斗,把铝塑组合盖桶放在出料口的相应位置,按下“出料按钮〞,手动调节电位器使主机反转出料。
出料完毕,弹出“出料按钮",关闭出料机构。
卸料完毕后,放入铝塑组合盖桶内密闭存放备用。
↓
2处理好的铝塑组合盖到使用不超过6小时,否那么重新处理。
检查铝塑组合盖清洗烘干效果及检查方法:
在正常处理结束后,每罐分三次取样,分别为出料前、中、后,每次随机取样50只,检查洗盖烘干质量。
检查标准:
目视无任何可见异物,无水滴:
手摸铝塑组合盖处于枯燥状态。
铝塑组合盖无变形、无变色、不褪色、塑料件应与铝件完整结合,无脱落。
结束工作
将处理罐用纯化水冲洗干净。
关紧各进水进气阀,排空罐内余水,关紧排液阀门。
盖好进、出料口。
用浸清洁液的半干丝光毛中擦拭罐外壁至洁净。
容器、工具用纯化水冲洗擦拭,枯燥后,定置存放。
生产结束后铝塑组合盖处理人员及时填写铝塑组合盖处理交接班记录。
工艺条件
配药岗位操作在C级洁净区内进行。
环境温度控制在18-26C,相对湿度控制在45-65%
洁净区与非洁净区之间,不同洁净级别相临房间的压差应≥10in后,将水排尽。
按照上述方法冲洗1-2遍。
药液的配制翻开罐盖,将称量好的原料缓慢参加浓配罐中,参加配制好的活性炭,关闭罐盖。
参加适量注射用水,翻开浓配罐搅拌,搅拌10min。
翻开浓配罐放料口阀门及稀配进料阀。
启动浓配卫生泵电源,经钛棒将浓配液打入稀配罐中。
药液全部打入稀配罐后通过浓配罐喷淋球,冲洗罐壁3遍,每次用水压差变送器显示读数为计量体积为400L,总冲洗水压差变送器显示不少于,将冲洗液全部打入稀配罐中,停泵,关闭电源,关闭浓配放料口阀门及稀配进料阀。
适当控制进水量,通过电子称重显示仪观察,待数值到达稀释配制量时,立即关闭稀配罐注射用水阀门。
翻开射流搅拌和稀配滤器阀门,,关闭冷却水进水阀。
取样测半成品。
半成品合格后准备灌装。
药液的过滤:
二级过滤,第一级:
3um钛棒:
第二级:
01um微孔滤器。
工艺条件
洗瓶在一般生产区域内进行。
纯化水冲洗、注射用水冲洗在C级洁净区内进行。
主要操作间位置和编号见?
主要操作间位置和编号一览表?
,主要设备型号和编号见主要设备型号和编号一览表?
。
输液瓶经卸垛机除外包装、空瓶输送、超声波粗洗、纯化水和注射用水回收水冲洗、纯化水冲洗、注射用水冲洗七个步骤。
洗瓶喷水压力保持在检查所用包材玻璃瓶与检验报告单为基准核对包材的品名、批号、生产厂家、规格及数量是否一致,复核无误后进行生产。
生产步骤
理瓶操作:
先将整垛待卸的输液瓶使用文车放到输入平台上整垛输液瓶再经输送链送到解包平台。
4卸瓶垛机的操作
在解包平台上,操作人员解除拥扎瓶垛的绑带和薄股,由输送链将解包的瓶垛送到井底平台上。
卸瓶垛主机的提升结构将进入井底平台的瓶垛用升降平台将瓶垛提升到预定的高度,接着卸层隔板装置将瓶垛上的“层隔板〞吸起并送到位于主机旁边的“层隔板〞输送小车内,输送小车将“层隔板〞送到“层隔板〞回收区。
卸层隔板同时,出瓶机构将输液瓶夹紧,出瓶机构向输瓶平台方向平移:
随后出瓶机构松开并将输液瓶卸到输瓶平台上。
卸后的瓶由输瓶平台的输送链板向前输送。
卸完一层瓶后,主机的提升机构按照预设的瓶高上升一层,再卸出下一层,循环完成整个瓶垛的卸瓶工作。
瓶在台面上时,操作人员要认真剔除破口、炸纹、结石、斑点、异形的以及积水严重污染的输液瓶,放入专用盛器中以备处理,并统计剔除品的类别与数量纳入?
理瓶记录?
中。
启动卸瓶垛机总电源开关,传送带上的输液瓶向前运输,通过输送带,输液瓶进入粗洗间的垂直下瓶轨道上。
15认真观察瓶子输送的情况,随时把倒下的瓶子扶起,并根据整条线的生产速度随时调整进瓶速度,保持连续供瓶。
粗洗操作
1输液瓶经垂直下瓶、传送带进入集瓶轨道及集瓶台。
输液瓶经垂直下瓶后进入粗洗的集瓶台的运行
过程中,操作人员要仔细检查瓶子质量,挑出理瓶传送带上面漏检的破口、炸纹、麻点、结石、斑点、异形的瓶子,记入?
输液瓶粗洗记录?
中。
2启动主机开关,按照生产需要调整主机进瓶速度,翻开进瓶传送带,开启二次混合水及补水用循环泵进行洗瓶超声波水箱混合水经过25um钛棒过滤器注入到输液瓶中,完成补水过程:
完成补水的输液瓶进入超声波水箱中,通过超声波发生器对输液瓶内外壁进行洗涤:
超声波洗瓶结束后,经3um钛棒过滤合格的二次混合水冲洗输液瓶内壁2次:
经3um钛棒过滤合格的一次混合水冲洗输液瓶内壁2次。
粗洗过后的输液瓶通过传送带输送到精洗岗位。
3检查超声波水位是否覆盖发生器,水温是否在35-50C范围内。
水温是否在30-35C范围内,抽查频次:
每批两次,查看一次混合水及二次混合水压力:
压力范围查看喷嘴水柱是否喷至瓶底,针头是否居中,水是否自上而下从瓶口流出。
抽查频次:
每批2次。
4操作人员在出瓶口随时观察出瓶情况,有出瓶不好的及时调整设备。
5洗瓶机洗瓶过程中,要注意检查瓶子的清洗质量:
洗后的玻璃输液瓶目视检查时外表没有污点、留痕及无光泽的薄层。
6操作人员在操作过程中及时检查针头对位情况,检查洗瓶水压力情况。
当二次混合水压力缺乏时,开启纯化水阀门进行补水。
7停机时,先停止进瓶传送带,待瓶篮中的输液瓶全部清洗完并通过送瓶传送带送至精洗岗位后,按主机停止按钮,主机停止工作,最后切断电源,清理现场。
8每批生产完毕必须检查洗瓶机内是否有从瓶篮中掉下的输液瓶,作为生产损耗量,把数量记录在<输液瓶粗洗记录?
中。
精洗洗瓶操作
1通知粗洗岗位查看注射用水罐、纯化水罐内是否加满水,得到确认后,开启水泵开关,针头开始喷水。
2输液瓶经粗洗后经传送带进入精洗集瓶台。
3启动精洗机进瓶开关。
4启动精洗机主机。
5开始进行洗瓶使用过滤合格的纯化水对输液瓶内壁冲洗2次,对外壁冲洗1次。
使用过滤合格的注射
用水对输液瓶内壁冲洗2次,外壁冲洗1次。
6生产过程要查看针头洗瓶情况,查喷嘴水柱是否喷至瓶底,居中,至上而下从瓶口流出。
纯化水及
注射用水管路喷射压力过滤器运行是否正常,无漏点。
抽查频次:
每批2次。
7生产过程中操作人员要认真剔除在精洗出瓶口传送带上面的异形、结石、炸纹、破瓶、斑点的瓶子,
并把数量计入?
输液瓶精洗记录?
中。
工艺条件
灌装岗位自动线操作均在C级背景下的A级环境下进行,环境温度控制为18-26C,相对湿度控制为45-65%,洁净区与非洁净区之间,不同洁净级别相临房间的压差应≥10l合格的注射用水,置可见异物检测仪下分正、倒、平视转动逐瓶检查可见异物。
每批抽查一次。
灌装人员启动传送带,将洁净输液瓶从精洗机的出瓶口送到灌装机的绞龙前端。
准备工作就绪后,联系上下岗位准备灌装。
灌装、压塞机操作
设备正常启动:
翻开人机界面电源,找出主菜单的操作画面。
触摸屏显示“操作画面〞:
设定“生产速度〞“无瓶不灌〞“手动〞等状态参数,检查设定所生产规格下的灌装时间及装量参数,并由另一人复核。
生产速度100-550瓶/分:
洁净压缩空气压力:
,恒压桶压力表的数值:
调整装装量时,对每一个灌装头装量控制时间分别设定,并根据每个灌装头的装量检查结果进行上下调节。
检查装量设定:
500ml规格装量设定在502-505ml
一人翻开要进行生产的药液阀门,另一人进行复核并无误。
然后点击操作面板上的“进药启动〞向贮液桶内输入灌装液,手动翻开各个灌装头气动隔膜阀,检查各个气动隔膜阀翻开是否正常,确认无误后翻开真空启动。
点击轨道开关,再翻开主机开启。
确认运转方向正确。
空车低速运转,检查确认无异常噪音、运动平稳,之后进行提速正常运转。
灌装
1送瓶轨道开始送瓶,一人查看从精洗岗位的出瓶口送来的瓶子无倒瓶,井查看分瓶盘分瓶顺畅。
2输液瓶进入灌装岗位后,根据生产情况调节振荡斗的振荡调速。
灌装生产时,灌装完毕的输液瓶由中间拨轮进入压塞操作。
5可见异物检查
每批开始灌装前应进行排液,500ml排液两圈80瓶,所排药液报废处理。
排液后由灭菌岗位人员在灭菌岗位取连续己灌装好的药瓶40瓶,置可见异物检测仪下分正、倒、平视转动逐瓶检查可见异物,不得有任何可见异物方可进行批生产。
灌装过程中灭菌岗位人员再取样检查一次可见异物。
装量检查
灌装岗位人员按灌装机下药管编号,以1到40抽取己灌封好的40瓶依次用相应规格的洁净量简量取装量,量取装量应在控制范围内。
每批抽查两次,查完装量的输液瓶及药液,作报废处理。
装量控制范围:
每瓶的装量不少于标示装量。
压塞
灌装完毕后的药瓶由中间拨轮进入压塞拨轮进行压塞操作。
压塞质量检查
检查方法:
目视无崩塞、掉塞。
检查标准:
压塞严密。
3灌装操作中要随时注意装量变化并及时调整。
34剔除的不合格品药液及时报废处理。
随时观察压塞机丁基胶塞的输送情况及时调节振荡频率并及时补充丁基胶塞。
没有落上丁基胶塞的输液瓶要及时报废处理。
压塞完成后,压塞拨轮使药瓶转到出瓶拨轮后经输出拨轮将药液瓶拨到输送带上进入下道工序。
结束操作
通知上下岗位及配药操作人员,准备停机。
关闭进药控制阀。
按停止按钮,主机停止工作,再按输瓶轨道停止。
关闭人机界面电源。
45剩余的丁基胶塞,放入洁净的不锈钢桶中密闭保存,从处理完到再次使用时间不能超过6小时,如超过6小时,那么需要重新进行处理。
46按照?
灌装清场清洁SO
l,其中霉菌、酵母菌不得有。
工艺条件
轧盖岗位自动线操作均在C级背景进行,环境温度控制为18--26C,相对温度控制为45--65%洁净区与非洁净区之间,不同洁净级别相临房间的压差应≥1O
in≤升温时间≤45min,F。
值大于8,2021n≤降温时间≤40min
压缩空气压力Ml规格产品在每灭菌柜次的最冷点取样1瓶,剩余局部要求均匀取样,每灭菌柜共收样15瓶,每柜次灭完菌后收样人员及时从天简车上取样,标取局部样品要求及时贴相应的标识。
上标明样,品批号,并注明“无菌〞字样。
所取样品经灯检合格后及时送包装固定位置,做好相应的标识
灭菌用水水质监测:
每班更换一次新鲜的纯化水,每柜从灭菌柜排水口处取样,检测电导率电导率≤2s/cm。
换水前最后一柜,取样检测微生物及细菌内毒素,米监控纯化水水质情况细菌、霉菌、酵母菌总数每1ml不得过100cfu:
细菌内毒素SEU/mL
工艺条件
灯检操作在一般生产区域内进行。
主要操作间位置和编号见主要操作间位置和编号一览表?
,主要
设备型号和编号见?
主要设备型号和编号览表?
。
灯检人员远距离和近距离视力测验,均应为49或以上矫正后视力应为或以上:
应无色盲。
每季度检查一次视力,不符合要求的调离灯检岗位。
检查方法按照卫生部规定的标准逐瓶目检,质检员逐批抽查,不符合要求应返工重检。
光源:
照度为1000~1500LUX的日光灯管,伞棚式装置。
背景:
不反光的黑色、白色背景。
检查距离:
供试品距光源2021,距人眼为20215cm,每瓶检查按正立、倒立、平视三步共需时间的4s秒。
检出的缺陷品及时分类、记录,灯检缺陷品应分别存放,标明品名、规格、批号,每批生产结束后,报废处理。
更换品种规格要清场,做好清场记录。
生产步骤
1生产前准