金属腐蚀与防护复习资料.docx
《金属腐蚀与防护复习资料.docx》由会员分享,可在线阅读,更多相关《金属腐蚀与防护复习资料.docx(18页珍藏版)》请在冰豆网上搜索。
金属腐蚀与防护复习资料
金属腐蚀与防护复习资料
第一章绪论
一、金属腐蚀研究的意义和重要性
二、金属腐蚀的分类
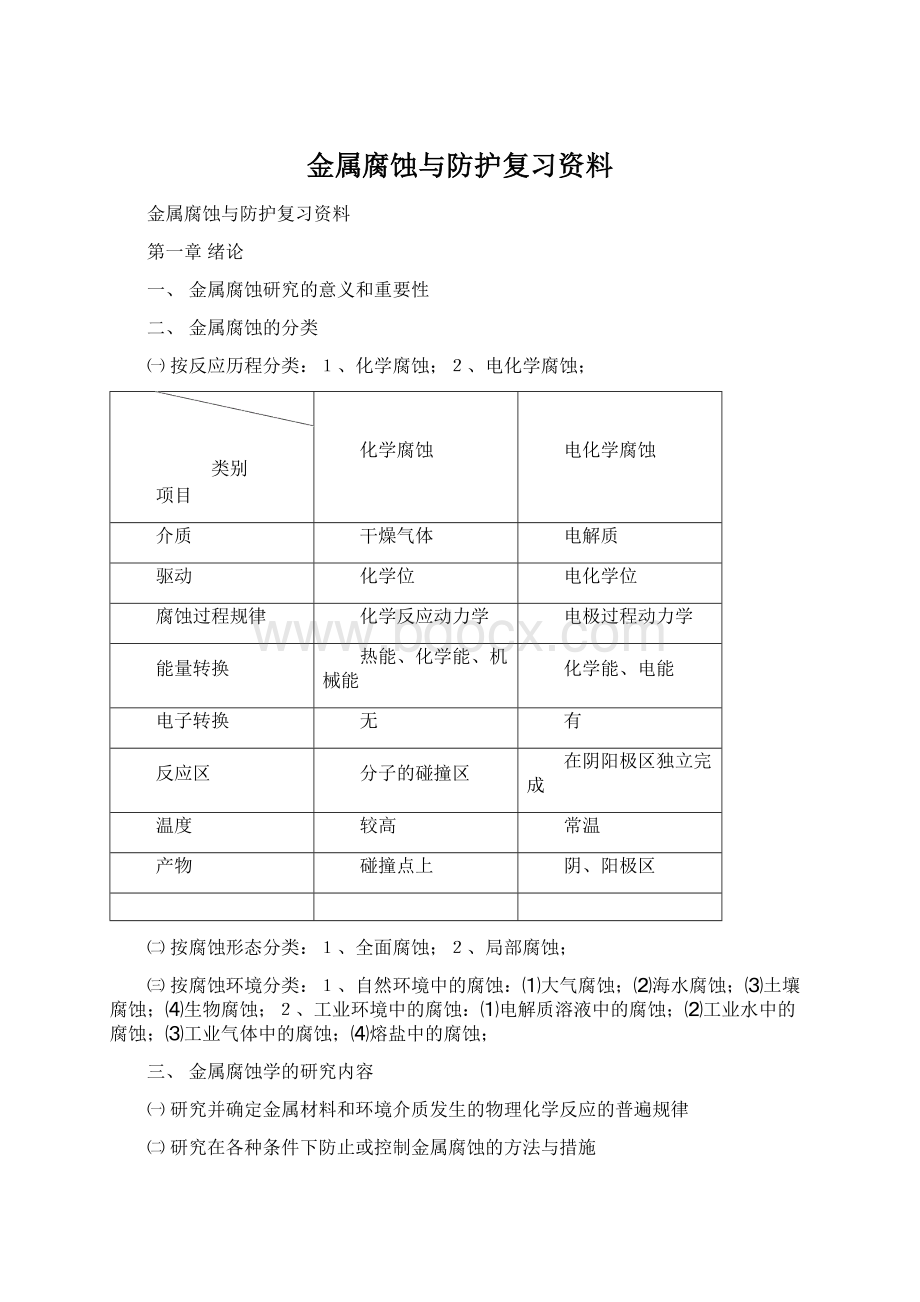
㈠按反应历程分类:
1、化学腐蚀;2、电化学腐蚀;
类别
项目
化学腐蚀
电化学腐蚀
介质
干燥气体
电解质
驱动
化学位
电化学位
腐蚀过程规律
化学反应动力学
电极过程动力学
能量转换
热能、化学能、机械能
化学能、电能
电子转换
无
有
反应区
分子的碰撞区
在阴阳极区独立完成
温度
较高
常温
产物
碰撞点上
阴、阳极区
㈡按腐蚀形态分类:
1、全面腐蚀;2、局部腐蚀;
㈢按腐蚀环境分类:
1、自然环境中的腐蚀:
⑴大气腐蚀;⑵海水腐蚀;⑶土壤腐蚀;⑷生物腐蚀;2、工业环境中的腐蚀:
⑴电解质溶液中的腐蚀;⑵工业水中的腐蚀;⑶工业气体中的腐蚀;⑷熔盐中的腐蚀;
三、金属腐蚀学的研究内容
㈠研究并确定金属材料和环境介质发生的物理化学反应的普遍规律
㈡研究在各种条件下防止或控制金属腐蚀的方法与措施
㈢研究金属腐蚀速率的检测技术和方法,特别是现场快速检测和监控的方法:
研究评定金属腐蚀的标准。
第二章金属电化学腐蚀热力学
根据组成电池的电极大小,可以把电池分为宏观电池和微观电池两类,对于电极较大,即用肉眼可以观察到的电极组成的腐蚀电池称为宏观电池。
宏观电池常见的几种类型有:
①不同金属与其电解质溶液组成的电池;②不同金属与同一种电解质溶液组成的电池;③浓差电池;④温差电池。
由于金属表面的电化学不均匀性,会在金属表面形成许多微小的电极,由这些微小电极形成的电池称为微观电池。
主要有以下几种类型:
①金属表面化学成分的不均匀性引起的微电池;②金属组织结构的不均匀性而构成的微电池;③金属表面物理状态的不均匀性构成的微电池;④金属的表面膜的不完整构成的微电池。
第三章金属电化学腐蚀过程动力学
一、电极的极化现象
㈠电极的极化:
当有外电流通过电极/电解质溶液界面时,电极电位随电流密度改变所发生的偏离平衡电极电位的现象。
㈡电极极化的原因及类型
㈢极化曲线及其测量
二、电化学极化与浓度极化
三、共轭体系与腐蚀电位
㈠混合电位:
阴阳极化曲线相交于一点,具有共同的电位,相交点的电位是整个金属电极的非平衡的稳定电位,称之为混合电位;当金属腐蚀时,则称之为腐蚀电位或自然腐蚀电位。
对应于腐蚀电位的电流密度称为腐蚀电流密度或自然腐蚀电流密度。
㈡混合电位理论的两项简单的观点
1、任何电化学反应都能分成两个或更多的局部氧化反应和局部还原反应;
2、在电化学反应过程中不可能有净电荷积累。
㈢共轭体系:
在一个孤立的电极上同时以相同的速度进行着一个阳极反应和一个阴极反应的现象叫做电极反应的耦合。
这两个耦合的反应又称为共轭反应,相应的体系称为共轭体系。
如果进行的共轭反应是金属的溶解及氧化剂的还原,其混合电位称为腐蚀电位。
在所接触的腐蚀介质中发生腐蚀的金属或合金称为腐蚀金属电极。
四、活化极化控制的腐蚀体系的极化行为
㈠活化极化控制的腐蚀体系的极化行为:
指腐蚀由电化学步骤控制的体系。
㈡ 阴极过程由浓度极化控制时腐蚀金属电极的极化
㈢ 理想极化曲线与实测极化曲线
1、由单一反应的平衡电位做起始电位,并忽略极化过程中其他次要因素的影响,这样所得到的电位-电流曲线称为理想极化曲线。
2、通过外加电流实验测定的这种实际电极体系中的阳极极化曲线和阴极极化曲线,称为实测极化曲线。
㈣ 表观极化曲线与真实极化曲线
1、腐蚀金属电极的外侧电流密度与电极电位的关系曲线称为表观极化曲线。
2、金属溶解反应的
曲线称为真实极化曲线。
3、二者的区别:
前者容易直接测得而后者往往不易直接测得。
4、二者的联系:
如果可以直接通过适当的实验手段测得两条真实极化曲线之一,那么只要再测定一下表观极化曲线,就可以利用极化曲线分解的办法求得另一条真实的极化曲线。
五、伊文思极化图及应用
1、腐蚀极化图又称为伊文思极化图,是一种电位-电流图,它把表征腐蚀电池特征的阴、阳极极化曲线画在同一张图上,忽略电位随电流密度变化的细节,将极化曲线画成直线的形式。
2、伊文思腐蚀极化图主要由直线代替理想极化曲线,用电流强度代替电流密度,具有更大的广泛性、实用性和易用性,在研究腐蚀问题及解释电化学腐蚀现象时,使用和分析十分方便。
3、伊文思极化图的应用:
⑴阴极过程控制的腐蚀过程;⑵阳极过程控制的腐蚀过程;⑶欧姆电阻控制的腐蚀过程。
⑷混合控制的腐蚀过程。
六、电化学腐蚀的阴极过程
㈠ 概述
1、由阴极极化本质可知,凡能在阴极上进行得电子阴极还原反应的物质都能起到去极化剂的作用。
2、几个重要的阴极过程:
⑴析氢腐蚀;⑵吸氧腐蚀;⑶溶液中阴离子还原反应;⑷溶液中某些阳离子的还原反应;⑸不溶性产物的还原反应;⑹溶液中的某些有机化合物可能的阴极还原反应。
㈡ 析氢腐蚀:
以氢离子还原反应为阴极过程的腐蚀。
㈢ 吸氧腐蚀:
以氧的还原反应为阴极过程的腐蚀。
第四章均匀腐蚀和金属钝化
一、均匀腐蚀的概念
㈠均匀腐蚀与局部腐蚀
类别
项目
均匀腐蚀
局部腐蚀
区域
不分阴阳极
阴阳极分开
电位
相等
电池类型
微观电池
宏观电池
影响
破坏性大
危害大
㈡ 按照腐蚀的形态可将金属腐蚀分为全面腐蚀和局部腐蚀两大类。
全面腐蚀可以是均匀腐蚀,也可以是不均匀腐蚀。
均匀腐蚀的特征是腐蚀破坏均匀地发生在整个表面上,金属由于腐蚀而普遍地减薄。
二、均匀腐蚀速度的表示
㈠ 平均腐蚀速度
1、重量法:
,
;
为试样原始重量;
为试样清除腐蚀产物后的质量;
表示未清除腐蚀产物时试样质量;S表示试样的表面积;t表示腐蚀时间。
2、厚度法:
;
表示采用平均厚度变化指标表示的金属的平均腐蚀速度,mm/年;
表示金属材料的密度,
;
3、容量法:
,
;A表示金属的相对原子质量,g/mol;n表示反应中转移电子的物质的量;i为腐蚀电流密度。
㈡ 均匀腐蚀速度计算
1、活化极化控制下腐蚀速度计算。
腐蚀电流密度:
;
因此,由上式可以看出
的大小受阴阳极反应的交换电流密度、阴阳极反应的平衡电位和塔费尔斜率的影响。
具体讨论如下:
⑴两个电极反应的平衡电位的差值
的差值越大,
越大;
⑵因塔费尔斜率主要通过指数项
对
来施加影响的,因此塔费尔斜率的数值越大,
越小;
⑶阴阳极反应的交换电流密度增大都将使
增大。
2、阴极由扩散控制条件下腐蚀速度计算:
腐蚀电流密度决定于去极化剂的极限扩散电流密度。
㈢ 金属的钝化
1、金属钝化现象
⑴金属钝化现象:
某些金属在特定介质中,表面会发生耐腐蚀性能的突然转变,如某些性质的金属变得较不活泼;
⑵经过钝化现象的研究,归纳出钝化的金属腐蚀过程有如下几个特点:
①金属处在钝化状态时,腐蚀速度非常低;②金属发生钝化都伴随着电位的较大范围的正移;③金属发生钝化的钝化现象只是金属表面性质的改变,是金属的界面现象。
2、阳极钝化
⑴采用外加阳极电流的方法,使金属由活性状态变为钝态的方法称为阳极钝化或电化学钝化。
金属表面状态的突变使金属溶解速度急剧下降的过程称为金属的钝化,金属钝化后所获得的高耐蚀性质,被称为钝性,金属表面钝化后所处的非活化状态,被称为钝态。
⑵金属在钝化现象出现之前,主要存在阳极的电化学极化和浓差极化。
⑶阳极极化曲线被四个特征电位值即金属自腐蚀电位
、致钝电位
、维钝电位
及过钝化电位
分成四个区域。
3、弗拉德电位与金属钝态的稳定性
4、腐蚀金属的自钝化
⑴腐蚀过程中,在没有任何外加极化的情况下,由于腐蚀介质中氧化性的去极化剂的还原而促使金属发生钝化,称为金属的自钝化。
⑵为了产生并实现金属的自钝化现象,介质中的氧化剂必须满足以下两个条件:
①氧化剂的氧化还原平衡电位要高于该金属的阳极致钝电位,即
;②氧化剂的还原反应的相应的阴极电流密度或阴极极限扩散电流密度必须大于金属的致钝电流密度,即
。
⑶金属在腐蚀介质中的钝化行为曲线,随着介质的氧化性和浓度的不同可有如下情况:
①氧化剂的氧化性很弱;②氧化剂的氧化性较弱或浓度不高,阴极、阳极极化曲线有三个交点;③中等浓度的氧化剂;④强氧化剂。
⑷氧对金属的腐蚀具有双重作用:
氧一方面可做去极化剂,使金属溶解;另一方面,氧在一定浓度下又可与溶解产物结合生成相应的钝化膜,阻止金属进一步溶解而发生表面钝化,起到钝化剂的作用。
5、金属钝化理论
⑴成相膜理论:
金属的钝态是由于金属和介质作用时在金属表面上生成一种非常薄且致密的覆盖性良好的保护膜,这种表面膜是作为一个独立的相存在的,它能够把金属与腐蚀介质机械地隔离,从而使金属的溶解速度得以降低,使金属表面由活化状态变为钝化状态。
⑵吸附理论:
金属钝化并不需要在金属表面生成成相膜,而只需在金属表面或部分表面生成氧或含氧的粒子吸附层就可以使金属表面进入钝态。
这些粒子吸附在金属表面上,能够改变金属/溶液界面的结构,并使阳极的活化能显著提高而发生钝化。
吸附理论认为,金属呈现钝化现象是由于金属表面本身反应能力的降低,而不是由于膜的机械隔离作用。
6、影响金属钝化的因素
⑴金属及合金成分的影响;
⑵钝化剂的性质、浓度影响;
⑶活性离子对钝化膜的破坏作用;
⑷介质温度对金属的钝化有很大影响。
第五章局部腐蚀
一、电偶腐蚀
㈠ 概述
1、当两种金属或合金在腐蚀介质中相互接触时,电位较负的金属或合金比它单独处于腐蚀介质中时腐蚀速度增大,而电位较正的金属或合金的腐蚀速度反而减小,得到一定程度的保护,这种腐蚀现象称为电偶腐蚀,又称为接触腐蚀或异金属腐蚀。
2、在电偶腐蚀现象中,电位较负的阳极性金属腐蚀速度加大的效应,称为电偶腐蚀效应;而电位较正的阴极性金属腐蚀速度减小的效应,称为阴极保护效应。
3、需要注意的是:
电偶腐蚀不单单指两种金属的接触造成的腐蚀,某些金属(如碳钢)与某些非金属的电子导体(如石墨材料)相互接触时,也会产生电偶腐蚀。
㈡ 电偶腐蚀的原理:
两种或两种以上的金属、金属与非金属的电子导体、同一金属的不同部位,在腐蚀介质中互相接触时由于存在腐蚀电位的不同,将会构成宏观腐蚀电池,成为腐蚀电池的两个电极,电子可以在两个电极间直接转移,而这两个电极上进行的电极反应也将进行必要的调整,以满足电极界面电荷的平衡关系。
㈢ 宏观腐蚀电池对微观腐蚀电池的影响
1、定义:
由于宏观腐蚀电池的作用将使微观电池的电流发生改变,将这种效应称为差异效应。
如果宏观电偶腐蚀电池使内部腐蚀电池电流减少,则此效应为正差异效应;相反,如果引起内部腐蚀微电池电流增加,则称为负差异效应。
2、例证:
正差异效应可以通过锌在稀硫酸中和铂接触的实验来验证。
㈣ 影响电偶腐蚀的因素:
1、金属材料的电位差值;2、极化作用;3、阴阳极面积比。
㈤ 防止电偶腐蚀的措施
1、组装构件应尽量选择在电偶序表中位置相近的金属;
2、对于不同金属构成的结构部件应该尽量避免形成大阴极小阳极的接触结构;
3、采用绝缘材料或保护性阻挡涂层分隔电偶腐蚀的接触部位;
4、采用电化学保护。
二、点腐蚀
㈠ 概述
1、定义:
金属材料在腐蚀介质中经过一定的时间后,在整个暴露于腐蚀介质中的表面上个别的点或微小区域内出现腐蚀小孔,而其他大部分表面不发生腐蚀或腐蚀很轻微,且随着时间的推移,蚀孔不断向纵深方向发展,形成小孔状腐蚀坑,这种腐蚀形态称为点腐蚀,简称点蚀,也叫做小孔腐蚀或孔蚀。
2、主要特征:
①通常发生在易钝化金属或金属表面上,同时往往在腐蚀介质中存在侵蚀性阴离子及氧化剂;②点蚀是一种外观隐蔽而破坏性极大的一种局部腐蚀形式;③蚀孔的阳极溶解速度相当大且具有自动加速的特点;④点蚀还能加剧其他类局部腐蚀。
㈡ 点蚀发生的机理
1、点蚀的萌生:
⑴金属表面在化学性质或物理性质上是不均匀的,总是存在各种各样的不完整性;⑵在溶液中存在有侵蚀性阴离子(如氯离子)以及溶解氧或氧化剂存在,氧化剂的作用主要是使金属的腐蚀电位升高,达到或超过某一临界电位。
这两个条件具备时就在钝化膜上生成了活性的溶解点,称为点蚀核。
除了氧化剂外,使用外加的阳极极化方式也可以使电位上升,超过临界电位,导致点蚀的发生。
这个临界电位被称为击穿电位或点蚀电位
。
2、点蚀的生长:
如果电位足够正,以导致充分的酸化或侵蚀性阴离子的集聚,克服再钝化的影响,促使点蚀孔的继续生长。
㈢ 影响点蚀的因素
1、环境因素:
⑴卤素离子及其他阴离子;⑵溶液中的阳离子和气体物质;⑶溶液的pH值;⑷温度的影响;⑸介质流速。
2、材料因素:
⑴金属本性;⑵合金元素的影响;⑶冷加工与热处理;⑷显微组织;⑸表面状态。
㈣点蚀的控制:
1、选用点蚀缓蚀剂;2、合理选择耐腐蚀材料;3、电化学保护。
三、缝隙腐蚀
㈠ 概述
1、缝隙腐蚀是因金属与金属、金属与非金属的表面间存在狭小缝隙,并有腐蚀介质存在时而发生的局部腐蚀形态。
2、特征:
⑴不论金属或合金的电极电位是正还是负,都能够发生缝隙腐蚀,但是特别容易发生在依靠钝化而具有耐蚀性的金属及合金上,越容易钝化的金属,对缝隙腐蚀就越敏感;⑵腐蚀介质可以是任何的侵蚀性溶液,可以是酸性、中性或碱性,但是含有侵蚀性阴离子的溶液更加容易引起缝隙腐蚀;⑶与点蚀相比,对同一种合金而言,缝隙腐蚀更易发生,即缝隙腐蚀的临界电位要比点蚀电位低。
3、机理:
若金属构成一定的缝隙结构,缝内与缝外构成氧浓度差异宏观电池,又由于闭塞电池的自催化作用使缝隙腐蚀加速,造成更加严重的破坏。
4、点蚀与缝隙腐蚀的区别:
⑴点蚀可在周围腐蚀介质能自由到达的金属表面上的各种薄弱点处萌生,而缝隙腐蚀仅集中于体系的几何形状使介质的到达受到限制的这部分表面上,即发生在侵蚀性介质可以透入的间隙中;⑵缝隙腐蚀多数发生在氯化物溶液中,也可发生在其他腐蚀性液体中,而点蚀通常局限在含有活性阴离子的介质中。
几乎所有的金属或合金都会发生缝隙腐蚀,而点蚀多数发生在容易钝化的金属和合金表面。
⑶点蚀可在静止的和运动的溶液中发生,并可在金属表面上的非均质处萌生,例如非金属夹杂处、晶界、位错露头处等。
而缝隙腐蚀容易在间隙中溶液静止的条件下发生,也可由于金属镀覆层或涂层的微观缺陷而萌生;⑷由于缝隙中溶液的不动性,缝内溶液与外部本体溶液则交换困难,因此,在狭窄缝隙中很快形成闭塞电池,比未被腐蚀产物覆盖的缝隙中的电解液的成分变化得多,缝隙腐蚀的萌生电位也因而通常比点蚀更负。
在多数情况下,缝隙腐蚀的萌生比点蚀更快。
在环形极化曲线上的
区间,对点蚀而言,原有点蚀可以发展,但不产生新的孔蚀,而缝隙腐蚀在该电位区内,既能产生新的蚀坑,原有蚀坑也能发展。
5、影响缝隙腐蚀的因素:
⑴缝隙的几何因素;⑵溶液中氧的浓度;⑶温度的影响;⑷pH值;⑸溶液中氯离子浓度;⑹腐蚀液流速;⑺材料因素。
6、防止缝隙腐蚀的措施:
⑴合理设计与施工;⑵阴极保护;⑶合理选择耐蚀材料;⑷应用缓蚀剂。
四、丝状腐蚀
五、晶间腐蚀
㈠概述:
沿着金属的晶粒边界发生的局部选择性腐蚀称为晶间腐蚀,它是由于晶界和晶粒之间的电化学的不均一性而造成的。
㈡机理
1、贫化理论:
由于在晶界析出新相,造成在晶界的合金成分中某一种成分贫乏,进而使晶粒和晶界之间出现电化学性质上不均匀,晶界因而遭受严重腐蚀。
2、晶界区杂质或第二相选择溶解理论:
由于在敏化温度(出现晶间腐蚀敏感性的温度称为敏化温度)下晶界析出了
-相的缘故。
㈢影响因素:
1、加热温度与时间的影响;2、合金成分的影响;3、防止晶间腐蚀的措施。
六、应力作用下的局部腐蚀
㈠应力腐蚀开裂
1、概述:
⑴定义:
是指受固定拉伸应力作用的金属材料在某些特定的腐蚀介质中,由于腐蚀介质与应力的协同作用而发生的脆性断裂现象,英文简称SCC。
⑵产生条件:
①敏感材料;②特定环境;③拉伸应力。
⑶共同特征:
①每种合金的应力腐蚀开裂只是对某些特定的介质敏感,而其他的介质中可能就不会发生应力腐蚀开裂的现象;②发生应力腐蚀开裂必须要有应力存在,特别是拉伸应力;③应力腐蚀开裂是一种典型的滞后破坏。
2、应力腐蚀机理:
阳极快速溶解理论:
在发生应力腐蚀的环境里,金属通常是被钝化膜覆盖,不与腐蚀介质直接接触,只有钝化膜遭受局部破坏后,裂纹才能形核,并在应力作用下裂纹尖端沿某一择优路径定向活化溶解,导致裂纹扩展,最终发生断裂。
因此,应力腐蚀经历了膜破裂、溶解、断裂这三个阶段。
3、防止应力腐蚀开裂的措施:
⑴控制环境;⑵控制应力;⑶改善材质;⑷电化学保护。
第六章自然环境中金属的腐蚀
一、金属在自然水中的腐蚀
㈠海水腐蚀
1、海水的性质:
⑴含盐量;⑵电导率;⑶含氧量;⑷pH值;⑸温度;⑹流速;⑺海洋生物。
2、海水腐蚀的电化学特征:
⑴与一般介质不同,海水电导率高,金属在其中既存在活性很大的微观腐蚀原电池,也存在活性很大的微观原电池;⑵除镁以外绝大多数金属的腐蚀是氧去极化腐蚀,腐蚀速度受限于氧的扩散速度;⑶由于海水中氯离子含量很高,因此,大部分的金属,如钢、铸铁在海水中不能建立钝态;⑷海洋环境复杂,不同的海洋区域,金属的腐蚀行为有较大不同。
3、防止海水腐蚀的措施:
⑴根据腐蚀性能和结构使用性能要求合理选材;⑵阴极保护;⑶表面覆盖层保护。
二、土壤腐蚀
1、金属的土壤腐蚀过程:
⑴阳极过程;⑵阴极过程。
2、土壤腐蚀的形式:
⑴腐蚀微观电池和腐蚀宏观电池:
土壤中的腐蚀宏观电池主要有氧浓差电池、盐浓差电池、酸浓差电池、温差电池、应力腐蚀电池等几种;⑵由于杂散电流引起的腐蚀;⑶土壤中的微生物腐蚀。
3、土壤腐蚀的影响因素:
⑴土壤电阻率;⑵土壤含气(氧)量;⑶土壤盐分;⑷土壤pH值和温度。
4、土壤腐蚀的防护措施:
⑴涂层保护;⑵阴极保护:
①牺牲阳极阴极保护法;②外加电流阴极保护法。
三、大气腐蚀
㈠大气腐蚀的分类:
1、干的大气腐蚀;2、潮的大气腐蚀;3、湿的大气腐蚀。
㈡大气腐蚀的过程、机理和特征
1、过程:
⑴水汽膜的形成:
①毛细凝聚的条件;②吸附凝聚的条件;③化学凝聚的条件;⑵湿膜的形成。
2、机理:
金属表面液膜厚度的大小,决定了干的、潮的、湿的三种类型大气腐蚀的机理。
3、特征:
⑴一般电解液中腐蚀电池都是短路的,介质欧姆电阻很小,可以忽略不计。
而在极薄的电解液膜下,欧姆电阻很大,不可忽视;⑵随着表面液膜厚度的变化,大气腐蚀的阴阳极过程及影响因素也会发生变化;⑶由于液膜的氧和金属离子含量都很高,金属离子水化过程速度较慢,使得阳极极化增大,易钝金属可出现阳极钝化的特征;⑷大气腐蚀形成的腐蚀产物存留在金属表面,形成具有一定保护作用的腐蚀产物膜。
㈢大气腐蚀的影响因素:
1、金属表面因素;2、大气的成分:
⑴
;⑵尘粒;⑶其他杂质;3、气候条件:
⑴大气的相对湿度;⑵气温;⑶温差;⑷风向;⑸风速。
第七章化工生产中的腐蚀
一、化工生产中的腐蚀与防护
二、无机化工生产中的腐蚀与防护
㈠ 概述:
无机化工生产包括酸、碱、盐的生产。
㈡ 无机酸生产中的腐蚀与防护
1、硫酸生产中的腐蚀与防护:
对于硫酸浓度较大,而温度较低的一般都采用碳钢制塔体,内衬耐酸砖板防腐。
对于酸浓度较低,一般采用玻璃纤维增强的塑料制造,或用硬聚氯乙烯塑料制造。
2、硝酸生产中的腐蚀与防护:
硝酸浓度不高,设备材料可采用低碳不锈钢;但是对于浓度超过68.4%的浓硝酸,不能使用不锈钢材料,一般使用高硅铁或钛合金材料。
㈢ 氯碱工业中的腐蚀与防护
1、食盐水溶液的腐蚀与防护:
食盐水溶液的腐蚀主要是氧去极化腐蚀。
在食盐水溶液中碳钢设备发生流水线腐蚀,这是由于在液面附近形成了氧浓差电池。
2、电解腐蚀与防护
3、氯的腐蚀与防护
4、碱液和固体碱生产中的腐蚀与防护:
⑴碱液浓缩过程:
以三效顺流自然循环工艺流程为例,在碱液蒸发过程中,一效蒸发器可全部采用碳钢制造,因为一效蒸发过程中碱液浓度较低;二效蒸发器可采用碳钢壳体,换热管和管板采用不锈钢;三效蒸发器外壳体可用碳钢,其他部位采用镍材料制造。
⑵固体碱生产过程:
无论碳钢还是不锈钢都不耐碱的腐蚀,一般使用镍材料。
第八章电化学保护
一、概述
1、所谓电化学保护,是指通过改变金属的电位,使其极化到金属电位-pH图中的免蚀区或钝化区,从而降低金属腐蚀速度的一种方法。
2、以常用的结构金属铁的电化学保护为例。
在铁的电位-pH值简图上,铁的状态可以划分为腐蚀区、免蚀区、钝化区和超钝化区四个区域,分别对应着热力学稳定态、腐蚀态、钝化态和超钝化态四种状态。
对铁而言,电化学保护有阴极保护和阳极保护:
首先可以通过阴极极化,使金属电位从腐蚀区或超钝化区负移至免蚀区或钝化区;其次可以通过阳极极化,使处于腐蚀区的金属电位正移至钝化区;使处于腐蚀区或超钝化区的金属免于腐蚀。
二、阴极保护
1、原理:
通过对被保护结构施加阴极电流使其阳极腐蚀溶解速度降至最低。
如果由外加电源向金属输送阴极电流,则称为外加电流阴极保护法;如果阴极电流由其他一种电位更负的金属来提供,则称为牺牲阳极阴极保护法。
2、对金属结构物实施阴极保护必须具备以下条件:
⑴腐蚀介质必须导电,并且有足以建立完整阴极保护电回路的体积量;⑵金属材料在所处介质中应易于进行阴极极化,即阴极极化率要大,但在阴极极化过程中化学性质应稳定;⑶被保护设备的形状、结构不宜太复杂。
3、阴极保护的基本控制参数:
⑴最小保护电位;⑵最小保护电流密度;
4、外加电流阴极保护法
⑴达到最小保护电位时金属所需的外加电流密度称为最小保护电流密度;
⑵要使金属得到完全的保护,必须将金属阴极极化到其腐蚀微电池阳极的平衡电位;
⑶腐蚀产物的形态和腐蚀介质条件对保护电流密度的大小也有很大影响;
⑷外加阴极极化有时会产生负保护效应,即使金属腐蚀更趋严重;
⑸由于腐蚀介质本身存在或大或小的电阻,因此在对金属实施阴极保护时,介质中存在随保护电流增加而增大的欧姆电压降,使得实测的金属结构物的电位要比真正的金属结构物对介质的电位负。
5、外加电流阴极保护系统:
⑴直流电源;⑵辅助阳极:
要求:
①具有良好的导电性和较小的表面输出电阻,极化小,排流量(在一定的电压下单位面积的阴极上能通过的电流)大;②阳极溶解速度低,耐蚀性好;③可靠性高,有足够的机械强度,耐磨,耐机械振动;④成本低,容易获得,方便加工;⑶参比电极:
要求:
①电极反应可逆;②电极电位的温度系数小,温度变化引起的电极电位变化速度快,无电位滞后现象;③腐蚀介质与参比电极内溶液无互相污染;④电极坚固耐用,具有一定的机械强度,耐磨、耐冲刷,使用寿命长;⑤电极制造、维护和使用方便,价格便宜;⑷其他装置还有阳极屏、电缆等。
6、牺牲阳极阴极保护法
⑴基本原理:
牺牲阳极阴极保护的基本作用过程是:
当一电位较负的金属与被保护金属结构连接时,两者构成宏观的腐蚀电池;其中电位较正的金属结构物成为宏观腐蚀电池的阴极,而电位较负的金属成为阳极,结果前者将受到保护,而后者会加速腐蚀。
⑵牺牲阳极保护系统由牺牲阳极、导线组成,此外还可能有填包料、绝缘垫、屏蔽层、接线盒等辅助物件。
⑶牺牲阳极:
具备的条件:
①足够负的电位,在工作时保持足够大的驱动电压;②较高的理论发生电量,较高的电流效率;③较小的阳极极化率,容易活化,可保证自身电位及输出电流的稳定;④溶解均匀,腐蚀产物松软易落,不黏附于阳极表面形成高阻硬壳;⑤价格便宜,来源充足,制作简便,腐蚀产物无公害。
常用的牺牲阳极材料主要有镁基合金、锌基合金和铝基合金三大类。
7、两种阴极保护方法的比较
外加电流阴极保护法
牺牲阳极阴极保护法
需要外加电源
无需加电源
输出电流电压可调,可输出大的保护电流,阳极有较保护半径大
驱动电压低,保护电流小且不可调节,阳极有效保护半径小
有可能造成过保护,对邻近金属结构物可能产生干扰
一般不会造成过保护,对邻近金属结构物干扰小
阳极数量少,保护