专题3从海水中获得的化学物质.docx
《专题3从海水中获得的化学物质.docx》由会员分享,可在线阅读,更多相关《专题3从海水中获得的化学物质.docx(62页珍藏版)》请在冰豆网上搜索。
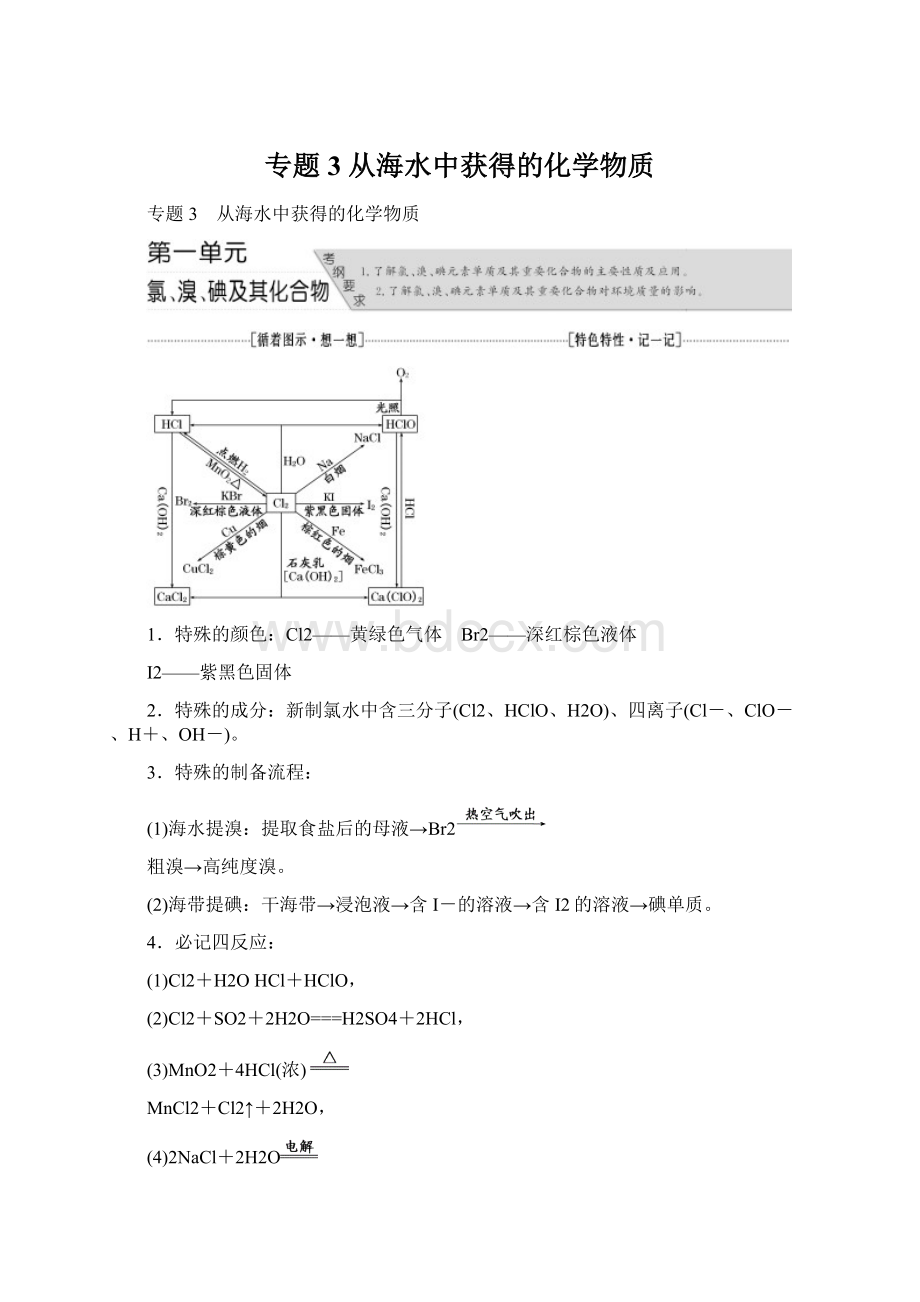
专题3从海水中获得的化学物质
专题3 从海水中获得的化学物质
1.特殊的颜色:
Cl2——黄绿色气体 Br2——深红棕色液体
I2——紫黑色固体
2.特殊的成分:
新制氯水中含三分子(Cl2、HClO、H2O)、四离子(Cl-、ClO-、H+、OH-)。
3.特殊的制备流程:
(1)海水提溴:
提取食盐后的母液→Br2
粗溴→高纯度溴。
(2)海带提碘:
干海带→浸泡液→含I-的溶液→含I2的溶液→碘单质。
4.必记四反应:
(1)Cl2+H2OHCl+HClO,
(2)Cl2+SO2+2H2O===H2SO4+2HCl,
(3)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
(4)2NaCl+2H2O
2NaOH+H2↑+Cl2↑。
考点一
[基础自主落实]
1.氯气的物理性质
颜色
气味
毒性
密度
特性
黄绿色
刺激性气味
有毒
比空气大
易液化
[注意] 闻氯气气味的方法是用手在瓶口轻轻扇动,使极少量的Cl2飘进鼻孔。
2.从氯的原子结构认识氯气的化学性质
——氧化性
Cl
Cl-
(1)与金属反应:
当与变价金属反应生成高价金属氯化物。
①与钠反应:
2Na+Cl2===2NaCl。
②与铁反应:
2Fe+3Cl2
2FeCl3。
③与铜反应:
Cu+Cl2
CuCl2。
(2)与非金属反应
与H2反应:
H2+Cl2
2HCl。
(3)与还原性无机化合物反应
①与溴化钾溶液反应:
Cl2+2KBr===Br2+2KCl。
②与碘化钾溶液反应:
Cl2+2KI===2KCl+I2。
③与SO2水溶液反应:
Cl2+SO2+2H2O===H2SO4+2HCl。
④与FeCl2溶液反应:
2FeCl2+Cl2===2FeCl3。
3.从化合价的角度认识Cl2的化学性质
——歧化反应
氯气与水或碱反应,氯元素的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。
(1)与水反应
氯气与水反应的化学方程式:
Cl2+H2OHCl+HClO。
(2)与碱(NaOH)反应
反应的化学方程式:
Cl2+2NaOH===NaCl+NaClO+H2O。
4.次氯酸
(1)不稳定性
次氯酸分解反应的化学方程式为2HClO
2HCl+O2↑。
氯水须现用现配,保存在棕色瓶中,置于冷暗处。
(2)强氧化性
①能将有色物质氧化为无色物质,作漂白剂。
②杀菌、消毒。
(3)弱酸性
向NaClO溶液中通入少量CO2,化学方程式为2NaClO+CO2+H2O===Na2CO3+2HClO。
5.次氯酸盐
(1)漂白液
(2)漂白粉
①成分:
漂白粉的主要成分是Ca(ClO)2、CaCl2,其中有效成分是Ca(ClO)2。
②制备原理:
化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
③漂白原理:
化学方程式为Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO。
小题热身
1.判断正误(正确的打“√”,错误的打“×”)。
(1)氯气的水溶液可以导电,说明氯气是电解质(×)
(2)新制取的漂白粉是纯净物(×)
(3)Cl2通入水中的离子方程式为Cl2+H2O===2H++Cl-+ClO-(×)
(4)用pH试纸测定氯水的pH为4(×)
(5)Cl2具有很强的氧化性,在化学反应中只能作氧化剂(×)
(6)过量的铁与氯气在一定条件下反应生成FeCl2(×)
(7)次氯酸是酸性比碳酸强的弱酸(×)
2.漂白粉和明矾都用于自来水的处理,二者有何不同?
提示:
漂白粉是利用其氧化性杀菌消毒,明矾净水是利用Al3+水解产生的Al(OH)3胶体吸附水中的固体悬浮物。
[考向合作探究]
氯气的性质及应用
1.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )
A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟
B.通常状况下,干燥的氯气能和Fe反应
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸
D.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸
解析:
选B Cl2与Fe反应需要点燃或加热。
2.向下列溶液中通入氯气,现象和结论描述正确的是( )
A.品红溶液:
红色褪去,加热该褪色溶液,仍无色;氯气具有漂白性
B.紫色石蕊溶液:
先变红,后褪色;氯气与水反应生成盐酸和次氯酸
C.含酚酞的氢氧化钠溶液:
红色褪去;氯气只作氧化剂
D.硫化钠溶液:
溶液变浑浊;氯气只作还原剂
解析:
选B A项,氯气与水反应生成的次氯酸具有漂白性,能使品红溶液褪色,且加热已褪色的溶液,溶液不会恢复原来的颜色,错误;B项,氯气与水反应生成盐酸和次氯酸,盐酸使紫色石蕊溶液变红,次氯酸具有漂白性,能使变红的石蕊溶液褪色,正确;C项,氯气和NaOH溶液反应生成氯化钠、次氯酸钠和水,其中,氯气既作氧化剂,又作还原剂,次氯酸钠的漂白性和溶液碱性的减弱均会使溶液的红色褪去,错误;D项,Cl2+Na2S===2NaCl+S↓,溶液变浑浊,氯气作氧化剂,错误。
氯水的成分与性质
3.(2016·宁德模拟)某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( )
A.该实验说明Cl2分子具有漂白性
B.该实验说明H+扩散速度比HClO分子快
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,现象相同
解析:
选B HClO具有漂白性,Cl2无漂白性,A项错误。
久置的氯水主要成分为稀盐酸,无漂白性,D项错误。
HClO的漂白持久、稳定,实验后的pH试纸加热不会恢复原来的颜色,C项错误。
4.下列关于氯水的说法正确的是( )
A.向氯水中通入少量二氧化硫,氯水的漂白性增强
B.氯水中加入NaCl固体,对溶液的pH无影响
C.常温下,pH=2的氯水中:
c(Cl-)+c(ClO-)+c(OH-)=0.01mol·L-1
D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为Cl2+2HCO
===2CO2↑+Cl-+ClO-+H2O
解析:
选C A项,氯水与二氧化硫反应生成无漂白性的物质,Cl2+SO2+2H2O===4H++SO
+2Cl-,漂白性减弱,错误;B项,加入NaCl固体,c(Cl-)增大,Cl2+H2OH++Cl-+HClO平衡逆向移动,c(H+)减小,溶液的pH增大,错误;C项,氯水的pH=2,说明溶液中c(H+)=0.01mol·L-1,根据电荷守恒,c(H+)=c(Cl-)+c(ClO-)+c(OH-),正确;D项,HClO的酸性弱于H2CO3,正确的离子方程式为Cl2+HCO
===CO2↑+Cl-+HClO,错误。
[知能存储]
探究氯水成分的实验方法
新制氯水为浅黄绿色有刺激性气味的液体,由多种成分组成决定了它具有多重性质,在与不同的试剂反应时,起作用的微粒不同。
具体的探究过程见下表:
所加试剂
实验现象
参与反应的微粒
离子方程式或解释
AgNO3溶液
白色沉淀
Cl-
Cl-+Ag+===AgCl↓
Na2CO3固体
有气泡产生
H+
2H++CO
===
CO2↑+H2O
有色布条
布条颜色褪去
HClO
发生氧化还原反应
SO2
黄绿色褪去
Cl2
SO2+Cl2+2H2O===
4H++2Cl-+SO
石蕊溶液
先变红后褪色
H+、HClO
酸性和漂白性
次氯酸、次氯酸盐的强氧化性
5.(2014·浙江高考)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。
25℃时氯气—氯水体系中存在以下平衡关系:
Cl2(g)Cl2(aq) K1=10-1.2
Cl2(aq)+H2OHClO+H++Cl- K2=10-3.4
HClOH++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
下列表述正确的是( )
A.Cl2(g)+H2O2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
解析:
选C Cl2(g)+H2O2H++ClO-+Cl-,K=K1×K2×Ka,由图可得Ka=10-7.5,故K值为10-12.1,A项错误;根据电荷守恒得,c(H+)=c(OH-)+c(ClO-)+c(Cl-),而c(HClO)由于部分电离而不等于c(Cl-),B项错误;已知HClO的杀菌能力比ClO-强,从图中可知,c(HClO)在pH=7.5时比在pH=6.5时低,则杀菌效果较差,C项正确;夏季温度高,氯的溶解能力变差,杀菌效果也变差,D项错误。
6.在淀粉�KI溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。
下列判断不正确的是( )
A.氧化性:
ClO->I2>SO
C.次氯酸钠可以与亚硫酸钠大量共存
D.向氯水中加入亚硫酸钠溶液,氯水褪色
解析:
选C 在酸性条件下发生反应:
ClO-+2H++2I-===Cl-+I2+H2O,I2遇淀粉溶液变为蓝色,证明氧化性ClO->I2;在溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,是因为又发生了反应:
I2+H2O+SO
===2I-+2H++SO
,证明氧化性I2>SO
,所以微粒的氧化性:
ClO->I2>SO
,A正确。
漂白粉的有效成分是Ca(ClO)2,电离产生ClO-,由于氧化性ClO->I2,所以漂白粉溶液可使淀粉KI试纸变蓝,B正确。
由于氧化性:
ClO->SO
,所以当次氯酸钠与亚硫酸钠混合时,会发生反应:
ClO-+SO
===Cl-+SO
,因此二者不能大量共存,C错误。
在氯水中会发生反应产生次氯酸,Cl2+H2OHCl+HClO,由于氧化性ClO-+SO
===Cl-+SO
,所以向氯水中加入亚硫酸钠溶液,会发生反应:
ClO-+SO
===Cl-+SO
,使ClO-浓度减小,氯气的溶解平衡正向移动,氯气的浓度减小,故氯水会逐渐褪色,D正确。
[知能存储]
次氯酸盐的强氧化性
ClO-不论是在酸性、碱性条件下都能跟亚铁盐、碘化物、硫化物、亚硫酸盐等发生氧化还原反应,即ClO-与I-、Fe2+、S2-、SO
不论是在酸性环境还是在碱性环境中均不能大量共存。
如漂白粉遇到亚硫酸盐:
Ca2++ClO-+SO
===CaSO4↓+Cl-。
考点二
[基础自主落实]
1.溴、碘的提取
(1)从海水中提取溴的方法
①工艺流程:
②基本步骤及主要反应:
a.氧化:
向苦卤中通入Cl2,将Br-氧化为Br2,反应的离子方程式为Cl2+2Br-===Br2+2Cl-。
b.吹出:
利用溴的挥发性,通入热空气或水蒸气,吹出的溴蒸气冷凝后得到粗溴。
c.精制:
粗溴精制后得到高纯度溴。
(2)从海洋植物中提取碘的主要工艺
①用水浸泡海带(或海藻)灼烧后的灰烬。
②向水中通入适量的氯气,使碘离子转化为碘单质。
2NaI+Cl2===I2+2NaCl。
③过滤,用有机溶剂萃取碘单质。
2.溴、碘的性质
(1)溴、碘单质的物理性质比较
性质
Br2
I2
颜色
深红棕色
紫黑色
状态
液体
固体
溶
解
性
水中
可溶
可溶
酒精、CCl4等有机溶剂中
易溶
易溶
特性
易挥发、有毒
易升华、遇淀粉变蓝色
保存
溴液面上需水封,用棕色细口瓶盛放并用蜡密封,置冷暗处
棕色广口瓶
(2)化学性质
向KI溶液中滴加溴水、向NaBr溶液中滴加氯水,反应的离子方程式分别为2I-+Br2===I2+2Br-,2Br-+Cl2===Br2+2Cl-,说明卤素单质间的氧化性顺序为:
Cl2>Br2>I2;卤素离子间的还原性顺序为:
I->Br->Cl-。
3.卤素离子的检验方法——沉淀法
未知液
生成
小题热身
1.判断正误(正确的打“√”,错误的打“×”)。
(1)从海水中提取物质都必须通过化学反应才能实现(×)
(2)实验室从海带中提取单质碘的方法是:
取样→灼烧→溶解→过滤→萃取(×)
(3)实验室保存液溴时要加少量水进行水封,不用橡胶塞(√)
(4)向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色说明原溶液中有I-(√)
(5)向碘水中通入SO2,反应的离子方程式为SO2+I2+H2O===SO
+2I-+2H+(×)
(6)双氧水中加入稀H2SO4和KI溶液的离子方程式为H2O2+2H++2I-===I2+2H2O(√)
(7)I-遇淀粉变蓝色(×)
(8)用AgNO3溶液可以鉴别KCl和KI(√)
2.海水提取溴的过程中,为什么从提取粗食盐的母液中提取,而不是直接从海水中提取?
提示:
溴离子得到了浓缩,减少了处理海水的量,提高了制溴的效益。
[考向合作探究]
氯、溴、碘单质氧化性的比较
1.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。
玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
①
②
③
④
A
黄绿色
橙色
蓝色
白色
B
无色
橙色
紫色
白色
C
黄绿色
橙色
蓝色
无色
D
黄绿色
无色
紫色
白色
解析:
选A 由①处产生的Cl2通过②时发生反应Cl2+2NaBr===2NaCl+Br2,通过③时发生反应Cl2+2KI===2KCl+I2,通过④时发生反应Cl2+2NaOH===NaCl+NaClO+H2O,因Cl2为黄绿色,Br2为橙色,淀粉遇I2变蓝,Cl2遇碱产生NaCl、NaClO,可知应选A。
2.(2016·临沂二模)某混合溶液中含有NaI、NaBr、Na2SO4三种溶质,其物质的量均为1mol,向混合溶液中通入一定量的氯气。
下列说法正确的是( )
A.将溶液蒸干最多可以得到4molNaCl
B.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4
C.向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量
D.若通入氯气的体积为22.4L(标准状况),反应的离子方程式为2I-+Cl2===I2+2Cl-
解析:
选B 氯气与硫酸钠不反应,因此将溶液蒸干最多可以得到2molNaCl,A错误;若氯气与部分的溴化钠反应,则将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4,B正确;向溶液中滴加KI淀粉溶液,溶液变蓝,说明有碘生成,氯气可能只与部分的NaI反应,C错误;D项,正确的离子方程式为2I-+Cl2===I2+2Cl-、2Br-+Cl2===Br2+2Cl-,错误。
[知能存储]
(1)Br2在常温下呈液态,是唯一的液态非金属单质。
(2)I2遇淀粉显蓝色。
用湿润的淀粉�KI试纸检验Cl2,其实质是Cl2+2I-===2Cl-+I2。
此外碘是常温下固体单质中唯一的双原子分子。
溴、碘的提取
3.从海带中提取碘的实验过程涉及下列操作,其中正确的是( )
解析:
选D 灼烧海带应用坩埚,A项错误;过滤时应用玻璃棒引流,B项错误;苯的密度比水的小,萃取了单质碘的苯在上层,应从分液漏斗的上口倒出,C项错误。
4.海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
(1)步骤①反应的离子方程式是_____________________________________________。
(2)步骤③反应的化学方程式是_____________________________________________。
从理论上考虑,下列也能吸收Br2的是________。
A.NaOH B.FeCl2
C.Na2SO3D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80~90℃。
温度过高或过低都不利于生产,请解释原因:
________________________________________________________________
________________________________________________________________________
解析:
(1)
(2)离子方程式和化学方程式分别为2Br-+Cl2===Br2+2Cl-,SO2+Br2+2H2O===2HBr+H2SO4;只从理论上考虑,NaOH具有强碱性,能吸收Br2,Fe2+、SO
具有强还原性也能吸收Br2,但Br2在水中的溶解度较小,不能用水吸收。
(3)温度过高,大量水蒸气随溴排出,溴气中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低。
答案:
(1)2Br-+Cl2===Br2+2Cl-
(2)SO2+Br2+2H2O===H2SO4+2HBr ABC
(3)若温度过高,大量水蒸气随溴排出,溴气中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低
[探规寻律]
海带中含有碘元素的检验
(1)反应原理:
2H++2I-+H2O2===I2+2H2O
(2)实验步骤及证明方法
卤素离子的检验方法
5.下列说法错误的是( )
A.(2014·海南高考)CCl4可用于鉴别溴水和碘水
B.(2014·重庆高考)用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2
C.(2014·大纲卷)用AgNO3溶液可以鉴别KCl和KI
D.(2014·四川高考)验证Br2的氧化性强于I2的方法是将少量溴水加入KI溶液中,再加入CCl4振荡、静置,可观察到下层液体呈紫色
解析:
选B Br2(g)和NO2均具有强氧化性,均能使湿润的碘化钾淀粉试纸变蓝,故无法鉴别。
6.鉴别NaCl、NaBr、NaI可以选用的试剂是( )
①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④硝酸、AgNO3溶液 ⑤氯水、苯 ⑥FeCl3溶液、CCl4
A.①②④ B.②③⑥
C.②④⑤D.④⑤⑥
解析:
选C ①NaCl、NaBr、NaI中加碘水和淀粉溶液均变蓝色;②氯水加入NaBr、NaI中后,再加CCl4萃取,下层分别为橙红色和紫红色,可以鉴别;③溴水与NaCl、NaBr不反应,与NaI反应生成I2,再用苯萃取后,前两种上层均为橙红色,无法鉴别;④NaCl、NaBr、NaI与AgNO3溶液反应分别生成AgCl、AgBr、AgI沉淀,且均不溶于稀HNO3,沉淀颜色依次为白色、淡黄色、黄色;⑤与②的原理相似,只是有色层在上层;⑥FeCl3溶液只能氧化I-生成I2,不能鉴别。
[知能存储]
卤素离子的其他检验方法
(1)置换——萃取法
未知液
有机层呈
(2)氧化——淀粉法检验I-
未知液
蓝色溶液,表明有I-
考点三
[基础自主落实]
1.氯气的工业制法——氯碱工业
(1)制备原理:
电解饱和食盐水的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑。
(2)电解装置
(3)产物检验
①将a管上收集到的气体靠近火焰,有轻微爆鸣声,该气体为H2;
②从b管导出的气体能使湿润的淀粉碘化钾试纸变蓝,该气体为Cl2。
2.氯气的实验室制法
(1)制备流程
(2)验满方法
①将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。
②将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
③实验室制取Cl2时,常常根据氯气的颜色判断是否收集满。
(3)注意事项
①必须用浓盐酸,稀盐酸不反应。
②为了减少制得的Cl2中HCl的含量,加热温度不宜过高,以减少HCl挥发。
③实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气。
④尾气吸收时,不能使用澄清的石灰水,因为石灰水浓度太小,吸收不完全。
小题热身
1.判断正误(正确的打“√”,错误的打“×”)。
(1)(2014·天津高考)制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体(×)
(2)(2014·大纲卷)除去Cl2中少量HCl气体的方法是将混合气体依次通入盛有饱和食盐水和浓H2SO4的洗气瓶(√)
(3)(2013·江苏高考)MnO2与浓盐酸反应制Cl2的离子方程式:
MnO2+4HCl
Mn2++2Cl-+Cl2↑+2H2O(×)
(4)氯气在饱和食盐水中的溶解度小于在纯水中的溶解度(√)
(5)实验室用MnO2和稀盐酸共热制取少量氯气(×)
(6)用NaOH溶液吸收多余的Cl2时,导气管不能伸到液面以下,原因是防止倒吸(×)
2.(2011·全国高考)下图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
装置B、C、D的作用分别是:
B______________________________________________________________________;
C______________________________________________________________________;
D______________________________________________________________________。
答案:
向上排气收集氯气 安全作用,防止D中的液体倒吸进入集气管B中 吸收尾气,防止氯气扩散到空气中污染环境
3.实验室用MnO2和浓盐酸来制取氯气,主要操作有:
①将蒸馏烧瓶固定在铁架台上;②把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定好铁圈,放好石棉网;③用药匙向蒸馏烧瓶中加入MnO2,再向分液漏斗中加浓盐酸,并将导管放入集气瓶中;④检查气密性;⑤在蒸馏烧瓶上装好分液漏斗,连接好导管。
最好的实验操作顺序是__________。
答案:
②①⑤④③
[考向合作探究]
氯气是一种性质活泼的气体,以氯气的实验室制备、性质探究为素材的实验题目在高考实验类试题中占有较大的比重。
如2015年江苏卷T19、福建卷T25、海南卷T17、重庆卷T9。
解答此类试题需建立气体制备与性质探究实验的解题流程:
[题组训练]
1.下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
A.a—b—c—d—e—f—g—h B.a—e—d—c—b—h—i—g
C.a—d—e—c—b—h—i—gD.a—c—b—d—e—h—i—f
解析:
选B 实验室制取FeCl3的实验流程为:
故仪器连接顺序为a→e→d→c→b→h→i→g。
2.(2015·海南高考)工业上,向500~600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。
现用如图所示的装置模拟上述过程进行实验。
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为________________________
_________________________________________________