实用参考高三化学复习化学工艺流程题docx.docx
《实用参考高三化学复习化学工艺流程题docx.docx》由会员分享,可在线阅读,更多相关《实用参考高三化学复习化学工艺流程题docx.docx(13页珍藏版)》请在冰豆网上搜索。
实用参考高三化学复习化学工艺流程题docx
化学工艺流程题
一.完整的物质制备化工生产流程一般具有下列特点
原料―→对原料的预处理―→核心化学反应―→产品的提纯、分离
―→目标产物
二.解题策略
(1)审题干:
准确分析题干中的信息,如生产目的、原料成分、产品成分、新物质的性质及相关反应等,进而分析每个生产环节所发生的反应和操作。
(2)审设问:
结合题中的问题,回到流程图中找答案。
三.题型的结构(题头题干题尾)
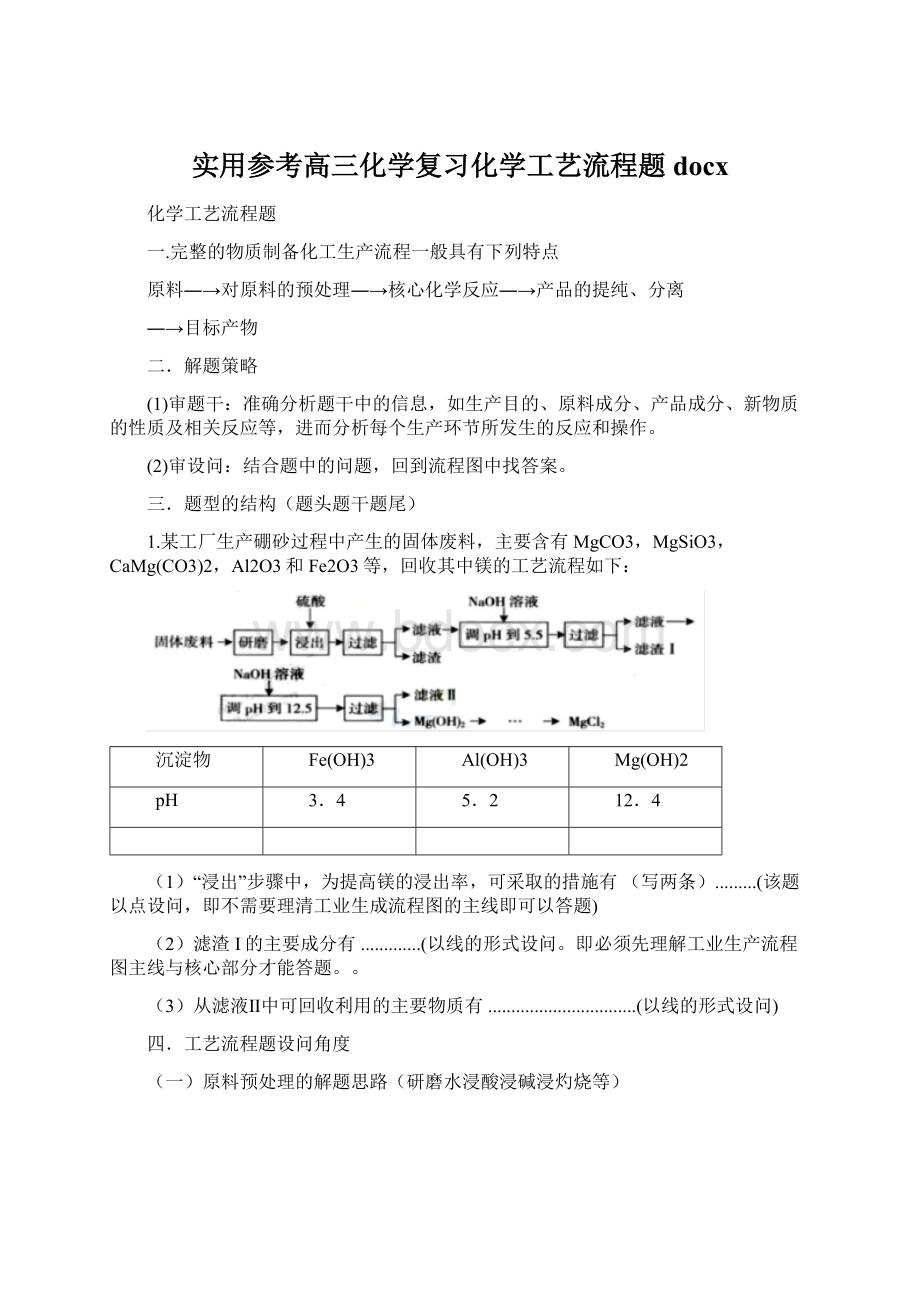
1.某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3,MgSiO3,CaMg(CO3)2,Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
沉淀物
Fe(OH)3
Al(OH)3
Mg(OH)2
pH
3.4
5.2
12.4
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有(写两条).........(该题以点设问,即不需要理清工业生成流程图的主线即可以答题)
(2)滤渣I的主要成分有.............(以线的形式设问。
即必须先理解工业生产流程图主线与核心部分才能答题。
。
(3)从滤液Ⅱ中可回收利用的主要物质有................................(以线的形式设问)
四.工艺流程题设问角度
(一)原料预处理的解题思路(研磨水浸酸浸碱浸灼烧等)
2.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域。
一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如下:
已知:
①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出):
成分含量/%
Y2O3
ZnO
Al2O3
PbO2
MgO
预处理前
24.28
41.82
7.81
1.67
0.19
预处理后
68.51
5.42
4.33
5.43
0.50
步骤I中进行原料预处理的目的为_____________。
原料预处理的常用方法总结
研磨粉碎:
增大反应物接触面积,加快反应速率。
水浸:
与水反应或溶解,使原料变成可溶性离子。
酸(碱)浸:
与酸(碱)接触反应或溶解,使可溶性金属离子进入溶液,不溶性物质过滤分离。
煅烧:
除去可燃性杂质或使原料初步转化
(二)常用的控制中心反应的条件(温度浓度压强催化剂pH等)
3.以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。
其主要流程如下:
应Ⅰ需控制反应温度低于35℃,其目的是________。
控制反应条件的方法总结
(1)调节溶液的pH。
能与H+反应,使溶液pH变大,便于沉淀某些金属离子。
(不引入新杂质)
(2)控制温度。
考虑因素:
反应速率;物质溶解度,热稳定性和挥发性;平衡移动方向
(3)控制压强。
改变速率,影响平衡移动方向。
(4)使用合适的催化剂。
加快反应速率,提高生产效率。
(3)核心反应——陌生方程式的书写
氧化还原反应:
熟练应用氧化还原规律①判断产物形式②配平
非氧化还原反应:
结合物质性质和反应酸碱环境判断产物形式
4.二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
②该法工艺原理示意图如右。
其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有H2、Cl2,生器中生成ClO2的化学方程式为______________________。
(四)产品的分离提纯(过滤、结晶、蒸馏、萃取分液)
(1)蒸发:
蒸发掉一部分溶剂。
有时要考虑反应时的气体氛围以抑制某物质发生水解。
(2)冷却结晶:
适用于杂质的溶解度随温度变化不大的物质的分离、提纯。
(3)蒸发结晶:
适用于杂质的溶解度随温度变化较大的物质的分离、提纯,可减少杂质晶体的析出。
(4)沉淀的洗涤:
由于沉淀生成时,表面会吸附一定量的离子(尤其是沉淀成分离子)。
因此过滤后要进行沉淀的洗涤。
洗涤方法是向过滤器中慢慢注入适量蒸馏水,至刚好没过沉淀,然后静置,让其自然流下,重复以上操作2~3次,直至洗涤干净。
为了减少沉淀(或晶体)的溶解,可用冰水或有机溶剂洗涤。
(5)沉淀是否洗涤干净的检验:
主要检验洗涤液中是否还含有沉淀表面吸附的离子。
一般的检验方法:
取少量最后一次的洗涤液,置于一洁净的试管中,滴加少量的检验试剂,若没有特征现象出现,说明沉淀洗涤干净。
(6)从溶液中得到晶体的过程:
蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
5.氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌(含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质)的流程如下:
提示:
在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是
(五)基本化工理念(环境意识效率意识成本意识)
产率高、速率快
产品纯度高
成本低、循环利用
无污染
6.循环利用的物质有
5.解题思路和技巧总结
1.解题时首先要粗读试题,尽量弄懂流程图。
2.要明确流程图中箭头方向和代表的含义。
流程图中箭头进入的是反应物(投料),箭头出去的是生成物(产物、副产物),返回的箭头一般是“循环利用”的物质
3.图中一般会出现超纲知识,要读懂流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用。
所以一定要关注题目的每一个字眼,但不必要将每一个物质都推出,问什么推什么。
4.其次要带着问题去精心研究某一步或某一个物质。
在答题时应注意前后问题往往没有联带效应,即前一问不能回答没关系,不影响后面回答问题。
5.遇到做不出来的问题要及时放弃,以免影响其他问题的作答。
最后,作答时一定要看清所提问题,不能答非所问,看清楚是写化学方程式还是离子方程式,注意配平,注意语言表达的科学性。
六.练习.
题型一 以分离、提纯为目的的工艺流程题
(20XX·高考新课标全国卷Ⅱ)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO
浸出液
滤液
滤液
滤饼
ZnO
提示:
在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是________,发生反应的离子方程式为________________________________________________________________________;
在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________________________________________________________________
________________________________________________________________________。
(2)反应③的反应类型为________,过滤得到的滤渣中,除了过量的锌外还有________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________________________________________________________________。
(4)反应④中产物的成分可能是ZnCO3·GZn(OH)2。
取干燥后的滤饼11.2g,煅烧后可得到产品8.1g。
则G等于________。
1.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),主要工艺流程如下。
(1)将过程②产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液B.紫色石蕊试液
C.酸性KMnO4溶液D.溴水
(2)过程①中,FeS、O2和H2SO4反应的化学方程式为
________________________________________________________________________。
(3)过程③中需加入的物质是________。
(4)过程④中,蒸发结晶时需使用的仪器除酒精灯、三脚架外,还需要________。
(5)过程⑤调节pH可选用下列试剂中的________(填序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80℃,目的是___________________________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。
①用分析天平称取2.7000g样品;②将样品溶于足量的盐酸后,加入过量的BaCl2溶液;③过滤、洗涤、干燥,称重得固体质量为3.4950g。
若该聚铁的主要成分为[Fe(OH)SO4]n,则该聚铁样品中铁元素的质量分数为________。
(假设杂质中不含铁元素和硫元素)
2.现代循环经济要求综合考虑环境污染和经济效益。
请填写下列空白。
(1)实验室里,可用于吸收SO2尾气的一种试剂是________________。
(2)高纯氧化铁可作现代电子工业材料。
以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁α�Fe2O3)的生产流程示意图:
①步骤Ⅰ中过滤所得滤渣的主要成分是________。
②步骤Ⅱ中加入铁粉的目的是_____________________。
③步骤Ⅲ中可选用________试剂调节溶液的pH(填标号)。
A.稀硝酸B.双氧水C.氨水D.高锰酸钾溶液
④写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式:
_________________________________________。
⑤从滤液C中回收的主要物质的一种用途是________。
题型二 以制备物质为目的的工艺流程题
(2015·高考山东卷)毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是__________________________。
实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3·H2O调pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。
加入H2C2O4时应避免过量,原因是_________________________。
Ca2+
Mg2+
Fe3+
开始沉淀时的pH
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.1
3.2
已知:
Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:
2CrO
+2H+===Cr2O
+H2O Ba2++CrO
===BaCrO4↓
步骤Ⅰ:
移取GmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL。
步骤Ⅱ:
移取ymLBaCl2溶液于锥形瓶中,加入GmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。
BaCl2溶液的浓度为________mol·L-1。
若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
3.(20XX·高考江苏卷)氧化镁在医药、建筑等行业应用广泛。
硫酸镁还原热解制备高纯氧化镁是一种新的探索。
以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为_____________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为__________________________________________________。
(3)滤渣2的成分是________________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C
2MgO+2SO2↑+CO2↑
MgSO4+C
MgO+SO2↑+CO↑
MgSO4+3C
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体是________________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液
c.稀硝酸d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
4.铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。
实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
请回答下列问题:
(1)固体a的化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为________________________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(3)以1000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84g·cm-3)________L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。
若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
例1[解析] 从分析整个流程图入手,明确每步发生的反应,从而解决相关问题。
(1)在反应②中,通过调节溶液的pH,高锰酸钾能将溶液中的Fe2+氧化为Fe3+,将Mn2+氧化为MnO2而除去;若开始溶液的pH过低,Fe2+、Mn2+将很难生成沉淀而除去。
(2)第一次过滤后的滤液中含有的阳离子有Zn2+、Ni2+、H+等,加入锌后可将Ni置换出来,故滤渣中还含有金属镍。
(3)反应④生成的沉淀为ZnCO3,同时生成Na2SO4,若沉淀未洗涤干净,洗涤液中应含有SO
和Na+,故只要对洗涤液中是否含有SO
进行检验即可。
(4)煅烧过程中ZnCO3、Zn(OH)2均发生分解反应生成ZnO,根据关系式ZnCO3·GZn(OH)2~(G+1)ZnO,可得
=
,故G=1。
[答案]
(1)Fe2+和Mn2+ MnO
+3Fe2++7H2O===3Fe(OH)3↓+MnO2↓+5H+,2MnO
+3Mn2++2H2O===5MnO2↓+4H+ 铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质
(2)置换反应 镍
(3)取少量水洗液于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净(4)1
1.解析:
SO2具有漂白性,能使品红溶液褪色,SO2有还原性,能被酸性KMnO4溶液、溴水氧化,而使它们褪色。
溶液G为Fe2(SO4)3,需加入还原剂将Fe3+还原为Fe2+,又不带入杂质离子,故需加入铁粉。
过程⑤中需将酸消耗而调高pH,而CaCO3跟硫酸反应会生成微溶于水的CaSO4而阻止反应的继续进行,故需选用NaOH溶液。
由聚铁的化学式可知:
n(Fe3+)=n(SO
)=n(BaSO4)=
=0.015mol,所以聚铁样品中铁元素的质量分数=
×100%=31.1%。
答案:
(1)ACD
(2)4FeS+3O2+6H2SO4===2Fe2(SO4)3+6H2O+4S (3)铁粉 (4)蒸发皿、玻璃棒 (5)C (6)促进Fe3+的水解 (7)31.1%
2解析:
(1)SO2为酸性气体,还具有较强的还原性,故可以通过用碱液吸收、强氧化剂溶液吸收等方法除去SO2。
(2)①硫铁矿烧渣中除SiO2外,均溶于盐酸,故滤渣是SiO2。
②Fe2O3、Fe3O4溶于盐酸均有Fe3+生成,加入铁粉可以将Fe3+还原为Fe2+:
2Fe3++Fe===3Fe2+。
③稀硝酸、双氧水、KMnO4溶液均容易将Fe2+氧化为Fe3+,只有氨水能够起到调节pH的作用。
④注意该过程中+2价的铁已转化为+3价的铁。
⑤滤液C为铵盐溶液,可作为氮肥使用。
答案:
(1)NaOH溶液(或其他合理答案)
(2)①SiO2 ②将Fe3+还原为Fe2+③C ④4FeCO3+O2
2Fe2O3+4CO2
⑤可作为氮肥
例2.[解析]
(1)毒重石用盐酸浸取前需充分研磨,目的是增大与盐酸的接触面积,加快反应速率。
实验室配制一定质量分数的溶液时,需用到的仪器是量筒、烧杯和玻璃棒。
(2)由流程图和表中数据可知,pH=8时,可除去Fe3+;调节pH=12.5时,Mg2+完全沉淀,Ca2+部分沉淀,故滤渣Ⅱ中含有Mg(OH)2和Ca(OH)2;加入H2C2O4的目的是除去溶液中剩余的Ca2+,使Ca2+(aq)+C2O
(aq)===CaC2O4(s),当H2C2O4过量时,也可能使c(Ba2+)·c(C2O
)>Ksp(BaC2O4),而生成BaC2O4沉淀,导致产品BaCl2·2H2O的量减少。
(3)由方程式2CrO
+2H+===Cr2O
+H2O知,步骤Ⅰ中加入的CrO
的总物质的量为bmol·L-1×
L=
mol。
步骤Ⅱ中,加入BaCl2充分反应后,剩余的CrO
的物质的量为bmol·L-1×
L=
mol,与Ba2+反应的CrO
的物质的量为
mol-
mol=
mol,由方程式Ba2++CrO
===BaCrO4↓得,n(Ba2+)=n(CrO
),所以BaCl2的浓度:
c(BaCl2)=
=
mol·L-1。
若步骤Ⅱ中滴加盐酸时,有少量待测液溅出,造成V1的用量减小,所以
的测量值将偏大。
[答案]
(1)增大接触面积从而使反应速率加快 ac
(2)Fe3+ Mg(OH)2、Ca(OH)2 H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少
(3)上方
偏大
3.解析:
明确实验过程,提取有效信息,正确判断反应过程。
(1)MgCO3与稀硫酸反应时,MgCO3微溶于水,在写离子方程式时要写化学式。
离子方程式为MgCO3+2H+===Mg2++CO2↑+H2O。
(2)因为菱镁矿中有FeCO3,在酸溶时产生Fe2+,除去Fe元素需将Fe2+氧化为Fe3+,通过调节溶液的pH生成Fe(OH)3从而除去Fe3+,所以加入H2O2的目的是将Fe2+氧化成Fe3+,发生反应的化学方程式为2FeSO4+H2O2+H2SO4===Fe2(SO4)3+2H2O。
(3)调pH≈4时发生的反应为Fe3++3NH3·H2O===Fe(OH)3↓+3NH
,所以经过滤所得滤渣2为Fe(OH)3。
(4)由题给反应可知,煅烧后的气体为CO2、SO2、CO和S蒸气的混合物。
S蒸气很容易转化为S固体,所以A的目的是收集S,B的作用是吸收SO2,可用KMnO4溶液将SO2氧化吸收,C中装NaOH溶液,作用是吸收产生的CO2,CO最后用排水法收集。
S与热的NaOH反应的离子方程式为3S+6OH-
2S2-+SO
+3H2O。
答案:
(1)MgCO3+2H+===Mg2++CO2↑+H2O
(2)2FeSO4+H2O2+H2SO4===Fe2(SO4)3+2H2O
(3)Fe(OH)3(4)①CO ②d ③3S+6OH-
2S2-+SO
+3H2O
4.解析:
(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2。
Al2O3溶于烧碱生成NaAlO2溶液,在其中通入CO2生成Al(OH)3沉淀。
(2)Al(OH)3分解生成Al2O3,Al2O3与稀硫酸反应后通入NH3生成铵明矾溶液。
(3)m(Al2O3)=1000kg×36%=360kg,m(H2SO4)=
kg=1037.6kg,需消耗质量分数98%的硫酸(密度1.84g·cm-3)为
=575.4×103mL=575.4L。
(4)设制得的Al2(SO4)3和NH4Al(SO4)2·12H2O的物质的量都是1mol,则Al3+共3mol,SO
共5mol,根据铝元素和SO
守恒原理可得,加入Al2O3和H2SO4的物质的量之比为
∶5=3∶10。
答案:
(1)SiO2 AlO
+CO2+2H2O===HCO
+Al(OH)3↓
(2)Al2O3+4H2SO4+2NH3===2NH4Al(SO4)2+3H2O 蒸发浓缩(3)575.4 (4)3∶10