金属钠铝铁实验探究题解析.docx
《金属钠铝铁实验探究题解析.docx》由会员分享,可在线阅读,更多相关《金属钠铝铁实验探究题解析.docx(25页珍藏版)》请在冰豆网上搜索。
金属钠铝铁实验探究题解析
有关金属钠、铝、铁的实验题
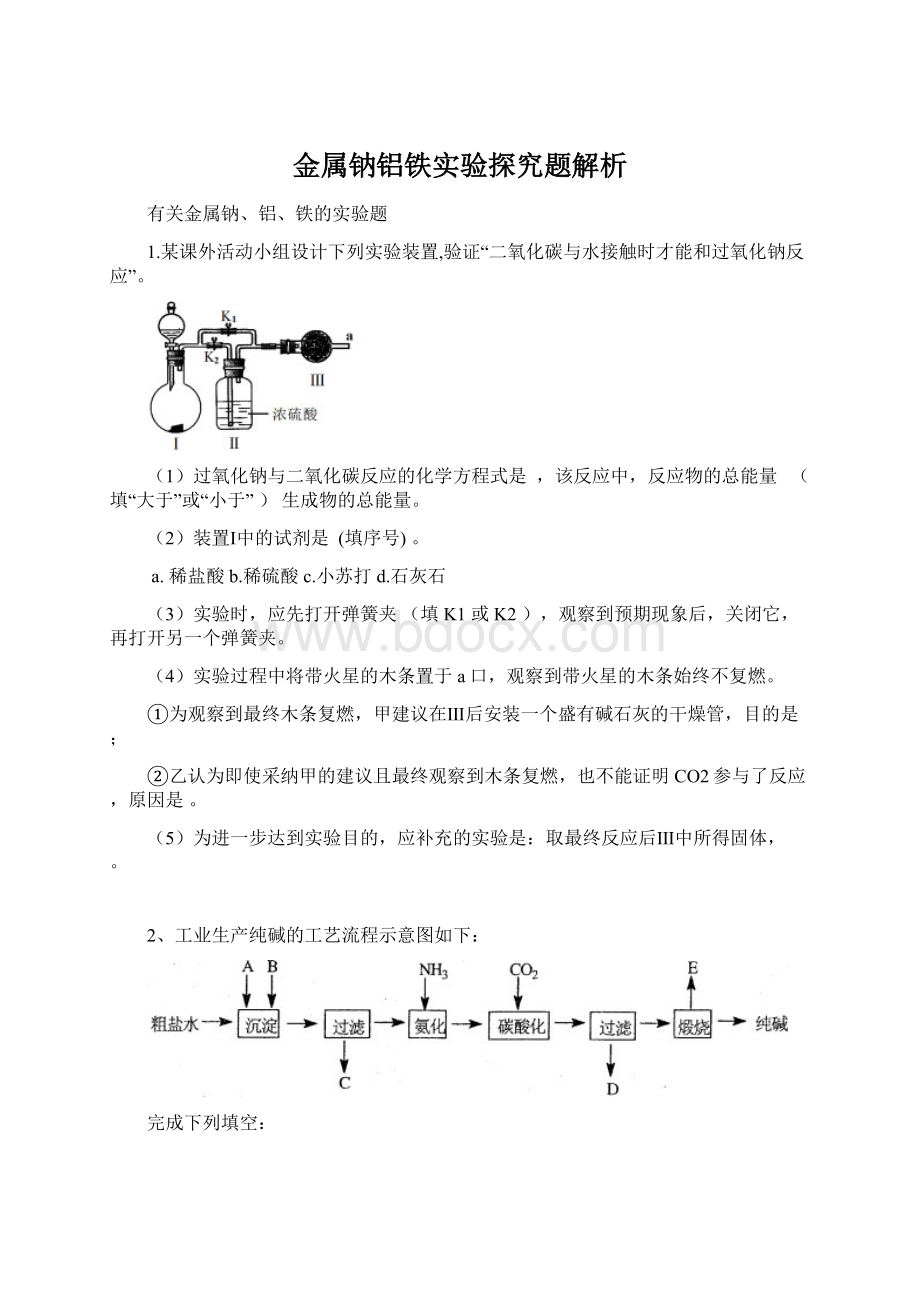
1.某课外活动小组设计下列实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
(1)过氧化钠与二氧化碳反应的化学方程式是,该反应中,反应物的总能量(填“大于”或“小于”)生成物的总能量。
(2)装置Ⅰ中的试剂是(填序号)。
a.稀盐酸b.稀硫酸c.小苏打d.石灰石
(3)实验时,应先打开弹簧夹(填K1或K2),观察到预期现象后,关闭它,再打开另一个弹簧夹。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是。
(5)为进一步达到实验目的,应补充的实验是:
取最终反应后Ⅲ中所得固体,。
2、工业生产纯碱的工艺流程示意图如下:
完成下列填空:
1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
AB
2)实验室提纯粗盐的实验操作依次为:
取样、、沉淀、、、冷却结晶、、烘干。
3)工业生产纯碱工艺流程中,碳酸化时产生的现象是。
碳酸化时没有析出碳酸钠晶体,其原因是。
4)碳酸化后过滤,滤液D最主要的成分是(填写化学式),检验这一成分的阴离子的具体方法是:
。
5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。
加石灰水后所发生的反应的离子方程式为:
滤液D加石灰水前先要加热,原因是。
6)产品纯碱中含有碳酸氢钠。
如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(注明你的表达式中所用的有关符号的含义)
3.工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。
其部分工艺流程如下:
已知:
①Li2O·Al2O3·4SiO2+H2SO4(浓)Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
T/℃
20
40
60
80
S(Li2CO3)/g
1.33
1.17
1.01
0.85
S(Li2SO4)/g
34.2
32.8
31.9
30.7
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。
则步骤Ⅱ中反应的离子方程式是。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)
。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是。
②b中,生成Li2CO3反应的化学方程式是。
1.(共14分)
(1)2Na2O2+2CO2=2Na2CO3+O2大于
(2)bc(3)K2
(4)①除去未充分反应的CO2②水与Na2O2反应生成氧气
(5)加入稀盐酸,将产生的气体通入澄清石灰水(合理答案均给分)
2、1)Ca(OH)2或CaO;Na2CO3;2)溶解;过滤;蒸发;过滤;3)有晶体析出(或出现浑浊);碳酸钠溶解度比碳酸氢钠大;4)NH4Cl;取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子;5)NH4++OH-→NH3↑+H2O;防止加石灰水时产生碳酸钙沉淀;6)
。
3.
(1)Al3++3NH3·H2O===Al(OH)3↓+3NH4+
(2)Ca(OH)2(s)
Ca2++2OH-
(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)①2Cl――2e―===Cl2↑
②2LiOH+NH4HCO3===Li2CO3+NH3+2H2O
4.(16分)氯化铁是实验室中的重要试剂。
某同学用mg含有铁锈(Fe2O3)的废铁屑来制取FeCl3·6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):
操作步骤如下:
Ⅰ.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1、打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3·6H2O晶体。
请回答:
(1)A中发生的置换反应的化学方程式是。
(2)操作Ⅱ中“……”的内容是,烧杯中的现象是,相应的离子方程式和化学方程式是、。
(3)操作Ⅲ不采用直接加热制FeCl3·6H2O晶体的原因是(用简要文字并结合离子方程式解释)。
(4)测得B中所得的气体是VmL(标准状况时),由此计算出该废铁屑中铁的质量分数是,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是。
(5)为了准确测定铁的质量分数,还可以另取mg废铁屑和某种常见的还原剂气体在加热时充分反应到恒重,测得实验后剩余固体质量是wg。
由此求出铁的准确质量分数是(用含m、和w的式子表示)。
5.(12分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。
某课外小组测定该补血剂中铁元素的含量。
实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是。
(2)步骤②加入过量H2O2的目的:
。
(3)步骤③中反应的离子方程式:
。
(4)步骤④中一系列处理的操作步骤:
过滤、、灼烧、、称量。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
1实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除药匙、天平(附砝码)、玻棒、烧杯、胶头滴管外,还需。
②滴定到终点时的颜色为色。
(6)正常人每天应补充14mg左右的铁。
其中绝大部分来自于食物。
如果全部通过服用含FeSO4·7H2O的片剂。
来补充铁,则正常人每天服需用含mgFeSO4·7H2O片剂。
6.(10分)某硫酸铁样品含有少量硫酸亚铁杂质。
现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I中除了烧杯、玻璃棒外还要用到的玻璃仪器是,
(2)操作II用到的仪器是。
A.碱式滴定管B.50mL量筒 C.10mL量筒D.25mL移液管
(3)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是(列出原始算式,不需化简)。
(4)某同学认为可以从操作Ⅱ后获得的250.00mL溶液开始,设计定量实验测定硫酸亚铁的含量,请你分析该同学的实验设计。
a取待测溶液25.00mL置于锥形瓶中;
b取某浓度的高锰酸钾酸性溶液装到酸式滴定管中,并调整好液面记录读数;
c滴定并记录读数;
d根据数据进行计算
①甲同学认为a、b间少了滴入指示剂的环节,请判断有无必要并说明理由。
。
②乙同学认为c、d间少了一个环节,请判断是何环节,并说明理由。
。
7.(12分)全世界每年被腐蚀损耗的钢铁约占全年钢铁产量的1/10,而在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
▲。
(2)已知草酸(H2C2O4)分解的化学方程式为:
H2C2O4
CO↑+CO2↑+H2O,下列装置中,可用作草酸分解制取气体的是▲。
(填字母)
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
①为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是▲、
▲。
②在点燃酒精灯之前应进行的操作是:
(a)检查装置气密性;(b)▲。
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=▲。
④在本实验中,下列情况会使测定结果n偏大的是▲。
(填字母)
a.缺少洗气瓶Bb.缺少装置Ec.反应后固体是铁和少量Fe2O3·nH2O
5.(12分)[(4)(5)两题每空1分,其余每空2分]
(1)取少量滤液先滴加KSCN溶液,再滴加氯水(或双氧水、稀硝酸等合理氧化剂),溶液由浅绿色变为血红色,证明有溶液中有Fe2+
(2)将Fe2+全部氧化为Fe3+(3)Fe3++3NH3·H2O→Fe(OH)3+3NH4+(4)洗涤冷却
(5)①250mL容量瓶(不写体积不给分)②紫(或紫红)(6)69.5mg
6.每空2分
(1)250mL容量瓶、胶头滴管。
(2)D。
(3)1120(W1-W2)/160a。
(4)①无必要,高锰酸钾溶液本身可起到指示剂的作用(有颜色)。
②重复操作2次(几次),使实验获得的数据可以采信(并可提高精确度)。
7.共12分。
(1)2Fe+O2+2H2O=2Fe(OH)2(2分)
(2)d(2分)
(3)①浓NaOH溶液(1分)浓硫酸(1分)
②通入混合气体一段时间(2分)③2(2分)④a(2分)
8.(12分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是
(用离子方程式表示)。
为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的 .。
a..NH3b.CO2c.NaOHd.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为____。
取少量废电解液,加入NaHCO,溶液后产生气泡和白色沉淀,产生沉淀的原因是_____。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______。
(3)利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
海水
K
M
N
铁
X
加HNO3
大理石
过滤
滤液A
用氨水调节pH至8~9
过滤
滤渣B
滤液B
加(NH4)2CO3
过滤
纯CaCO3
滤液C
CaO2
加盐酸
操作①
CaCl2·2H2O晶体
260℃
干燥脱水
无水CaCl2
浓H2O2溶液
操作②
9.(15分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。
下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
^
请回答下列问题:
(1)操作①应包括下列操作中的 (填序号)。
A.溶解B.过滤C.蒸馏D.分液E.蒸发结晶
(2)用氨水调节pH至8~9的目的是 。
(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+(填“是”或“否”)沉淀完全。
[已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)^
(5)操作②是:
在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。
;用简要的文字解释需用氢氧化钠调节pH至9~11的原因 。
^
(6)已知大理石含CaCO3的质量分数为a,mg大理石可以制得ngCaO2,请计算:
CaCO3转化为CaO2过程中,Ca原子的利用率为 。
^
10某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质。
过程如下:
【提出问题】
①在周期表中,Cu、Al位置接近。
Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
⑴解决问题①需用到的药品有CuSO4溶液、(填试剂),同时进行相关实验。
⑵解决问题②的实验步骤和现象如下:
取98gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。
冷却后称量,A的质量为72g,A的化学式为。
向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
⑶为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
实验中观察到CuO变为红色物质。
查资料可知,同时生成一种无污染的气体。
该气体的化学式为。
【实验结论】
⑴Cu(OH)2具有两性。
证明Cu(OH)2具有两性的实验现象是
。
⑵根据实验方案⑵,得出的+1价Cu和+2价Cu稳定性大小的结论是高温时;在酸性溶液中。
⑶CuO能够被NH3还原。
【问题讨论】
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。
请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
11.电镀含铬废水的处理方法较多。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。
为回收利用,通常采用如下流程处理:
已知:
(1)Cr(OH)3NaCrO2Na2CrO4Na2Cr2O7
(2)Cu(OH)2能溶于氨水:
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:
(1)操作I的名称,上述操作I、II、III相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有________________。
(2)滤渣I的主要成分为________________(写化学式),试剂乙的名称________。
(3)加入试剂甲的目的________________。
(4)废水处理流程中生成滤渣III的离子方程式:
________。
II.酸性条件下,六价铬主要以Cr2O72-形式存在。
工业上用以下方法处理处理含Cr2O72-的废水:
①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。
(5)电解时能否用Cu电极来代替Fe电极?
______________(填“能”或“不能”),理由是
。
(6)已知某含Cr2O72-的酸性工业废水中铬元素的含量为104.5mg/L,处理后铬元素最高允许排放浓度为0.5mg/L。
处理该废水1000m3并达到排放标准,至少消耗铁的质量为kg。
8
(1)①2Al+2OH―+6H2O=2[Al(OH)4]―+3H2(或2Al+2OH―+2H2O=2AlO2―+3H2)
②2Al+3H2O=Al2O3+6H++6e-
HCO3_与H+反应使H+溶度减小,产生Al(OH)3沉淀(合理即得分)
(2)补充溶液中消耗的Cu2+,保持溶液中Cu2+溶度恒定
(3)N:
牺牲阳极的阴极保护法(或牺牲阳极保护法)
9\答案:
(15分)
(1)A、B、E
(2)除去Fe3+(3)是(4)<
(5)CaCl2+H2O2
CaO2+2HCl(或CaCl2+H2O2+2NaOH=CaO2↓+2NaCl+2H2O)
加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成。
(6)25n/18am
10.答案:
(16分)
【实验方案】⑴H2SO4(HCl)溶液、浓NaOH溶液………………………………2分
⑵Cu2O……………………………………………………………………………………2分
(3)N2……………………………………………………………………………………2分
【实验结论】
⑴Cu(OH)2既能溶于盐酸,又能溶于浓NaOH溶液……………………………………2分
⑵+1价Cu比+2价Cu稳定……………………………………………2分
+2价Cu比+1价Cu稳定……………………………………………2分
【问题讨论】
取NH3与CuO反应后生成的红色物质少许,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有A,反之则无………………………………………………………………4分
11.(12分)
(1)过滤(1分)玻璃棒(1分)
(2)Cu(OH)2、Fe(OH)3(2分)氨水(1分)
(3)将Fe2+氧化成Fe3+(1分)(4)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(2分)
(5)不能(1分)
因阳极产生的Cu2+不能使Cr2O72-还原到低价态(1分,答案合理即给分)
(6)336(2分)
61.(8分)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。
(1)若A为氯碱工业的产品,C为厨房中的用品。
①D的电子式是。
②反应Ⅲ的离子方程式是。
③氯碱工业制备A的化学方程式是,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1molKI转移电子0.6mol,则三种物质间反应的离子方程式是。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是。
②B可作净水剂,其原理是(用离子方程式表示)。
在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是。
62.(8分)铁是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是。
(2)某实验小组利用右图装置验证铁与水蒸气的反应。
①湿棉花的作用是,试管中反应的化学方程式是。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是_____(填序号)。
a.一定有Fe2+、H+和Fe3+b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有H+d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入适量的浓硫酸中,加热,充分反应后收集气体。
经测定气体中含有SO2、CO2和H2。
①铁与浓硫酸反应的化学方程式是。
②气体中混有CO2的原因是(用化学方程式表示)。
③将672mL(标准状况)收集到的气体通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66g。
由此推知收集到的气体中SO2的体积分数是。
63.(8分)有关FeSO4的转化关系如下图所示(无关物质已略去)。
已知:
①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,
产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式)。
(2)反应I的反应类型属于(填序号)。
a.分解反应b.复分解反应c.置换反应d.化合反应e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是。
(4)若经反应I得到16g固体Y,产生的气体X恰好被0.4L1mol/LNaOH溶液完全吸收,则反应IV中生成FeSO4的离子方程式是。
64.(14分)某酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。
实验室用下图模拟工艺流程,利用常用的酸、碱和废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
过量甲
过程Ⅰ
工业废水
A
B
稀硫酸
过程Ⅱ
C
金
乙溶液
过程Ⅲ
E
F
G
丙溶液
过程Ⅳ
氢氧化钠溶液
搅拌
D
铁红
(1)甲的化学式是 ,乙的化学式是 ,G的化学式是 。
(2)过程Ⅰ中共发生了个化学反应,写出其中不属于置换反应的离子方程式 。
(3)过程Ⅰ、Ⅱ、Ⅲ、Ⅳ中均进行的实验操作的名称是。
(4)过程Ⅱ中加入稀硫酸的目的是。
(5)由A生成D的实验现象是。
(6)由D生产铁红的化学方程式是。
67.(15分)Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。
【实验步骤】
I.按下图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。
石灰水
ABC
II.将0.6g炭粉与3.9gNa2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成)。
III.用酒精灯微微加热试管底部。
【实验现象】
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
请回答:
(1)在图中方框内绘出仪器装置简图,使仪器装置图完整。
△
(2)装置B的作用是。
(3)通过探究发现,装置A中发生的反应为2Na2O2+C===Na2CO3+X,X的电子式
是。
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种新物质。
已知反应过程中转移6.02×1023个电子时,生成53gPd,该反应的化学方程式为。
(5)将装置A中充分反应后所得产物溶于适量水中。
①所得溶液的溶质是(填化学式)。
②溶液中下列关系正确的是(填字母序号)。
a.c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c.c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
d.c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-)
③若使所得溶液与100mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的
量浓度为
。
72.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。
硫酸亚铁铵在500℃时隔绝