配位化学-配合物异构现象_精品文档.ppt
《配位化学-配合物异构现象_精品文档.ppt》由会员分享,可在线阅读,更多相关《配位化学-配合物异构现象_精品文档.ppt(21页珍藏版)》请在冰豆网上搜索。
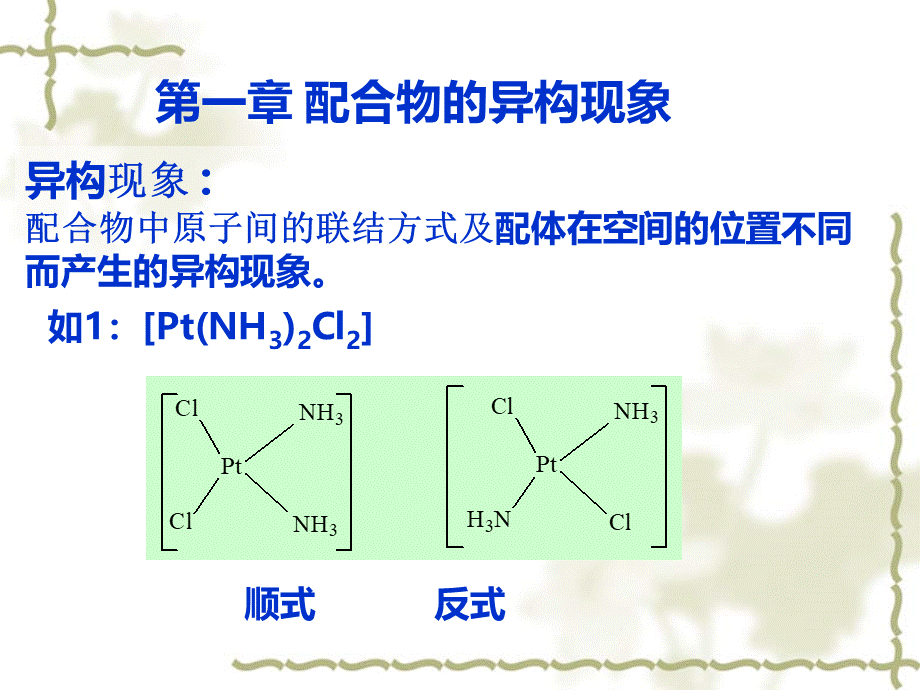
异构现象:
配合物中原子间的联结方式及配体在空间的位置不同而产生的异构现象。
第一章配合物的异构现象,顺式反式,如1:
Pt(NH3)2Cl2,如2:
Pt(NH3)(py)ClBr,平面正方形配合物,顺式(绿色)反式(紫色),1.2配合物的异构现象,配合物的异构现象是指分子式(实验式)相同而原子间的联结方式或空间排列方式不同而引起结构和性质不同的现象。
一般可分为构造异构和立体异构。
构造异构:
化学式相同,成键原子连接方式不同(原子排列次序不同)的异构体。
立体异构:
化学式和原子排列次序都相同,仅原子在空间的排列不同的异构体。
1.2配合物的异构现象,构造异构:
水合异构、电离异构配位异构、聚合异构键合异构立体异构:
非对眏异构对眏异构几何异构多形异构,配合物的异构现象不仅影响其物理和化学性质,而且与配合物的稳定性和键性质也有密切关系。
其中最重要的是几何异构现象和光学异构现象。
一、构造异构:
1.水合异构体凡是化学组成相同,但水分子在分子的内界和外界分布不同的配合物。
见14页表1-1Co(NH3)4Cl2ClH2O和Co(NH3)4(OH2)ClCl2;Co(NH3)5(NO3)(NO3)2H2O和Co(NH3)5(OH2)(NO3)3Cr(Py)2(OH2)Cl3H2O和Cr(Py)2(OH2)2Cl2Cl等。
如:
Cr(H2O)6Cl3(紫色)Cr(H2O)5ClCl2H2O(绿色)Cr(H2O)4Cl22H2O(绿色)。
水合异构体的物化性质和热稳定性都有很大的差别。
如:
构造异构:
2、电离异构由于阴离子处于内界或外界之间进行交换而引起的异构现象。
溶液中加入BaCl2生成白色沉淀,室温下与AgNO3无反应。
溶液中室温下加入BaCl2无反应,但加入AgNO3有大量的沉淀产生。
同样,反式-CoCl2(en)2NO2(绿色)与反式-CoCl(NO2)(en)2Cl(红色)也互为电离异构体。
构造异构:
3、配合异构由于配体在配阳离子和配阴离子之间分配不同而引起的异构。
金属离子不同。
如:
Cu(NH3)4PtCl4紫色和Pt(NH3)4CuCl4绿色Co(NH3)6Cr(CN)6和Cr(NH3)6Co(CN)6;金属离子相同,但配体不同。
Co(NH3)4(NO2)2Co(NH3)2(NO2)4和Co(NH3)6Co(NO2)6,氧化态不同的同一金属离子与不同配位体配合。
Pt(NH3)4PtCl6和Pt(NH3)4Cl2PtCl4,配位异构:
这种异构仅存在于由配阳离子和配阴离子所组成的盐中,它们之间差别在于配阳离子和配阴离子中配位体分布情况不同。
构造异构:
4、聚合异构配合物的聚合异构现象与一般化合物的聚合现象不同,它不是简单分子的聚合,而是由配位体的不同排列所形成的配位异构体。
同系列的聚合异构体中,各个配合物的分子量正好为该系列中最简式的整数倍。
Co(NH3)6Co(NO2)6黄色Co(NH3)6Co(NH3)2(NO2)4黄橙色Co(NH3)4(NO2)2Co(NH3)2(NO2)4黄棕色,4.聚合异构聚合异构并非真正的异构体,它们具有相同的最简式,习惯上称它们为聚合异构。
如:
Co(NH3)3(NO2)3n=1Co(NH3)6Co(NO2)6n=2Co(NH3)4(NO2)2Co(NH3)2(NO2)4n=2Co(NH3)5(NO2)Co(NH3)2(NO2)42n=3Co(NH3)4(NO2)23Co(NO2)6n=4Co(NH3)5(NO2)3Co(NO2)62n=5,构造异构:
5、键合异构同一种多原子配体与金属离子配位时,由于键合原子的不同而造成的异构现象称为键合构体。
如:
NO2-作为配体时可用O原子配位亚硝酸根配合物。
可用N原子配位硝基配合物。
Cr(H2O)5SCN2和Cr(H2O)5NCS2,如Co(NH3)5NO22+黄色,Co(NH3)5(ONO)2+红色硝基五氨合钴()离子亚硝酸根五氨合钴()离子,二、立体异构实验式相同,成键原子的联结方式也相同,但空间排列不同。
最常见是顺反异构现象,主要是配位数为4的平面正方形和配位数为8的八面体中。
一般可分为非对映异构和对映异构两类,非对映异构和对映异构,非对应异构构造式相同,构型不同,但不是实物与镜象关系的化合物互称非对应体。
多形异构:
分子式相同,立体结构不同的异构体。
如Ni(P)2Cl2存在以下两种异构体(P代表二苯基苄基膦),红色、反磁性,蓝绿色、顺磁性,顺反异构配合物中,配体可占据中心原子周围的不同位置。
如配体处于相邻的位置叫顺式结构,如配体处于相对的位置叫反式结构,分子的构造相同,由配体所处的顺反位不同而产生的异构现象称为顺反异构现象。
最典型的代表是PtCl2(NH3)2,其有两种几何异构体分别为顺式和反式。
如图,顺式,抗癌活性,反式,无抗癌活性,旋光异构现象(opticalisomerism),旋光活性:
手性分子对偏振光有作用,能使偏振光向某一方向旋转某一角度,而且组成相同的一对对映体使偏振光向不同的方向旋转,一个对映体使偏振光旋转的性质称为旋光活性或光学活性。
旋光性,当光通过含有某物质的溶液时,使经过此物质的偏振光平面发生旋转的现象。
可通过存在镜像形式的物质显示出来,这是由于物质内存在不对称碳原子或整个分子不对称的结果。
由于这种不对称性,物质对偏振光平面有不同的折射率,因此表现出向左或向右的旋光性。
利用旋光性可以对物质(如某些糖类)进行定性或定量分析。
旋光异构体(对映异构体):
CHClBrI,有对称面或对称中心的分子不存在旋光异构体。