届高考化学第一轮复习讲练测试题.docx
《届高考化学第一轮复习讲练测试题.docx》由会员分享,可在线阅读,更多相关《届高考化学第一轮复习讲练测试题.docx(8页珍藏版)》请在冰豆网上搜索。
届高考化学第一轮复习讲练测试题
高考化学题型专项复习:
工艺流程题型
专题训练五
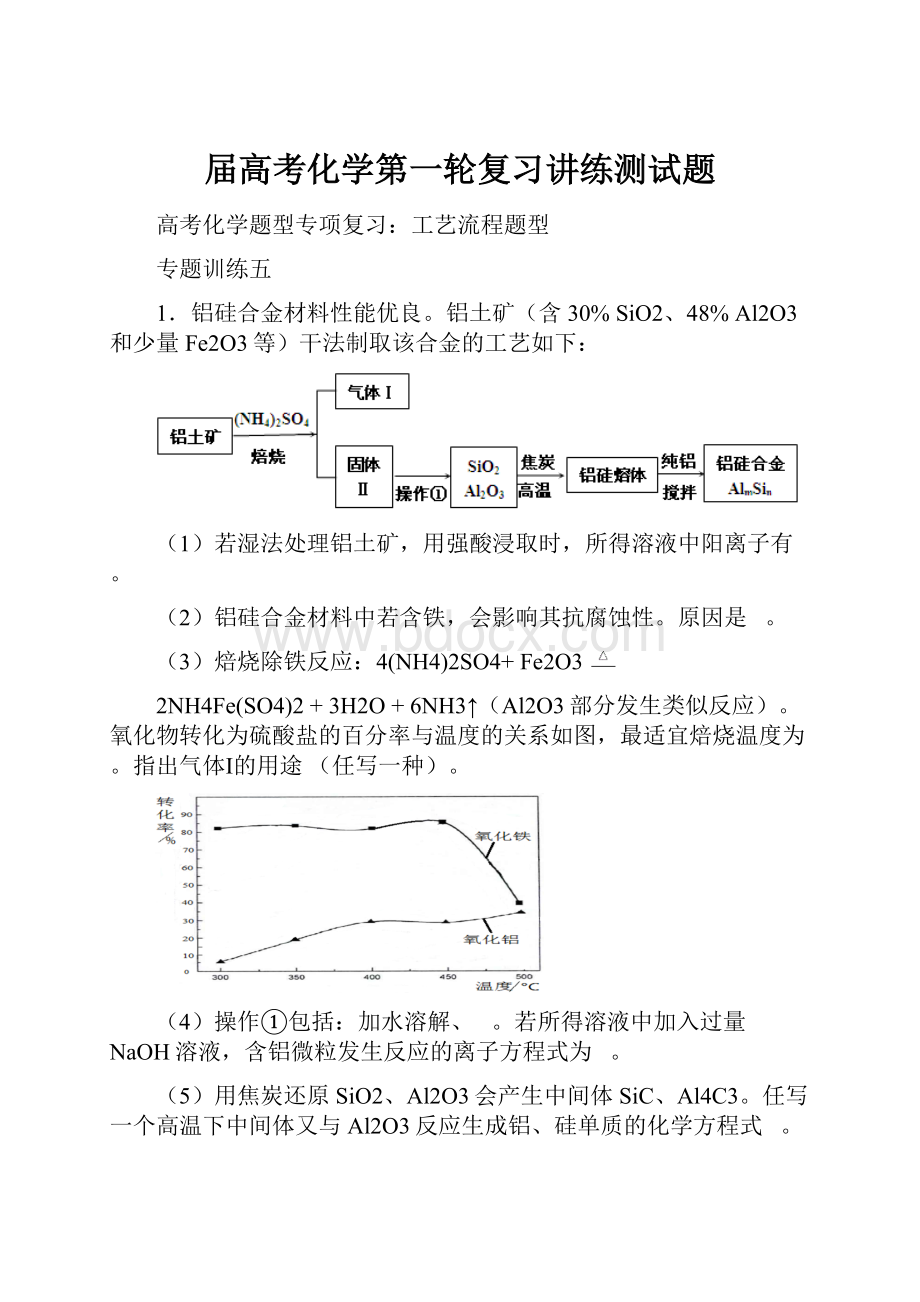
1.铝硅合金材料性能优良。
铝土矿(含30%SiO2、48%Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有。
(2)铝硅合金材料中若含铁,会影响其抗腐蚀性。
原因是。
(3)焙烧除铁反应:
4(NH4)2SO4+Fe2O3
2NH4Fe(SO4)2+3H2O+6NH3↑(Al2O3部分发生类似反应)。
氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为。
指出气体Ⅰ的用途(任写一种)。
(4)操作①包括:
加水溶解、。
若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为。
(5)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。
任写一个高温下中间体又与Al2O3反应生成铝、硅单质的化学方程式。
(6)不计损失,投入1t铝土矿,当加入27kg纯铝后,铝硅合金中m:
n=(摩尔质量:
SiO2---60g/molAl2O3---102g/mol)。
2.以天然气为原料合成氨是当下主流合成氨方式,其过程简示如下:
(1)甲烷脱硫的主要目的是。
(2)甲烷一次转化发生反应:
CH4(g)+H2O(g)
CO(g)+3H2(g)
。
在20L的密闭容器中充入CH4(g)、H2O(g)各1mol,CH4的平衡转化率与温度、压强的关系如图。
压强P1(选填>、<、=)P2;若3min后在150℃、压强为P2时达到平衡,平均反应速率v(H2)=。
(3)传统的化学脱碳法是用热碳酸钾溶液洗气,用什么方法可以使洗气后的碳酸钾溶液再生以循环使用?
。
铜洗能较彻底脱碳脱硫。
醋酸亚铜溶于过量氨水形成的铜洗液,可吸收H2S、O2、CO、CO2等,该铜洗液吸收CO2的化学方程式:
。
(4)n(N2):
n(H2)=1:
3原料气进入合成塔,控制反应条件之外采取什么措施提高原料气利用率?
。
(5)NaCl、NaBr、NaI混合溶液中滴入AgNO3溶液至c(Ag+)=07mol·L-1,溶液中浓度比
c(Cl-):
c(Br-):
c(I-)=:
:
1。
AgCl
AgBr
AgI
Ksp
2×10-10
5×10-13
1×10-16
3.工业制硫酸生产流程如下图:
(1)实验室常用过量的氢氧化钠溶液吸收SO2尾气,该反应的离子方程式为。
(2)已知SO2和O2生成SO3的反应过程放热。
在催化反应室中,下列措施有利于提高SO2平衡转化率的有。
(填写编号)
A.减少压强B.升高温度C.不断补充空气D.及时分离出SO3
(3)在工业制硫酸生产中,为提高催化剂效率采取的措施有(答出2点)。
(4)在450℃、常压和钒催化条件下,在容积为2L的恒容容器中加入2molSO2和1molO2。
①下列选项中不能作为判断该反应是否达平衡状态的标志的是。
(填写编号)
A.混合气密度不变化B.SO2百分含量保持不变C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等E.气体总物质的量不变
②达平衡后,测得平衡常数为K,若此时O2的转化率为x,则K和x的关系满足K=。
(5)SO2和O2的反应在恒容密闭容器中发生,图1、2表示在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况,根据图1、图2相关信息,判断t2发生改变的条件是。
4.(14分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜。
碱洗时常有气泡冒出,该气体的名称为。
②为将碱洗槽液中的铝元素以沉淀形式回收,最好向槽液中加入下列试剂中的。
A.NH3B.CO2C.NaOHD.HNO3
③以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是。
(3)下列关于金属腐蚀的事实中,与电化学腐蚀有关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.为保护海轮的船壳,常在船壳上镶入锌块
C.在空气中,金属银的表面生成一层黑色物质
D.镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
(4)利用下图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁的腐蚀,开关K应置于处。
②若X为锌,开关K应置于处。
5.(16分)铁及其化合物在日常生活、生产中应用广泛。
(1)某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:
c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为________(填字母)。
A.2B.3C.4D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
①酸溶过程中Fe2O3发生反应的离子方程式为_______;
“滤渣A”主要成分的化学式为_______________。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:
FeS2+____Fe3++______===______Fe2++____SO42-+______
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为__________________。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8。
沉淀物
Fe(OH)3
Al(OH)3
Fe(OH)2
Mg(OH)2
开始沉淀pH
2.7
3.8
7.6
9.4
完全沉淀pH
3.2
5.2
9.7
12.4
如果pH过大,可能引起的后果是____________________(几种离子沉淀的pH见上表)。
⑤滤液B可以回收的物质有________(填序号)。
A.Na2SO4B.Al2(SO4)3C.Na2SiO3D.MgSO4
6.(15分)N是重要的非金属元素,尿素、羟胺、硝酸、亚硝酸钠均为重要的含氮化合物。
(1)尿素[CO(NH2)2]是人类利用无机物合成的第一种有机物。
①尿素中元素原子半径最大的原子结构示意图为;
②尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因;
③已知:
20oC时,H2CO3:
Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3·H2O:
Kb=1.7×10ˉ5,碳酸氢铵溶液中HCO3ˉ、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为
(2)羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂。
①利用羟胺的还原性,可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式;
②制备NH2OH·HCl(盐酸羟胺)的一种工艺流程如下图所示:
ⅰ步骤中,发生反应的化学方程式为;
ⅱ步骤中使用的NaNO2外观酷似食盐,误食会中毒。
可用电解法将工业废水中少量的NO2ˉ转化为N2以降低其危害。
写出NO2ˉ在酸性条件下转化为氮气的电极反应式为________。
ⅲ步骤中,X为(填化学式);若要使滤液Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,溶液中Ba2+浓度应不小于[已知KSP(BaSO3)=5.0×10ˉ10;KSP(BaSO4)=1.1×10ˉ10]
③用惰性电极电解硝酸溶液可制备NH2OH。
写出其阳极反应式;
1.
(1)Al3+、Fe3+、H+(2分)
(2)铁与铝形成原电池,加快了铝的腐蚀(2分)
(3)300℃(2分)氮肥、用硫酸吸收气体(氨气)循环到焙烧过程中等(2分)
(4)过滤(2分)Al3++4OH-=AlO2-+2H2O或Al3++4OH-=Al(OH)4-(2分)
(5)Al4C3+Al2O3
6Al+3CO↑或者3SiC+Al2O3
3Si+2Al+3CO↑(2分)
(6)9∶5(2分)
2.
(1)避免合成氨使用的催化剂中毒
(2)>;03mol·L-1·min-1
(3)加热使KHCO3分解成K2CO3.2NH3·H2O+CO2=(NH4)2CO3+2H2O
(4)循环使用分离氨气后剩余的氮气、氢气。
(5)2×1065×103
3.(15分)
(1)SO2+2OH-=SO32-+H2O(2分)
(2)CD(2分)
(3)①净化气体②控制温度在400~500℃③增大催化剂与反应气体的接触面积
(写出2点即可,每答对1点给1分,共2分。
)
(4)AD(2分)2x2/(1-x)3(3分)
(5)降低温度(4分)
4.(共14分,每空2分)
(1)①氢气②b③2Al+3H2O-6e-==Al2O3+6H+
(2)补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定(或阳极Cu可以发生氧化反应生成Cu2+)
(3)ABD(共2分,漏选1分,错选不给分)(4)①N;②M
5.
(1)B(2分)
(2)①Fe2O3+6H+===2Fe3++3H2OSiO2(3分)②FeS2+14Fe3++8H2O===15Fe2++2SO42-+16H+(3分)③(3分)4Fe2++O2+2H2O+8OH-===4Fe(OH)3↓[或Fe2++2OH-===Fe(OH)2↓、4Fe(OH)2+O2+2H2O===4Fe(OH)3]。
④(2分)Al3+、Mg2+形成沉淀,使制得的铁红不纯(3分)ABD
6.
(1)①
(1分);②NH4++OH-=NH3·H2O(或NH4++OH-=NH3↑+H2O)(2分);③c(NH4+)>c(HCO3-)>c(OH-)>c(H+)(2分);
(2)①2NH2OH+2Fe3+=2Fe2++N2↑+2H2O+2H+(2分);
②Ca(OH)2+2SO2=Ca(HSO3)2(2分);2NO2-+8H++6e-=N2↑+4H2O(2分);BaCl2(1分);
5.0×10-5(1分)。
③4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑。