物质结构与性质的综合题.docx
《物质结构与性质的综合题.docx》由会员分享,可在线阅读,更多相关《物质结构与性质的综合题.docx(21页珍藏版)》请在冰豆网上搜索。
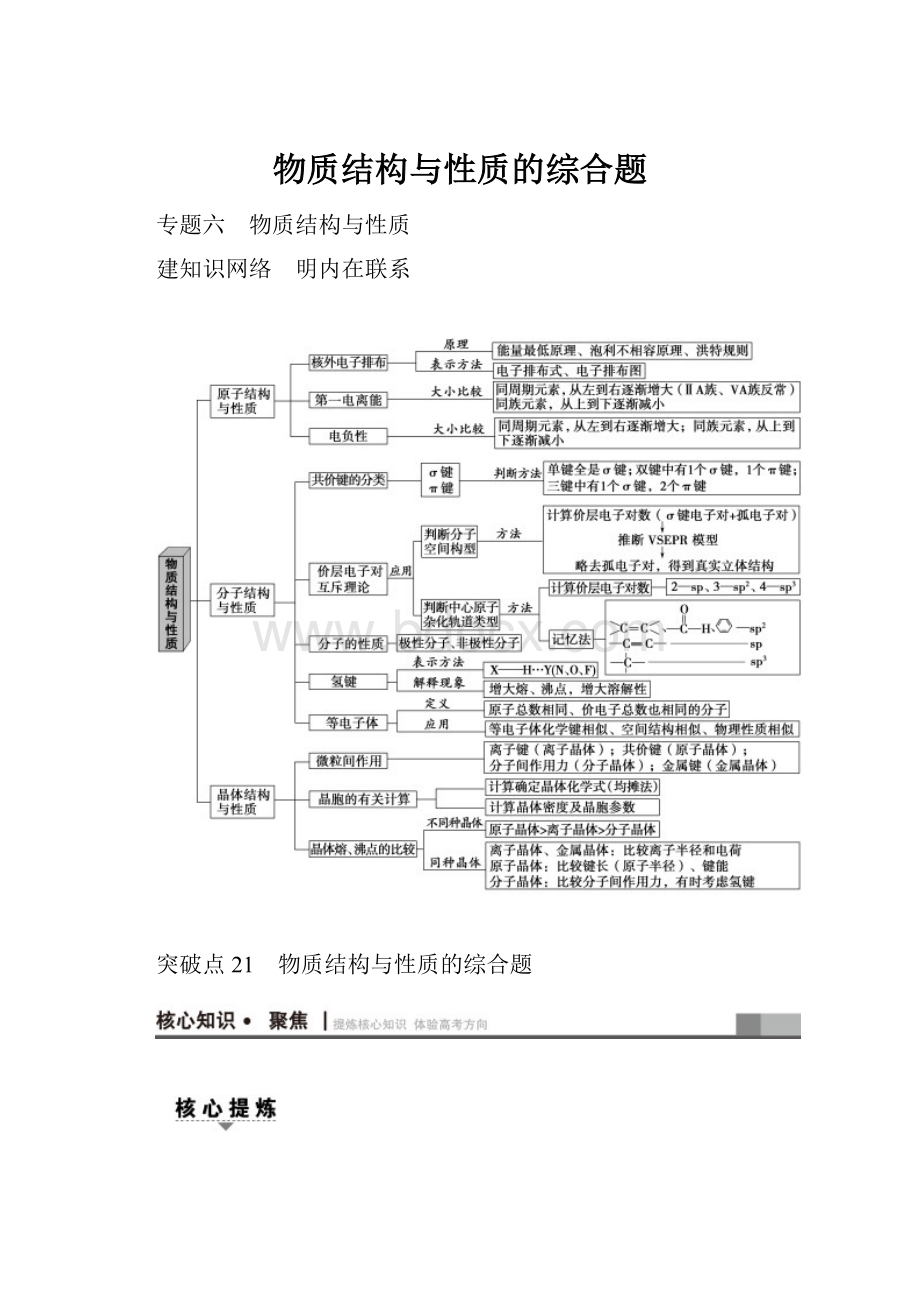
物质结构与性质的综合题
专题六 物质结构与性质
建知识网络 明内在联系
突破点21 物质结构与性质的综合题
提炼1 原子结构与性质
1.基态原子的核外电子排布
(1)排布规律
能量最低原理
原子核外电子总是先占有能量最低的原子轨道
泡利不相容原理
每个原子轨道上最多只能容纳2个自旋方向相反的电子
洪特规则
当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同
特别提醒 能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低。
如24Cr的基态原子的核外电子排布式为1s22s22p63s23p63d54s1,而不是1s22s22p63s23p63d44s2。
(2)四种表示方法
表示方法
举例
电子排布式
Cr:
1s22s22p63s23p63d54s1
简化表示式
Cu:
[Ar]3d104s1
价电子排布式
Fe:
3d64s2
电子排布图(或
轨道表示式)
2.元素第一电离能和电负性的变化规律
同周期(从左到右)
同主族(自上而下)
第一电离能
增大趋势(注意ⅡA、ⅤA的特殊性)
依次减小
电负性
依次增大
依次减小
特别提醒 同周期元素,ⅡA族(np0)和ⅤA族(ns2np3),因p轨道处于全空或半满状态,比较稳定,所以其第一电离能大于同周期右侧相邻的ⅢA族、ⅥA族元素,如第一电离能Mg>Al,P>S。
提炼2 分子结构与性质
1.共价键的分类
分类依据
类型
形成共价键的原子轨道重叠方式
σ键
“头碰头”重叠
π键
“肩并肩”重叠
形成共价键的电子对是否偏移
极性键
共用电子对发生偏移
非极性键
共用电子对不发生偏移
原子间共用电
子对的数目
单键
原子间有一对共用电子对
双键
原子间有两对共用电子对
三键
原子间有三对共用电子对
【特别提醒】
①单键为σ键;双键或三键,其中一个为σ键,其余为π键。
②配位键为一种特殊的共价键,共用电子由成键原子单方面提供。
③s轨道形成的共价键全部是σ键;杂化轨道形成的共价键全部为σ键。
2.价层电子对互斥理论的两大应用
应用Ⅰ:
判断分子空间构型
(1)判断思路:
价层电子对数目→价层电子对空间构型
分子的空间构型
(2)各种电子对的计算方法及其关系
价层电子对数=中心原子形成σ键电子对数+中心原子上的孤电子对数
①中心原子形成σ键电子对数=与中心原子结合的原子数目
②中心原子上的孤电子对数=
(a-xb)
其中a为中心原子价电子数(若为离子,则加上阴离子所带的负电荷数或减去阳离子所带的正电荷数)。
x为与中心原子结合的原子数。
b为与中心原子结合的原子最多能接受的电子数。
(3)常见的分子空间构型与价层电子对空间构型的关系
价层电
子对数
σ键电
子对数
孤电子
对数
价层电子对
空间构型
分子空
间构型
实例
2
2
0
直线形
直线形
BeCl2
3
3
0
平面三角形
平面三角形
BF3
2
1
V形
SnBr2
4
4
0
正四面体形
正四面体形
CH4
3
1
三角锥形
NH3
2
2
V形
H2O
应用Ⅱ:
判断杂化轨道类型
(1)判断思路:
价层电子对数目→杂化轨道数目→杂化类型
(2)相互关系
价层电子对数
杂化轨道数
杂化类型
2
2
sp
3
3
sp2
4
4
sp3
3.分子构型与分子极性的关系
提炼3 晶体结构与性质
1.晶体类型的判断
(1)据各类晶体的概念判断,即根据构成晶体的粒子和粒子间的作用力类别进行判断。
如由分子通过分子间作用力(范德华力、氢键)形成的晶体属于分子晶体;由原子通过共价键形成的晶体属于原子晶体;由阴、阳离子通过离子键形成的晶体属于离子晶体;由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。
(2)据各类晶体的特征性质判断,如低熔、沸点的晶体属于分子晶体;熔、沸点较高,且在水溶液中或熔融状态下能导电的晶体属于离子晶体;熔、沸点很高,不导电,不溶于一般溶剂的晶体属于原子晶体;能导电、传热、具有延展性的晶体属于金属晶体。
2.立方体(长方体)晶胞组成的计算方法
3.晶胞各物理量的计算
对于立方晶胞,可简化成下面的公式进行各物理量的计算:
a3×ρ×NA=n×M,a表示晶胞的棱长,ρ表示密度,NA表示阿伏加德罗常数的值,n表示1mol晶胞中所含晶体的物质的量,M表示晶体的摩尔质量。
回访1 (2016·全国乙卷)锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。
从原子结构角度分析,原因是______________________________________________________________________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
_________________________________________________________________
______________________________________________________________。
GeCl4
GeBr4
GeI4
熔点/℃
-49.5
26
146
沸点/℃
83.1
186
约400
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。
Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为________,微粒之间存在的作用力是______________________________________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。
下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
,0,
);C为(
,
,0)。
则D原子的坐标参数为________。
②晶胞参数,描述晶胞的大小和形状。
已知Ge单晶的晶胞参数a=565.76pm,其密度为________g·cm-3(列出计算式即可)。
[解析]
(1)锗元素在周期表的第四周期、第ⅣA族,因此核外电子排布式为[Ar]3d104s24p2,p轨道上的2个电子是未成对电子。
(2)锗虽然与碳为同族元素,但比碳多了两个电子层,因此锗的原子半径大,原子间形成的σ单键较长,p�p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键。
(3)由锗卤化物的熔沸点由Cl到I呈增大的趋势且它们的熔沸点较低,可判断它们均为分子晶体,而相同类型的分子晶体,其熔沸点取决于分子量的大小,因为分子量越大,分子间的作用力就越大,熔沸点就越高。
(4)Zn和Ge为同周期元素,Ge在Zn的右边,因此Ge的电负性比Zn的强;O为活泼的非金属元素,电负性强于Ge和Zn,因此三者电负性由大至小的顺序为O、Ge、Zn。
(5)Ge单晶为金刚石型结构,金刚石中碳原子的杂化方式为sp3,因此Ge原子的杂化方式也为sp3。
微粒之间存在的作用力为共价键。
(6)①根据题给图示可知,D原子的坐标参数为(
,
,
)。
②每个晶胞中含有锗原子8×1/8+6×1/2+4=8(个),每个晶胞的质量为
,晶胞的体积为(565.76×10-10cm)3,所以晶胞的密度为
。
[答案]
(1)3d104s24p2 2
(2)Ge原子半径大,原子间形成的σ单键较长,p�p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键
(3)GeCl4、GeBr4、GeI4的熔、沸点依次增高。
原因是分子结构相似,相对分子量依次增大,分子间相互作用力逐渐增强
(4)O>Ge>Zn
(5)sp3 共价键
(6)①
②
×107
回访2 (2016·全国甲卷)东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。
回答下列问题:
(1)镍元素基态原子的电子排布式为________________________________,
3d能级上的未成对电子数为________。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是______________;
氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。
(3)单质铜及镍都是由________键形成的晶体;元素铜与镍的第二电离能分别为:
ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是_____________
______________________________________________________________。
(4)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为________。
②若合金的密度为dg·cm-3,晶胞参数a=______________nm。
[解析]
(1)Ni是28号元素,根据核外电子的排布规律可知,其基态原子的核外电子排布式为1s22s22p63s23p63d84s2。
根据洪特规则可知,Ni原子3d能级上8个电子尽可能分占5个不同的轨道,其未成对电子数为2。
(2)①SO
中,S原子的价层电子对数为
=4,成键电子对数为4,故SO
的立体构型为正四面体。
②[Ni(NH3)6]2+中,由于Ni2+具有空轨道,而NH3中N原子含有孤电子对,两者可通过配位键形成配离子。
③由于NH3分子间可形成氢键,故NH3的沸点高于PH3。
NH3分子中,N原子形成3个σ键,且有1个孤电子对,N原子的轨道杂化类型为sp3,立体构型为三角锥形。
由于空间结构不对称,NH3属于极性分子。
(3)Cu、Ni均属于金属晶体,它们均通过金属键形成晶体。
因Cu元素基态原子的价层电子排布式为3d104s1,3d能级全充满,较稳定,失去第2个电子较难,因此ICu>INi。
(4)①由晶胞结构图可知,Ni原子处于立方晶胞的顶点,Cu原子处于立方晶胞的面心,根据均摊法,每个晶胞中含有Cu原子的个数为6×
=3,含有Ni原子的个数为8×
=1,故晶胞中Cu原子与Ni原子的数量比为3∶1。
②根据m=ρV可得,1mol晶胞的质量为(64×3+59)g=a3×dg·cm-3×NA,则a=
cm=
×107nm。
[答案]
(1)1s22s22p63s23p63d84s2或[Ar]3d84s2 2
(2)①正四面体 ②配位键 N ③高于 NH3分子间可形成氢键 极性 sp3 (3)金属 铜失去的是全充满的3d10电子,镍失去的是4s1电子 (4)①3∶1
②
×107
回访3 (2016·全国丙卷)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
回答下列问题:
【导学号:
14942081】
(1)写出基态As原子的核外电子排布式______________________________。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。
(填“大于”或“小于”)
(3)AsCl3分子的立体构型为________,其中As的杂化轨道类型为________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是
______________________________________________________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。
该晶体的类型为________,Ga与As以________键键合。
Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________________。
[解析]
(1)As元素在周期表中处于第ⅤA族,位于P元素的下一周期,则基态As原子核外有33个电子,根据核外电子排布规律写出其核外电子排布式:
1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3。
(2)同周期主族元素的原子半径随原子序数的递增而逐渐减小,Ga与As在周期表中同位于第四周期,Ga位于第ⅢA族,则原子半径:
Ga>As。
Ga、As原子的价电子排布式分别为4s24p1、4s24p3,其中As原子的4p轨道处于半充满的稳定状态,其第一电离能较大,则第一电离能:
Ga(3)As原子的价电子排布式为4s24p3,最外层有5个电子,则AsCl3分子中As原子形成3个As—Cl键,且含有1对未成键的孤对电子,则As的杂化轨道类型为sp3杂化,AsCl3分子的立体构型为三角锥形。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3是离子晶体,GaCl3是分子晶体,而离子晶体的熔点高于分子晶体。
(5)GaAs的熔点为1238℃,其熔点较高,据此推知GaAs为原子晶体,Ga与As原子之间以共价键键合。
分析GaAs的晶胞结构,4个Ga原子处于晶胞体内,8个As原子处于晶胞的顶点、6个As原子处于晶胞的面心,结合“均摊法”计算可知,每个晶胞中含有4个Ga原子,含有As原子个数为8×1/8+6×1/2=4(个),Ga和As的原子半径分别为rGapm=rGa×10-10cm,rAspm=rAs×10-10cm,则原子的总体积为V原子=4×
π×[(rGa×10-10cm)3+(rAs×10-10cm)3]=
×10-30(r
+r
)cm3。
又知Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,晶胞的密度为ρg·cm-3,则晶胞的体积为V晶胞=4(MGa+MAs)/ρNAcm3,故GaAs晶胞中原子的体积占晶胞体积的百分率为
×100%=
×100%=
×100%。
[答案]
(1)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3
(2)大于 小于 (3)三角锥形 sp3 (4)GaF3为离子晶体,GaCl3为分子晶体 (5)原子晶体 共价
×100%
[题型分析] 物质结构与性质的综合型题是近几年全国卷的选考题之一,一般为第37题,分值为15分。
该题主要考查:
(1)原子结构与性质:
基态原子核外电子排布、第一电离能和电负性递变规律等;
(2)分子结构与性质:
共价键类型的判断、原子轨道杂化类型、分子构型判断等;(3)晶体结构与性质:
晶体类型的判断、晶体熔沸点高低的比较、氢键对溶解性的影响、晶体密度和晶体参数的计算、晶体空间利用率的计算等。
[典型例题] A、B、C、D为前四周期元素且原子序数依次增大。
BA3能使湿润的红色石蕊试纸变蓝,A、B、C原子的电子数之和等于25,DC晶体中D+的3d能级上已充满电子。
请回答下列问题:
(1)这四种元素中,第一电离能最大的是________(填元素符号);D的基态原子的核外电子排布式为________________________________________________
____________________。
(2)在BA3、AC中,沸点较高的是________________(填化学式),原因是________________。
DA的晶体类型是________。
(3)BA4C晶体中含有离子键、极性键和________,在该晶体中B原子价层电子对数为________(填数字)。
(4)化合物BC3的立体构型为________________,中心原子的轨道杂化类型为________。
BC3溶于水,其水溶液具有漂白性。
工业上,以石墨为电极,电解BA4C和AC溶液可以制得BC3,写出该电池总反应的化学方程式:
______________________________________________________________。
(5)B、D形成晶体的晶胞如图所示(灰球表示D元素原子)。
已知紧邻的白球与灰球之间的距离为acm。
①该晶胞的化学式为______________________________________________。
②B元素原子的配位数为________。
③该晶胞的密度为________g·cm-3。
(NA代表阿伏加德罗常数的值)
【解题指导】 解答本题时可先推断相关元素,然后根据题设问题并联系教材知识分析、整合和迁移,解决新问题。
审题时抓住“前四周期”、“原子序数依次增大”等信息。
[解析] BA3能使湿润的红色石蕊试纸变蓝,说明B为N,A为H。
C元素原子的电子数为25-1-7=17,C的原子序数为17,故C为Cl;又因为DC晶体中D+的3d能级上已充满电子,说明D的原子序数为29,故D为Cu。
(1)四种元素中,第一电离能最大的是N,不是Cl,因为基态氮原子的2p能级上达到半充满结构,N的第一电离能大于O的,而Cl的第一电离能小于O的,故N的第一电离能大于Cl的。
(2)NH3分子间存在氢键,故NH3的沸点高于HCl的。
氢化亚铜晶体属于离子晶体。
(3)NH4Cl晶体中存在离子键、极性键和配位键,氮原子的价层电子对数为
=4。
(4)NCl3的中心原子是N原子,其中N的价层电子对数为4,成键电子对数为3,孤电子对数为1,故NCl3的立体构型为三角锥形,中心原子的杂化轨道类型为sp3。
电解氯化铵溶液和盐酸可生成三氯化氮和氢气。
(5)①观察晶胞图示知,12个铜原子位于棱上、8个氮原子位于顶点,1个晶胞中含氮原子个数为8×
=1;含铜原子个数为12×
=3,故氮化铜的化学式为Cu3N。
②顶点上1个氮原子周围紧密相邻的铜原子有3个,设想由8个立方体构成大立方体,可知氮原子上下、前后、左右共有6个铜原子紧密相邻,即氮的配位数为6。
③ρ=
g·cm-3=
g·cm-3。
[答案]
(1)N 1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)NH3 分子间存在氢键 离子晶体 (3)配位键 4
(4)三角锥形 sp3 NH4Cl+2HCl
NCl3+3H2↑
(5)①Cu3N ②6 ③
1.在书写基态原子核外电子排布时,区别电子排布式、价层电子排布式(或外围电子排布式)和电子排布图。
2.在计算晶体密度时,要注意单位换算。
例如,1m=100cm=1×109nm=1×1012pm。
3.配位键属于共价键。
4.分析物质性质时,容易混淆物质挥发性和稳定性,前者与分子间作用力有关,后者与分子中化学键强弱有关。
氢键包括分子间氢键和分子内氢键。
[针对训练]
1.(2016·河南六市联考)现有前四周期元素A、B、C、D、E,原子序数依次增大。
A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍。
基态B原子与A同周期,p能级达到半充满,C原子电子层数与最外层电子数相等,B和E同主族,基态D原子的价层电子排布通式为ns2np1。
请回答下列问题:
(1)基态E原子的价电子排布式为________。
(2)上述5种元素中,电负性最大的元素是________,1molAB-中含有π键的数目是________。
(3)BO
的空间构型为________,写出它的一种等电子体:
________。
(白球为B,黑球为D)
(4)B、C可组成一种新型无机非金属材料CB,具有耐高温,耐磨性能。
它的晶体类型为________,其晶胞与金刚石晶胞相似,已知晶胞边长为apm,则该晶胞的密度为________(用含a、NA的代数式表示)g/cm3。
(5)D、B可组成第三代半导体材料,其晶胞如图所示,它的化学式为________。
[解析] 根据提供信息,可以推断A为C,B为N,C为Al,D为Ga,E为As。
(1)基态As原子的价电子排布式为4s24p3。
(2)根据电负性大的元素位于元素周期表右上方,则5种元素中,电负性最大的为N,CN-的电子式为[:
C⋮⋮N:
]-,C和N之间为三键,而1个三键中含有1个σ键,2个π键,则1molCN-含有2molπ键。
(3)NO
中N无孤电子对,空间构型为平面三角形;NO
与CO
互为等电子体。
(4)AlN具有耐高温、耐磨性能,则为原子晶体,AlN晶胞与金刚石晶胞相似,则一个AlN晶胞中含4个Al、4个N,故晶胞的密度为
=
g·cm-3。
(5)N的个数为6×
+4=6,Ga的个数为12×
+2×
+3=6,故该晶体的化学式为GaN。
[答案]
(1)4s24p3
(2)N 2NA
(3)平面三角形 CO
(4)原子晶体
(5)GaN
2.(2016·辽南协作校联考)A、B、C、D、E、F均为前四周期元素且原子序数依次增大,A是宇宙中最丰富的元素。
B的基态原子中占据哑铃形原子轨道的电子数为1,C原子核外成对电子数比未成对电子数多1,前四周期元素中D的电负性只比氟元素小,E是第三周期中原子半径最小的元素,F位于ds区且原子的最外层电子数与A的相同。
请回答下列问题:
(1)F晶体中原子堆积模型为________________,二价F离子的电子排布式为________________。
(2)B、C、D基态原子第一电离能由大到小的顺序为________________。
(3)CE3中C原子的杂化轨道类型为________,C的气态氢化物分子的空间构型为________,将其水溶液滴入F的氢氧化物悬浊液中,反应的离子方程式为__________________________________________________________________
______________________________________________________________。
(4)已知F和E的电负性分别为1.9和3.0,则F与E形成的化合物属于________(填“离子”或“共价”)化合物。
(5)立方BC的结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方BC的密度是________________________________________________(只要求列算式)。
[解析] 根据题给信息推断A、B、C、D、E、F依次为H、B、N、O、Cl、Cu。
(1)金属铜、银、金均为面心立方最密堆积;铜原子失去最外层的一个电子和次外层的一个电子,得到铜离子的电子排布式为1s22s22p63s23p63d9。
(2)因N原子的2p轨道处于半充满状态,相对较稳定,第一电离能大于后面