化学工艺学实验.docx
《化学工艺学实验.docx》由会员分享,可在线阅读,更多相关《化学工艺学实验.docx(17页珍藏版)》请在冰豆网上搜索。
化学工艺学实验
实验一纯碱法制备轻质碳酸镁
一、实验目的
1、了解纯碱法制碳酸镁的工艺方法和操作过程。
2、初步学会利用沉淀反应来制取盐的一种方法。
二、实验原理
轻质碳酸镁即为最轻的最松散的镁白,是一种碱式碳酸镁。
由于它具有不燃烧和质地轻松的特点,常用作橡胶制品的填充剂和增强剂,绝热、耐高温的防火保温材料,还用于制造高级玻璃制品、镁盐、颜料、油漆和日用化学品等。
生产其主要来源于白云石(MgCO3·CaCO3)、菱镁矿(MgCO3)、苦卤(MgCl2、MgSO4)、海水等,工业上依生产原料不同而主要有纯碱法,白云石碳化法,海水、石灰石碳化法等。
工业上的纯碱法是将纯碱加入苦卤中是碳酸镁或氢氧化镁沉淀出来而制得的反应方程式
5MgCl2+5Na2CO3+5H2O→4MgCO3·Mg(OH)2·4H2O+CO2+10NaCl
5MgSO4+5Na2CO3+7H2O→4MgCO3·Mg(OH)2·6H2O+CO2+5Na2SO4
从反应式看出,纯碱和苦卤的反应实质上是一种沉淀反应,因此,本实验可直接用Na2CO3与镁盐溶液来制取碱式碳酸镁。
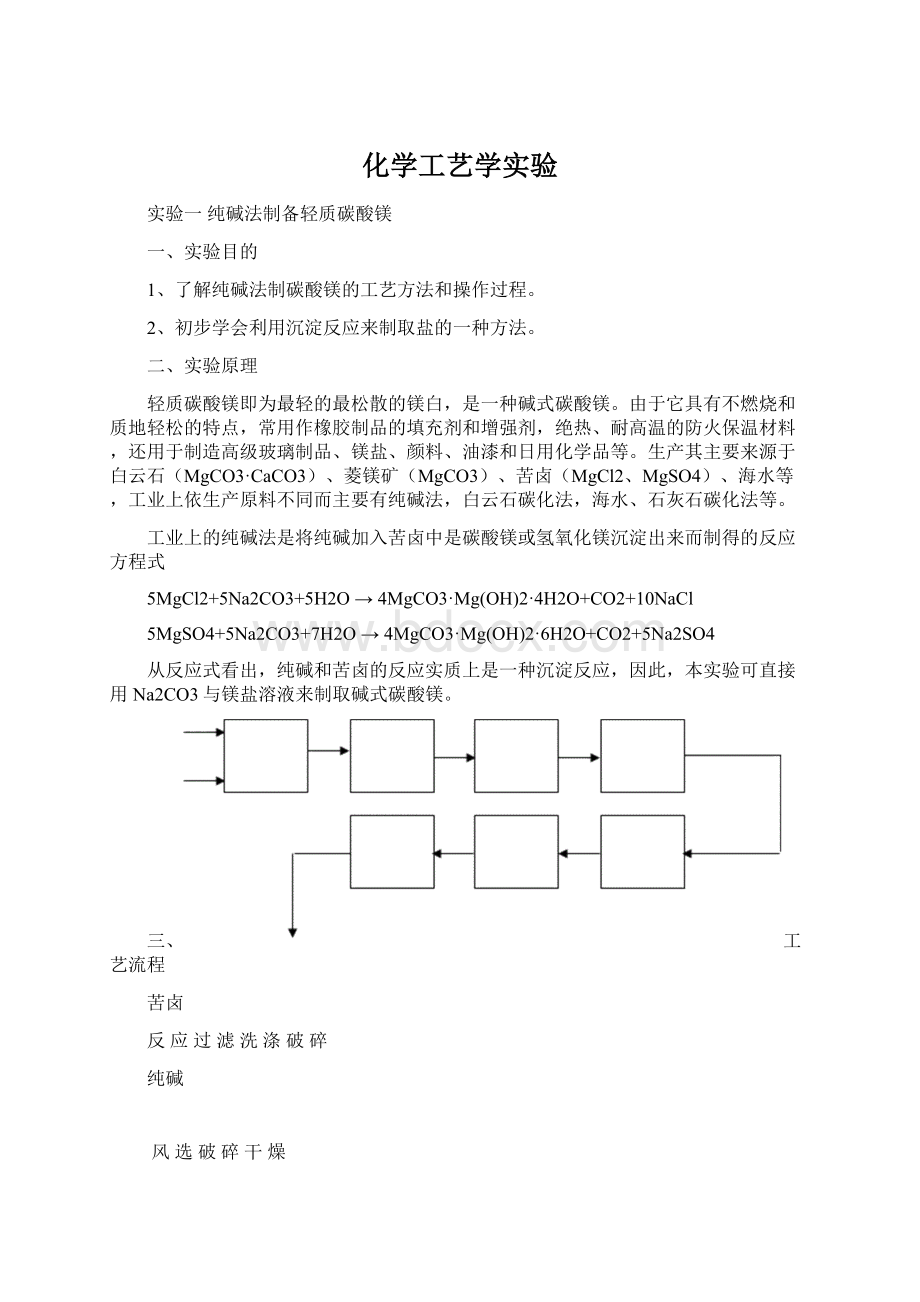
三、工艺流程
苦卤
反应过滤洗涤破碎
纯碱
风选破碎干燥
轻质碳酸镁
四、实验材料及设备
(一)原料
1、苦卤
2、纯碱
(二)设备
1、反应器用搪瓷盆或塑料桶代用
2、电动搅拌器
3、过滤器
4、电烘箱
五、实验步骤
(一)沉淀
取1升已经过滤除机械杂质的苦卤于搪瓷盆或塑料桶中,在充分搅拌下,徐徐加入25%的碱液2升;由于流动性较差,变为豆腐般粘滞,等再恢复流动性,停止搅拌。
(二)过滤、洗涤
反应完成后,将上述溶液在过滤器上过滤,若滤液浑浊,需再过滤一次,将沉淀用水洗涤1~2次,将沉淀中的水分尽量抽干。
(三)干燥
将上述干燥的沉淀破碎后,放入电烘箱内于105~110℃下干燥1小时,取出,将结成的块粉碎后装入塑料袋中,称重,取样分析其含量。
六、产品检测
(一)试剂
1、盐酸1∶1
2、NaOH10%水溶液
3、NH4Cl—NH4OH缓冲液pH=10
4、钙指示剂1%
5、K—B指示剂
6、甲基红指示剂
7、EDTA标准溶液0.1M
(二)分析手续
在分析天平上准确称取1g样品于250毫升的烧杯中,加少许水将样品润湿,加入1∶1的HCl10—20毫升,加盖在电炉上加热溶解(因有CO2气体产生,注意防止溶液溅出),将固体样完全溶解后,取下冷却,移于250毫升的容量瓶中,用水冲至刻度,摇匀。
用大肚移液管分别取两份25毫升上述溶液于250毫升的三角瓶中,一份测钙用,一份测钙镁合量。
测钙取一份式样加甲基红指示剂1滴,用稀酸和稀碱(1NHCl和1NNaOH)调节使溶液刚变黄,加水使体积为80毫升左右,加入10%NaOH溶液10毫升,加钙指示剂4~8滴,用0.1MEDTA标准溶液滴定至溶液由红色变为纯蓝色为终点。
记下消耗的EDTA毫升数(V1)。
测钙镁合量取另一份试液加入甲基红指示剂1滴,用稀酸和稀碱调至溶液刚变黄,加水使体积约为80毫升,加入pH=10的氨性缓冲液10毫升,加入2~3滴K—B指示剂,用0.1M的EDTA标准溶液滴定至溶液由红色变为稳定的蓝色(或蓝灰色)为终点。
记下消耗的EDTA溶液毫升数(V2)。
按下式计算轻质碳酸镁(按MgO计)的含量。
MgO%=
式中——MgO的分子量
M——EDTA标准溶液的摩尔浓度
G——分取样品的重量(克)
将分析数据汇于下表;
实验次数
样品重(克)
分取溶液体积(ml)
耗标准溶液的体积ml
MgO含量(%)
七、思考题
1、在纯碱法生产轻质碳酸镁时应注意哪些因素?
2、为什么要慢慢地加入沉淀剂?
3、在操作过程中为什么碱式碳酸镁易结块?
实验二硼镁石制硼酸
硼在玻璃、陶瓷、电讯、化学、医药、农业及冶金等许多工业部门都得到广泛的应用。
特别是在国防尖端工业方面有着不少新的用途。
例如,加硼制造的耐高温玻璃纤维,可用作火箭头的防护材料;氮化硼用于耐火材料及半导体;硼化氢、硼化锂、硼化铍的化合物可作为高能燃料。
此外,硼还具有显著的吸收中子的特性,可用碳化硼控制原子能反应速度;含硼2~4%的钢可做中子屏;塑料中加入硼可防辐射;复合肥料中加入少量的硼,可使粮食增产。
因此,可以说硼是重要的战略物资。
硼在地壳中的克拉克值为0.01%,在自然界中无单体存在,而多是与氧和碱土金属和碱金属元素相化合,所形成的化合物主要是硼酸和各种硼酸盐,硼酸含于某些温泉、地下卤水、油气田水、盐湖水中。
目前世界上已发现硼酸盐矿物有近百种,最为人所熟悉的是硼砂(Na2B4O7·H2O),其次还有硼镁石(MgO·B2O3·H2O),硼钙石(CaO·B2O3·H2O),钠硼解石(Na2O·2CaO·5B2O3·16H2O),硅钙硼石(2CaO·B2O3·2SiO2·H2O),硼镁铁矿(Mg,Fe)2Fe3+[BO3]O2等。
在我国硼资源的分布和存在形式大体上有四大类型,一类是硼镁铁矿,分布在辽宁、湖南。
二类是液态硼矿,主要存在于地热水、盐湖水,分布青海、西藏,油气田水、盐卤水,分布于四川、山东、湖北、新疆。
三类是天然硼砂,产于西藏、青海部分干枯盐湖沉积和部分现代盐湖结晶析出。
第四类是硼镁矿、硼钙石、钠硼解石,分布于我国西藏、青海、新疆境内,目前我国工业用硼原料主要来源于西藏和辽宁。
硼酸的生产工艺主要有以下几种方法:
1、浮选法
是针对盐湖水、盐卤水、油气田水、地热水,通过蒸发制盐后硼在母液中得到数十倍的富集,母液中H3BO3含量大于50g/l以上的可采用此法生产。
2、萃取法
选用对硼有专一萃取功能的有机溶剂,对硼进行萃取,使硼进入有机相,再进行反萃取,将萃取液蒸发浓缩,得到硼酸产品。
该方法适宜含硼量较低的液矿。
3、离子交换法
选用对硼有吸附能力的专一树脂,将硼从液矿中分离出来,经酸液洗脱,得到高浓度的硼酸溶液,经蒸发浓缩,等到硼酸产品。
该法适宜于低含量硼的液矿。
4、沉淀法
向母液中加入氯化钙,使硼形成硼酸钙沉淀,经过滤得固体硼酸钙,加盐酸溶解,便得粗硼酸,经过精制,得硼酸产品。
该方法适于含硼高,含钙镁较低的母液。
5、酸分解法
将固体硼镁矿、硼钙石、钠硼解石加酸加热溶解,便得到溶解小的硼酸(冷溶液),过滤得粗硼酸,精制后得硼酸产品。
本方法适宜固体硼矿生产硼酸。
一、实验目的
1、通过本实验教学,使学生了解和掌握利用硼镁石生产硼酸的工艺技术流程和操作过程。
2、掌握酸分解硼镁石制硼酸分解硼镁石制硼酸的基本原理。
3、了解生产工艺中使用设备性能,使用方法,技术指标以及保护设备的安全技术措施。
4、了解国内外硼酸生产的各种工艺技术方法。
二、原理
硼镁石矿经破碎、磨矿、加酸加热,使固体矿样溶解。
反应式
H2O+MgO·B2O3·H2O+H2SO4==2H3BO3+MgSO4
H2O+MgO·B2O3·H2O+2HCl==2H3BO3+MgCl2
利用各化合物在冷热溶液中溶解度相差较大和酸度等条件之关系,将硼酸从液相分离出来,经过精制,得硼酸产品。
三、工艺流程
硼镁石矿
鄂式破碎
对辊破碎
盘式细磨
过120目筛
120目矿粉大于12目矿样
称矿粉1kg
加30%HCl2升加热溶解
趁热过滤
滤渣硼酸、氯化镁溶液
酸水洗涤加热蒸发
过滤冷却至室温
过滤
滤渣弃去洗水
粗硼酸母液
精制水
精硼酸
烘干硼酸产品
四、实验材料及仪器设备
(一)原料及药品试剂
1、硼镁矿
2、工业盐酸(30%以上)
3、甘露醇
4、NaOH标准溶液0.1N
5、甲基红指示剂0.2%溶液
6、酚酞指示剂0.5%
7、的确良过滤布(2米2)
8、塑料袋(20×30cm)
(二)设备
1、鄂式破碎机(XPC—75100×60)
2、对辊破碎机(XPZΦ200×60)
3、盘式磨矿机
4、溶样杯(3000ml烧杯)
5、电炉(1500w)
6、抽滤瓶(5升)
7、布式漏斗(Φ1500mm)
8、真空泵(50立升/分)
9、脱水机
10、电烘箱
四、实验步骤
(一)矿石粉碎
用台秤称取硼镁矿石1kg,经鄂失破碎机破碎,送入对辊破碎机破碎,再送入盘式磨矿机磨矿,要求矿样粉全部过120目筛,混匀,取1g样分析矿样中硼的含量。
将粉碎后的矿样称重,重量记入实验报告内。
(二)酸分解矿石
把矿样粉全部放入3000ml烧杯中,加入30%的工业盐酸1升,用玻璃棒搅匀,放到电炉上慢慢升温加热至沸腾,煮沸10分钟,再补加盐酸1升煮至硼镁矿粉全部溶解,趁热过滤,滤渣用10%的热盐酸液洗涤二次,将滤液趁热放到电炉上蒸发浓缩到1200ml体积,取下冷却至室温,这时硼酸将大量结晶析出,把析出的硼酸抽滤,称其粗硼酸重量,量取母液体积,将数据记入实验报告表内。
(三)精制
将粗硼酸按其重量加1∶1水,加热煮沸溶解,加入NaClO5ml冷却,离心过滤,所得产物为精硼酸,称其重量,按精硼酸重量比加30%的白水对精硼酸洗涤2~3次,用AgNO3溶液检查洗涤液中无Cl-为止,将精硼酸放入可控温电烘箱内在60℃内烘1~2小时。
(四)产品检验
在分析天平上称取5克硼酸样品,用不含CO2的蒸馏水150ml加热溶解后,煮沸2~3分钟,取下冷至室温,转入250ml的容量瓶中,用水冲至刻度,摇匀。
用大肚移液管分取上述溶液25ml于250ml的三角瓶中,加入1∶1的HCl1滴,在电炉上加热至沸,取下冷却至室温。
加入1滴0.1%的甲基红指示剂,用0.1NHCl和0.1NNaOH溶液调至红色刚褪为止。
加入酚酞指示剂10滴,加入甘露醇(固体),摇匀后,用0.1NNaOH标准溶液滴定溶液呈微红色,再补加少量甘露醇,摇动,若红色褪去,则继续用NaOH溶液滴定,直至呈稳定的微红色为止。
记下耗用的NaOH标准溶液体积(V)。
按下式计算硼酸的含量。
H3BO3=
式中
N——NaOH标准溶液的当量浓度
G——分取的样品重量(克)
五、实验结果及数据整理
七、思考题
1、酸分解硼镁石矿事,矿样粒度对分解有什么影响?
2、分解时酸的用量及酸的浓度对分解矿样有何影响?
3、为什么要趁热过滤?
4、加NaClO的作用是什么?
5、精制硼酸的过程中为什么要用少量白水洗涤2~3次?
用水量多少有何关系?
6、硼酸产品的干燥为什么要求60℃以下烘干?
温度高了有什么影响?
实验内容用硼镁石生产硼酸
实
验
编
号
分解段
精制段
各段收率
总
收
率
(%)
硼
镁
石
量
(kg)
加
酸
量
(ml)
粗
硼
酸
重
(kg)
粗
硼
品
位
(%)
母
液
量
(ml)
母
液
含
硼
量
(g/l)
精
制
加
水
量
(ml)
精
硼
酸
量
(kg)
精
硼
品
位
(%)
洗
水
用
量
(ml)
洗
水
含
硼
量
(g/l)
硼
酸
产
品
量
(kg)
硼
酸
含
量
(%)
分
解
段
(%)
精
制
段
(%)
实验三碳酸氢铵和氯化钠制备碳酸钠
一、实验目的
1、通过实验了解联合制碱法的反应原理。
2、学会利用各种盐类溶解度的差异并通过复分解反应来制取一种盐的方法。
二、原理
碳酸钠又名苏打,工业上叫纯碱。
用途很广,