d区元素一相关知识点Word格式文档下载.docx
《d区元素一相关知识点Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《d区元素一相关知识点Word格式文档下载.docx(13页珍藏版)》请在冰豆网上搜索。
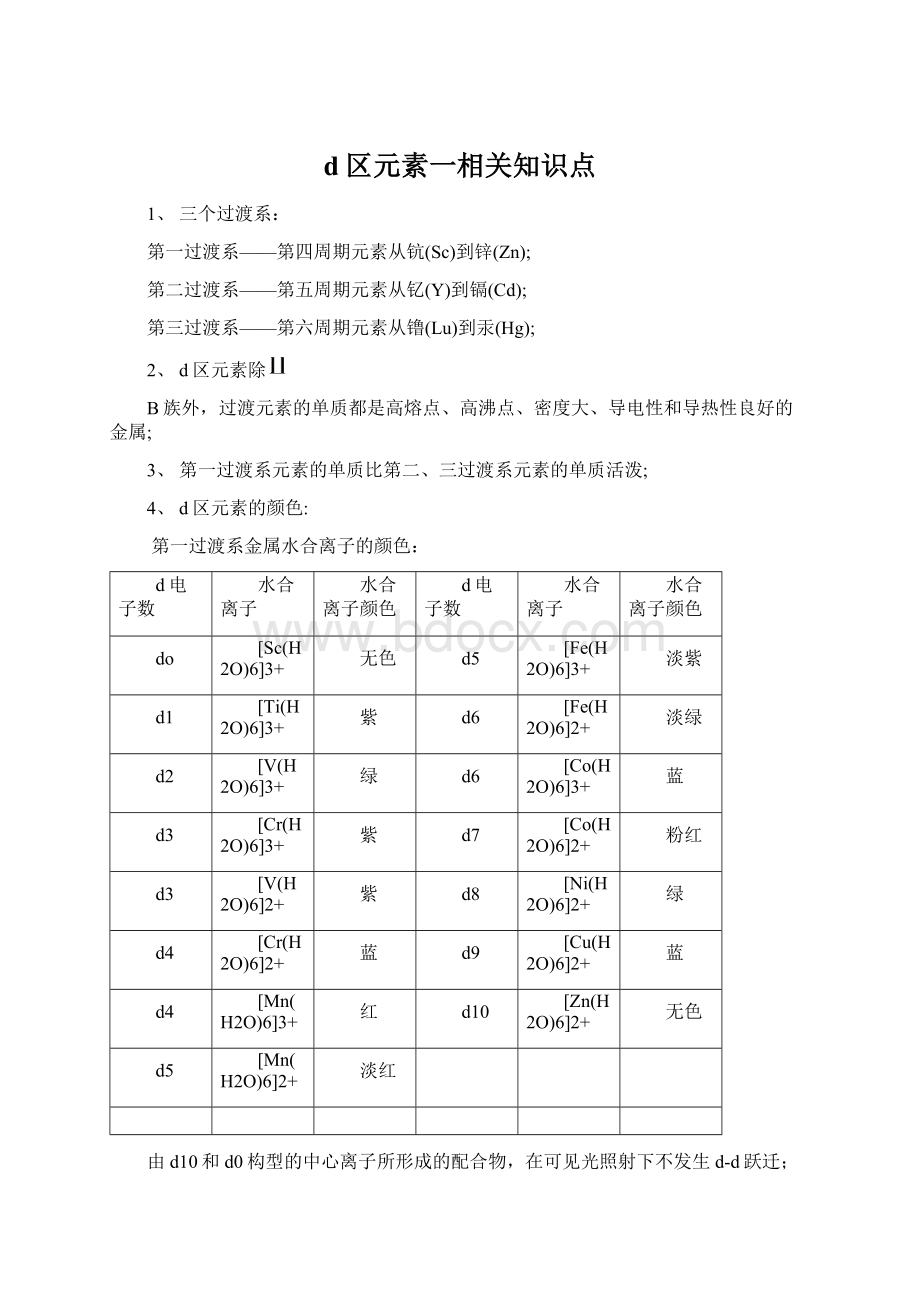
d7
[Co(H2O)6]2+
粉红
[V(H2O)6]2+
d8
[Ni(H2O)6]2+
d4
[Cr(H2O)6]2+
d9
[Cu(H2O)6]2+
[Mn(H2O)6]3+
红
d10
[Zn(H2O)6]2+
[Mn(H2O)6]2+
淡红
由d10和d0构型的中心离子所形成的配合物,在可见光照射下不发生d-d跃迁;
而d1~d9构型的中心离子所形成的配合物,在可见光的照射下会发生d-d跃迁;
对于某些具有颜色的含氧酸根离子,如:
VO43-(淡黄色)、CrO42-(黄色)、MnO4-(紫色)等,它们的颜色被认为是由电荷迁移引起的;
5、
(1)钛(Ti)是银白色金属,其表面易形成致密的氧化物保护膜,使其具有良好的抗腐蚀性,特别是对湿的氯气和海水具有良好的抗腐蚀性能;
(2)加热TiO2
可得到白色粉末状的TiO2:
;
(3)自然界中存在的金红石是TiO2的另一种存在形式,由于含少量的铁、铌、钒、钽等而呈红色或黄色;
(4)TiO2在工业上用作白色涂料和制造钛的其他化合物;
(5)TiO2+H2SO4(浓)=TiOSO4+H2O;
TiO2+2C(s)=Ti(s)+2CO(s);
(6)制取Ti的方法:
通常用TiO2、碳和氯气在800C~900C时进行反应:
用Mg还原TiCl4:
TiCl4+2Mg=Ti+2MgCl2;
(7)TiCl4在加热的情况下:
2TiCl4+H2=2TiCl3+2HCl;
(8)Ti4+由于电荷多,半径小,使它具有强烈的水解作用,甚至在强酸溶液中也未发现有[Ti(H2O)6]4+的存在,Ti4+在水溶液中是以钛氧离子(TiO2+)的形式存在;
(9)在中等酸度的Ti4+的盐溶液中加入H2O2:
TiO2++H2O2=[TiO](H2O2)]2+(橘黄色);
(10)在酸性溶液中用Zn还原TiO2+时,可形成紫色的[Ti(H2O)6]3+(可简写成Ti3+):
2TiO2++Zn+4H+=2Ti3++Zn2++2H2O;
(11)向含有Ti3+的溶液中加入碳酸时:
2Ti3++3CO32-+3H2O=2Ti(OH)3(s)+3CO2;
(12)在酸性溶液中,Ti3+是一种比Sn2+略强的还原剂,它易被空气中的氧所氧化:
4Ti3++2H2O+O2=4TiO2++4H+;
(13)有机化学中常用Ti3+来证实硝基化合物的存在,它可将硝基还原为氨基:
RNO2+6Ti3++4H2O=RNH2+6TiO2++6H+;
6、
(1)钒在自然界中的存在极为分散,很少可以见到钒的富矿;
(2)钒是银灰色金属,在空气中是稳定的,其硬度比刚大;
(3)钒对于稀酸也是稳定的,但在室温下,它能溶于王水或硝酸中,生成VO2+;
浓硫酸和氢氟酸仅在加热条件下与钒发生作用;
(4)加热时。
钒可以与大多数非金属反应;
(5)钒原子的价层电子构型为3d34s2;
V5+的化合物都是反磁性的,有些是无色的;
V的+4,+3,+2价化合物都是顺磁性的,常呈现颜色;
(6)钒的化合物都有毒:
V2O5+6NaOH=2Na3VO4+3H2O;
V2O5+H2SO4=(VO2)2SO4(硫酸钒酰)+H2O;
(7)灼烧NH4VO3时:
;
V2O5是两性偏酸的氧化物,易溶于强碱溶液,在冷的溶液中正钒酸盐
,在热的溶液中形成偏钒酸盐
:
在加热条件下,V2O5也可以与Na2CO3作用生成偏钒酸盐:
(8)V2O5是较强的氧化剂:
在有SO32-的溶液中,V2O5可溶解:
V2O5+SO32-+4H+=2VO2++SO42-+2H2O;
(9)V2O5在加热情况下的一些反应:
V
V2O4
VCl5
V2O5
VC
VOCl
V2O3;
(10)酸性溶液中钒的各种离子:
离子
VO2+
(VO2+)
[VO(H2O)5]2+
(V3+)
(V2+)
1
2
3
氧化值
+5
+4
+3
+2
颜色
淡黄色
蓝色
绿色
紫色
(11)VO2+具有较强的氧化性,易被还原为VO2+:
2VO2++SO32-=2VO2++SO42-+H2O;
用KMnO4溶液可把VO2+氧化为VO2+:
5VO2++H2O+MnO4-=5VO2++Mn2++2H+;
(12)V3+在水溶液中并不十分稳定,特别是在碱性条件下很容易被空气中的氧所氧化,V2+具有较强的还原性,V2+的化合物能从水中置换出H2;
7、钼、钨、钨都是灰白色金属,它们的熔、沸点都很高,铬是金属中最硬的,表面易形成一层氧化膜,从而降低了它们的活泼性;
8、
(1)铬原子的价层电子构型为3d54s1;
(2)水溶液中铬的各种离子:
Cr2O72-
CrO42-
(Cr3+)
[Cr(OH)4]-
(Cr2+)
+6
d0
橙红
黄色
亮绿色
存在的pH
pH<
pH>
6
酸性
适量强碱溶液中
(3)通常由铬铁矿借助于碱熔法制得Cr6+的化合物:
再在Na2CrO4溶液中加入适量的H2SO4:
2Na2CrO4+H2SO4=Na2Cr2O7+Na2SO4+H2O;
(4)以K2Cr2O7为原材料:
浓H2SO4CrO3
(NH4)2Cr2O7
KCl、浓H2SO4、蒸馏CrO2Cl2
K2Cr2O7H2SO4、SO2KCr(SO4)2.12H2O(铬钾矾)
浓HClCrCl3.H2O;
(5)氯化铬酰是深红色易挥发的液体,有较强的氧化性;
易吸水放出HCl,本身变为CrO3(铬酐):
CrO2Cl2+H2O=CrO3+2HCl;
(6)CrO3在冷却的条件下与氨水作用:
(7)有些铬酸盐比重铬酸盐难溶于水:
(8)在Cr2O72-的溶液中,加入H2O2和乙醚时,有蓝色的过氧化物CrO(O2)2.(C2H5)2O生成,这一反应用来鉴定溶液中是否有Cr6+存在;
(9)Cr2O72-具有较强的氧化性,而CrO42-的氧化性较差:
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O;
Cr2O72-+3H2S+8H+=3S(s,黄色)+2Cr3++7H2O;
Cr2O72-+3Sn2++14H+=3Sn4++2Cr3++7H2O;
Cr2O72-+3SO32-+8H+=3SO42-+2Cr3++4H2O;
K2Cr2O7(s)+14HCl(浓)=3Cl2+2CrCl3+2KCl+7H2O;
(10)(NH4)2Cr2O7晶体受热分解:
Cr2O3俗称铬绿,可做绿色颜料;
(11)在Cr3+的溶液中加入碱至过量:
Cr3++3OH-=Cr(OH)3(s,灰绿色);
Cr(OH)3+OH-=[Cr(OH)4]-(亮绿色);
溶液颜色由灰绿色变为亮绿色;
(12)在酸性中,使Cr3+氧化为Cr2O72-比较困难,需要采用氧化性更强的氧化剂,如S2O82-(过硫酸根离子):
在碱性溶液中,把[Cr(OH)4]-氧化为铬酸盐比较容易:
[Cr(OH)4]-+3H2O2+2OH-=2CrO42-+8H2O;
(13)
Cr2O3(铬绿);
2Cr3++3S2-+6H2O=Cr(OH)3(s,灰绿)+3H2S;
2Cr3++3CO32-+3H2O=2Cr(OH)3(s,灰绿)+3CO2(g);
(14)在含有[Cr(H2O)6]3+的溶液中加入锌粉,可得到蓝色的[Cr(H2O)6]2+:
2Cr3++Zn=2Cr2++Zn2+;
当有Ac-存在时,可看到难溶的、粉红色的Cr2(Ac)4.2H2O生成;
9、
(1)锰在自然界中主要以软锰矿MnO2
的形式存在;
(2)块状锰是白色金属,质硬而脆:
Mn+X2=MnX2(
);
Mn+F2=MnF4和MnF3;
Mn+2H2O=Mn(OH)2(s,白)+H2;
Mn+2H+(稀)=Mn2++H2(g);
(3)KMnO4晶体(紫红色或近乎黑色);
K2MnO4(暗绿色),MnO2粉末(黑色);
MnSO4.7H2O晶体(肉红色);
MnCl2.4H2O(肉红色);
(4)水溶液中的锰的各种离子:
MnO4-
MnO42-
[Mn(H2O)]2+
+7
紫红
暗绿
红色
存在条件
中性
13.5
易歧化
酸性中稳定
(5)以软锰矿制取KMnO4时:
再用氯气氧化:
2K2MnO4+Cl2=2KMnO4+2KCl;
(6)MnO4-的空间构型为四面体型;
(7)
MnO4-在不同条件下:
2MnO4-+SO32-+2OH-(浓)=2MnO42-+SO42-+H2O;
MnO4-+3SO32-+H2O=2MnO2(s)+3SO42-+2OH-;
2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O;
(8)通常用棕色瓶装KMnO4溶液:
MnO4-+4H+=4MnO2+2H2O+3O2(中性或弱碱性);
4MnO4-+4OH-=4MnO42-+O2+2H2O(浓碱);
2MnO4-+5H2S+5H+=2Mn2++5S+8H2O;
6MnO4-+5S+8H+=6Mn2++5SO42-+4H2O;
(9)MnO4-在微酸性条件下通入CO2或加入醋酸,甚至在中性条件下,可发生歧化反应:
3MnO42-+4H+=2MnO4-+MnO2+2H2O;
3MnO42-+2CO2=MnO2+2MnO4-+2CO32-;
(10)在酸性溶液中,MnO2具有强氧化性:
(11)加热MnO2可分解为Mn3O4和O2:
在氢气流中加热MnO2或Mn3O4:
(12)向Mn2+的溶液中加入OH-时:
它在空气中很快被氧化:
2Mn(OH)2+O2=2MnO(OH)2(棕黄色);
(13)Mn2+的特征反应:
2Mn2++5NaBiO3+14H+=2MnO4-+5Bi2++5Na++7H2O;
由于反应生成了MnO4-而使溶液呈紫色,因此常用这一反应来检验溶液中是否存在微量的Mn2+;
但是溶液中有Cl-存在时,溶液颜色变为紫红色后立即褪去,这是由于MnO4-被还原为Cl-还原,当Mn2+过多时,也会在紫红色出现后立即消失:
2MnO4-+3Mn2++2H2O=5MnO2+4H+;
10、
(1)铁与冷的稀硝酸作用时,没有气态氮氧化合物生成:
4Fe+10H++NO3-=4Fe2++NH4++3H2O;
铁与热的稀硝酸作用时:
Fe+4H++NO3-(较浓)=Fe3++NO+2H2O;
Fe+6H++3NO3-(浓)=Fe3++3NO2+3H2O;
冷的浓硝酸可使铁、钴、镍变成钝态;
(2)铁的价层电子构型为:
3d64s2;
(3)铁的常见氧化物有红棕色的Fe2O3、黑色的FeO、黑色的Fe3O4;
实验室常用上述反应制取Fe2O3或FeO;
(4)向Fe2+或Fe3+的溶液中加入强碱或氨水:
4Fe(OH)2+O2+2H2O=4Fe(OH)3(s),
溶液颜色由白变灰绿,再变为红褐色;
(5)在浓碱溶液中:
2Fe(OH)3+3ClO-+4OH-=3Cl-+5H2O+2FeO42-(高铁酸根离子);
高铁酸根离子(FeO42-)的颜色为紫红色;
(6)带有结晶水的FeCl3.6H2O易潮解,工业上常将其用作净水剂;
(7)在酸性溶液中,Fe3+是中强氧化剂:
2Fe3++2I-=2Fe2++I2;
2Fe3++H2S=2Fe2++S(s)+2H+;
2Fe3++Fe=3Fe2+;
2Fe3++Cu=2Fe2++Cu2+;
2Fe3++Sn2+=Sn4++2Fe2+;
(8)在Fe2+的溶液中,加入KSCN溶液,首先:
Fe2++2CN-=Fe(CN)2(s,白);
过量时:
Fe(CN)2+4CN-=[Fe(CN)6]4-;
用氯气氧化时:
2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-;
(9)鉴定Fe3+:
xFe3++xK++x[Fe(CN)6]4-=[KFe(CN)6Fe]x(蓝色),普鲁士蓝;
鉴定Fe2+:
xFe2++xK++x[Fe(CN)6]3-=[Kfe(CN)6Fe]x,滕氏蓝;
两种鉴定均在酸性条件下;
(10)用于鉴定NO3-:
3Fe2++NO3-+4H+=3Fe3++NO+2H2O;
[Fe(H2O)6]2++NO=[Fe(NO)(H2O)5]2++H2O;
(11)当硝酸与[Fe(CN)6]4-的溶液作用时:
[Fe(CN)6]4-+4H++NO3-=[Fe(CN)5(NO)]2-+CO2+NH4+;
[Fe(CN)5(NO)]2-(五氰亚硝酰合铁酸根离子);
用于鉴定S2-:
[Fe(CN)5(NO)]2-+S2-=[Fe(CN)5NOS]4-(紫红色);
11、
(1)
Co2O3+6HCl(浓)=2CoCl2+Cl2+3H2O;
PbO2
MnO2;
(2)钴的价层电子构型为:
3d74s2;
(3)Co2++2OH-=Co(OH)2(s,粉红);
2Co(OH)2+1/2O2+(x-2)H2O=Co2O3
(4)CoF3是淡棕色粉末,与水猛烈作用放出氧气:
在有机合成上:
(5)氯化钴CoCl2.6H2O在受热脱水过程中:
CoCl2.6H2O是变色硅胶;
(粉红)(紫红)(蓝紫)(蓝色);
(6)制取[Co(CN)6]Cl3的反应:
4[Co(CN)6]4-+O2+2H2O=4[Co(CN)6]3-+4OH-;
(7)把Na3[Co(NO2)6]溶液加到K+的溶液:
2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6](s,黄),
K2Na[Co(NO2)6](六硝基合钴酸钠);
(8)
(粉红)(蓝);
(9)[Co(NH3)6]具有较强的还原性,易被空气中的O2氧化:
4[Co(NH3)6]2++O2+2H2O=4[Co(NH3)6]3++4OH-;
(10)在含有Co2+的溶液中加入KSCN(S)及丙酮,用于鉴定Co2+:
12、
(1)镍的价层电子构型:
3d84s2;
(2)
(3)Ni2++2OH-=Ni(OH)2(s,苹果绿);
在Ni(OH)2溶液中加入较强的氧化剂:
13、
(1)Fe、Co、Ni具有永久磁性;
(2)还原性:
Fe2+>
Co2+>
Ni2+(关于失电子能力),因为随原子序数的增加,有效电荷增加,增强了核对3d电子的束缚作用;
(3)(NH4)2Fe(SO4)2,硫酸亚铁铵晶体(摩尔盐),绿色;
CoCl2.6H2O,氯化钴晶体,粉红色;
CoSO4.7H2O,硫酸钴晶体,淡紫色;
NiCl2.6H2O,氯化镍晶体,草绿色;
NiSO4.7H2O,硫酸镍晶体,暗绿色;
Ni(NO3)2.6H2O,硝酸镍晶体,青绿色;