有机化学实验 本科 2Word文档下载推荐.docx
《有机化学实验 本科 2Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《有机化学实验 本科 2Word文档下载推荐.docx(13页珍藏版)》请在冰豆网上搜索。
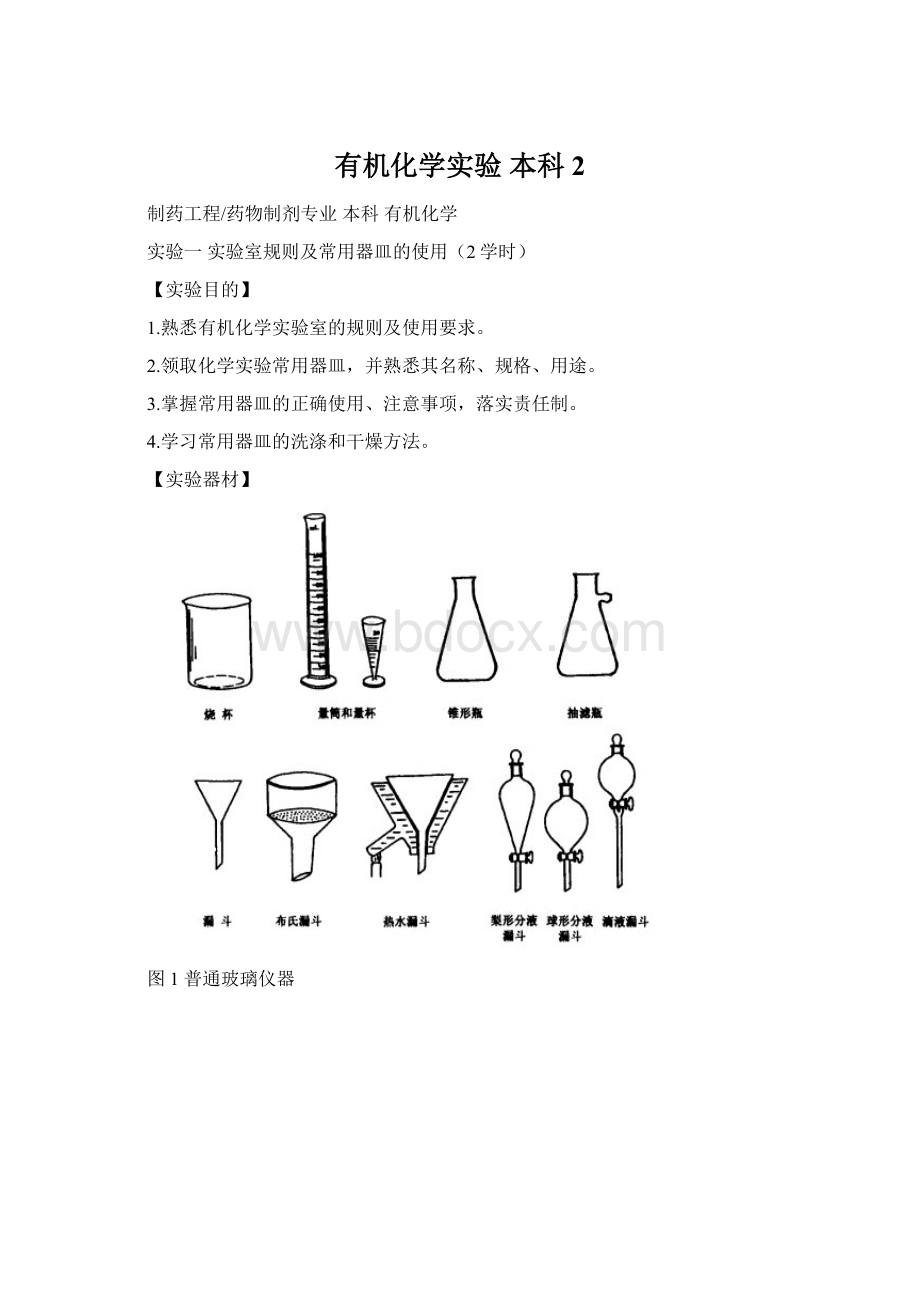
(5)实验过程中应保持安静,不得大声喧哗、随意走动;
应认真操作,细致观察,积极思考,并及时、真实的记录实验现象及实验数据。
(6)保持实验室和实验台面、地面的整洁,勿使试剂、药品洒在实验台面和地面。
废物应分类放置,废纸、废渣等固体废物应倒在垃圾篓中,不得随处乱扔;
废液倒入废液缸中,少量可倒入水槽中,并用大量水冲洗或稀释,以防腐蚀或堵塞下水管道;
空试剂瓶、碎玻璃应单独存放。
(7)节约使用药品、试剂试药、水、电等;
注意保持药品和试剂的纯净,严防混杂;
公用试剂试液用毕,应立即盖上瓶盖放回原处。
(8)实验室内仪器,尤其是精密仪器禁止随意乱动,使用前实验教师应进行讲解,指导学生严格按照标准操作规程使用,如发现异常情况,应立即停止使用,并及时报告实验室管理人员。
(9)注意实验室内安全,严禁吸烟,禁止使用明火(如电炉)!
酒精灯、煤气灯除外。
酒精灯、煤气灯要随用随灭,必须严格做到“火着人在,人走火灭”。
(10)实验室内一切物品,未经实验室管理人员批准严禁携出室外,借物必须办理登记手续。
(11)实验完毕,每小组将试剂、试液排列整齐,放在试剂架上;
玻璃器皿洗涤干净,放回仪器柜;
实验台面抹拭干净方可离开。
值日生负责讲台、边台、窗台和地面等公共场所卫生的打扫和整理,并检查水、电、门、窗的开关,经实验室管理人员检查同意后,方可离开实验室。
(12)实验完毕后一周内,学习委员收齐本次实验报告,交给代课教师,并附未交学生名单,过期不交者无实验成绩。
2.常用仪器、器皿的认领和使用:
3.学习组装回流和蒸馏装置:
(1)回流装置的组装
(2)蒸馏装置的组装
A.安装顺序一般由左至右,由下至上,首先从左下侧的热源开始安装。
B.温度计安装时要确保蒸馏时水银球能完全被蒸汽包围,从而获得准确地读数。
C.安装冷凝管时,要使冷凝水从下口进入,上口流出,保证“逆流冷却”。
D.整套装置要求准确端正,各个仪器的轴线要在同一平面内,铁架台的铁架尽可能放在仪器后部。
各仪器之间的装配要严密,防止蒸馏过程中蒸汽逸出,使产品损失或发生火灾。
制药工程/药物制剂专业本科有机化学实验二无水乙醇的制备和沸点的测定
1.学习用氧化钙法制备无水乙醇。
2.掌握回流和蒸馏的操作方法。
仪器:
圆底烧瓶100~200ml、回流冷凝管、接受器(瓶)、干燥管
试剂:
100ml95%乙醇、15gCaO、0.25gNaOH、无水
、无水
【实验原理】
某些液态有机化合物和其他液态物质以某种比例混合时,会形成具有固定沸点的二元或三元共沸物(即恒沸物),如95.5%的乙醇中含有4.5%的水,形成了沸点为78.1℃的二元共沸物。
共沸混合物在共沸时,混合物的蒸汽相组成与液相的组成完全相同,所以不能再用蒸馏的办法来分离提纯共沸物。
含量为95.5%的乙醇还含有4.5%的水,若要得到纯度更高的乙醇,实验室中常用氧化钙法或分子筛法等除去乙醇中的水分。
本实验在95%的乙醇中加入氧化钙加热回流,使水和氧化钙反应生成不挥发、加热不易分解的氢氧化钙来除去水分,再用蒸馏的方法将乙醇分离出来,这样制得的无水乙醇,纯度最高可达99.5%。
1.将100ml95%乙醇,15g生石灰,0.25gNaOH装入250ml圆底烧瓶,摇匀。
2.回流:
将圆底烧瓶与冷凝管相连,装配好回流装置和干燥管,在电热套上加热回流2h。
3.蒸馏:
回流结束后,待反应体系稍冷,将其改装成蒸馏装置,并连接干燥管,用电热套加热蒸馏出无水乙醇,用量筒计量得到的无水乙醇,计算收率。
4.对比试验:
取后馏分1ml于小试管,加入无水硫酸铜,观察现象,用95%乙醇作对比试验,并得出结论。
【注意事项】
1.必须在烧瓶中加入沸石,以防止在回流和蒸馏过程中发生爆沸。
2.蒸馏开始时,应缓慢加热,使烧瓶内的物料缓慢升温,但温度计的温度
达到乙醇的沸点时(78℃),再收集馏出液。
3.当烧瓶中的物料变为糊状时,表示蒸馏已接近尾声,应立即停止加热,
利用电热套余温将剩余的液体蒸出,以免烧瓶过热破裂。
4.加热前一定要先通冷凝水,冷凝水应是“下进上出”;
实验完毕,应先撤
去火源,稍等几分钟,等温度稍微冷却后再停止通水。
4.蒸馏速度的控制十分重要,不应太快或太慢。
在蒸馏过程中,应始终保
持温度计水银球上有一稳定的液滴,这是气液两相平衡的象征。
这时,温度计的读数便能代表液体的沸点。
【思考题】
蒸馏与回流时,加入沸石的目的是什么?
制药工程/药物制剂专业本科有机化学
实验三葡萄糖溶液旋光度的测定
1.了解旋光仪的构造。
2.熟悉比旋光度的计算方法
3.掌握旋光仪的使用方法。
【实验器材】
旋光仪、分析天平、100ml烧杯、100℃温度计、100ml容量瓶
葡萄糖晶体、葡萄糖溶液
物质可按是否具有光学活性分为两大类,一类具有使偏振光的振动平面旋转的性质,如乳酸、葡萄糖等,称为旋光性物质或光学活性物质;
另一类对偏振光不产生影响,没有旋光性。
旋光度是指光学活性物质使偏振光的振动平面旋转的角度。
物质的旋光度与溶液的浓度、溶剂、温度、旋光测定管长度和所用光源的波长等都有关系,所以常用比旋光度[α]λt来表示各物质的旋光性。
溶液的比旋光度[α]λt=
式中[α]λt——旋光性物质在t℃,光源的波长为λ时的旋光度
t——测定时溶液的温度
λ——光源的光波波长
α——标尺盘转动角度的读数(即旋光度)
c——溶液的浓度(指1ml溶液中所含物质的克数)
l——测定管的长度(dm)
在一定条件下,比旋光度是旋光性物质的一个重要物理常数,通过对旋光度的测定可以简单鉴定光学活性物质的含量和纯度。
【实验步骤】
1.旋光仪零点的校正在测定样品前,必须先校正旋光仪零点。
将旋光仪的旋光管清洗干净,装上蒸馏水,使液面凸出管口,将玻璃盖沿管口边缘轻轻平推盖好,不能带入气泡,管内不能有空隙,否则将影响测定结果。
然后旋上螺丝帽盖,使之不漏水。
但注意不可旋得过紧,以免玻璃盖产生扭力而影响读数正确性。
将已装好蒸馏水的旋光管外壁擦干,放入旋光仪内,罩上盖子,开启钠光灯约5分钟,待发光正常后,将标尺盘调到零点左右,转动旋钮,使视场亮度达到一致,此时读数应为零,由于使用者对其感觉不一,此读数可能为某一数值(即为初读数)记下读数。
重复操作至少5次,取其平均值即为零点。
若零点相差太大,应重新校正。
2.测定已知准确浓度的葡萄糖溶液的旋光度用分析天平准确称量10.000g葡萄糖晶体于小烧杯中,加入适量蒸馏水,搅拌使之溶解,定量转移到100ml容量瓶中,稀释至标线,摇匀备用。
用上述溶液少量润洗旋光管2次,以避免葡萄糖溶液被蒸馏水稀释而改变浓度。
然后将溶液装入旋光管,每隔2分钟测定1次旋光度,观察葡萄糖溶液的变旋现象,读取其稳定的读数。
重复操作5次,去5次稳定读数的平均值,此时所得的读数与零点之间的差值即为葡萄糖溶液的旋光度。
记录旋光管的长度及溶液的浓度,然后按公式计算其比旋光度。
3.测定未知浓度的葡萄糖溶液的旋光度将旋光管用蒸馏水洗净后,再用少量待测溶液润洗2次,按上述方法测定该溶液的旋光度。
将所测旋光度的读数与上述实验(布骤2)所计算出的比旋光度代入公式,即可确定该溶液的浓度。
1.旋光仪在开始测量前,必须预热5—10min,至钠光灯充分受热。
2.测量前还需校正旋光仪的零点。
3.旋光管在装入蒸馏水或待测液体后,不能带入气泡;
若样品管中有气泡,应让气泡浮在凸颈处。
旋光管上的螺丝帽不可旋得过紧,以免玻璃盖产生扭力而影响读数正确性。
旋光度和比旋光度有何区别?
实验五肥皂的制备
【实验要求】
1.掌握皂化实验的过程以及本质;
2.熟悉制作肥皂的工序。
1.制皂的基本化学反应是油脂和碱相互作用生成肥皂和甘油;
(C17H35COO)3C3H5+3NaOH加热3C17H35COONa+C3H5(OH)
2.理论过程:
反应所得的皂经盐析、洗涤、整理后,称为皂基,再继续加工而成为不同商品形式的肥皂。
【实验试剂和仪器】
烧杯、量筒、蒸发皿、玻璃棒、酒精灯、铁圈、铁架台、火柴。
猪油、乙醇、氢氧化钠溶液、氯化钠饱和溶液、蒸馏水。
1.在一干燥的烧杯中加入3g猪油、6ml乙醇和10ml40%氢氧化钠溶液。
2.在搅拌下,给烧杯中的液体微微加热,加热过程中加入乙醇与水混合液(1:
1),直到混合物变稠。
3.继续加热,直到把一滴混合物加到水中时,在液体表面不再形成油滴为止。
4.把盛有混合物的烧杯放在冷水中冷却,然后逐渐加入150ml氯化钠饱和溶液,充分搅拌。
5.用定性滤纸滤出固态物质,弃去含有甘油的溶液,把固态物质挤干,并把它压制成型,晾干,即制成肥皂。
【实验思考题】
1.在制备肥皂过程中为何要加入氯化钠饱和溶液?
2.如何确定在加热过程中液体表面不再有油滴生成?
【实验注意事项】
1.油脂不易溶于碱水,加入乙醇为的是增加油脂在碱液中的溶解度,乙醇的高挥发性将水分快速带出,加快皂化反应速度。
2.加热用小火或热水浴。
3.皂化反应时,保持混合液体积不变,不能让蒸发皿里的混合液蒸干或溅到外面。
实验六从茶叶中提取咖啡因(6课时)
一、实验目的
1、学习生物碱的提取方法;
2、了解咖啡因的性质;
3、学习脂肪提取器的作用和使用方法。
二、实验原理
茶叶中含有咖啡因,约占1~5%,另外还含有11~12%的丹宁酸(鞣酸),0.6%的色素、纤维素、蛋白质等。
为了提取茶叶中的咖啡因,可用适当的溶剂(如乙醇等)在索氏提取器中连续萃取,然后蒸去溶剂,即得粗咖啡因。
粗咖啡因中还含有其它一些生物碱和杂质(如单宁酸)等,可利用升华法进一步提纯。
咖啡因易溶于氯仿(12.5%),水(2%)及乙醇(2%)等。
含结晶水的咖啡因为无色针状晶体,在100℃时即失去结晶水,并开始升华,在120℃升华显著,178℃升华很快。
三、仪器及药品
酒精灯、索氏提取器、滤纸、圆底烧瓶、球形冷凝管、蒸馏瓶、直形冷凝管、蒸发皿、玻璃漏斗
样品:
茶叶、95%乙醇、生石灰
四、实验装置图
五、实验步骤
1、粗提:
a、仪器安装:
采用索氏提取器
b、连续萃取:
称取10g茶叶,研细,用滤纸包好,放入索氏提取器的套筒中,用75mL95%乙醇水浴加热连续萃取2~3h。
c、蒸馏浓缩:
待刚好发生虹吸时,立即停止加热,将提取液转移到100ml蒸馏瓶中进行蒸馏,待蒸出60-70ml乙醇时,停止蒸馏。
d、加碱中和:
趁热将残余物倾入蒸发皿中,拌入3~4g生石灰,使成糊状,蒸气浴加热,不断搅拌下蒸干,压碎块状物。
e、除水:
将蒸发皿放在石棉网上,小火焙炒,除尽水分。
2、纯化:
安装升华装置。
用滤纸罩在蒸发皿上,并在滤纸上扎一些小孔,再罩上口径合适的玻璃漏斗。
b、初次升华:
小火加热升华,控制温度在220℃左右。
当滤纸上出现许多毛状(白色)结晶时,小心取出滤纸,刮下咖啡因。
c、再次升华:
残渣经搅拌后用较大的火再加热升华。
直至残渣变成棕色为止,合并所有的咖啡因,然后称重。
四、实验说明及注意事项
1、脂肪提取器是利用溶剂回流和虹吸原理,使固体物质连续不断地为纯溶剂所萃取的仪器。
溶剂沸腾时,其蒸气通过侧管上升,被冷凝管冷凝成液体,滴入套筒中,浸润固体物质,使之溶于溶剂中,当套筒内溶剂液面超过虹吸管的最高处时,即发生虹吸,流入烧瓶中。
通过反复的回流和虹吸,从而将固体物质富集在烧瓶中。
脂肪提取器为配套仪器,其任一部件损坏将会导致整套仪器的报废,特别是虹吸管极易折断,所以在安装仪器和实验过程中须特别小心。
2、用滤纸包茶叶末时要严实,防止茶叶末漏出堵塞虹吸管;
滤纸包大小要合适,既能紧贴套管内壁,又能方便取放,且其高度不能超出虹吸管高度。
3、若套筒内萃取液色浅,即可停止萃取。
4、浓缩萃取液时不可蒸得太干,以防转移损失。
否则因残液很粘而难于转移,造成损失。
5、拌入生石灰要均匀,生石灰的作用除吸水外,还可中和除去部分酸性杂质(如鞣酸)。
6、升华过程中要控制好温度。
若温度太低,升华速度较慢,若温度太高,会使产物发黄(分解)。
7、刮下咖啡因时要小心操作,防止混入杂质。
中药制药技术专业专科中药药剂学
实验七醇、酚、醚的性质
1.验证醇、酚、醚的主要化学性质
2.能用化学方法鉴别伯、仲、叔醇、一元醇以及苯酚等物质。
试管、100ml烧灯、酒精灯。
无水乙醇、金属钠、酚酞试液、正丁醇、仲丁醇、叔丁醇、蒸馏水、3mol/l
硫酸、0.17mol/l重铬酸钾溶液、卢卡斯试剂、2.5mol/l氢氧化钠溶液、乙醇、0.3mol/l硫酸铜溶液、甘油、0.2mol/l
苯酚溶液、饱和碳酸氢钠溶液、苯酚、饱和溴水、0.2mol/l邻苯二酚溶液、0.2mol/l苯甲醇溶液、0.06mol/l三氯化铁溶液、0.03mol/l高锰酸钾溶液。
1.醇与活泼金属反应放出氢气
2.醇在酸性的重铬酸钾溶液中发生氧化反应生成酸
3.醇与卢卡斯试剂发生反应生成卤代烷
4.甘油与氢氧化铜发生反应
5.酚与氢氧化钠发生,显示出弱酸性
6.溴与苯酚发生卤代反应生成三溴苯酚的白色沉淀
7.酚与三氯化铁发生显色反应
8.酚能够和氧化剂发生氧化反应
9.醚能与强酸反应,生成佯盐
醇的官能团是羟基,其化学反应主要发生在羟基及与羟基相连的碳上,主要包括0-H键和C-0键的断裂,此外,由于α-H原子有一定的活泼性,因此还能发生氧化反应。
具有邻二酚结构的多元醇,能与氢氧化铜作用生成深蓝色的物质。
由于酚羟基氧原子上的未共用电子对与苯环的π电子形成了ρ-π共轭体系,使氧原子上的电子云密度降低,增强了氢氧键的极性,所以苯酚显弱酸性。
而ρ-π共轭体系的形成,使苯环上的电子云密度增加,尤其是在羟基的邻、对位,因此苯酚极易发生取代反应,如能与溴水生成白色沉淀。
大多数酚类都能和三氯化铁溶液发生显色反应。
酚类很容易被氧化。
因为醚键氧原子有未共用电子对,能接受质子,所以醚能与强酸作用。
实验步骤:
1、醇与金属钠的反应取干燥试管1支,加入无水乙醇0.5ml,再加入新切的金属钠一粒,观察和解释变化。
冷却后,加入蒸馏水少许,然后再加入酚酞试液1滴,观察和解释变化。
2、醇的氧化取试管4支,分别加入正丁醇、仲丁醇、叔丁醇、蒸馏水各三滴,然后在以上4支试管中分别加入3mol/l硫酸、0.17mol/l重铬酸钾溶液各2-3滴,振摇,观察和解释变化。
3、与卢卡斯试剂的反应取干燥试管3支,分别加入正丁醇、仲丁醇、叔丁醇各3滴,在50-60o水浴中预热片刻。
然后同时向3支试管中加入卢卡斯试剂1ml,振摇,观察和解释变化。
4、甘油与氢氧化铜的反应取试管2支,各加入2.5ml/l氢氧化钠溶液1ml和0.3mol/l硫酸铜溶液10滴,摇匀,观察现象。
然后分别加入乙醇2-3滴、甘油2-3滴,振摇,观察变化。
然后往深蓝色溶液中滴加浓盐酸到酸性,观察和解释变化。
5、酚的弱酸性试验取试管2支,编号,再分别加入固体苯酚少许和水1ml,振摇,观察现象。
往1#试管中加2.5mol/l氢氧化钠溶液数滴,振摇,观察现象;
往2#试管中加饱和碳酸氢钠溶液1ml,振摇,观察和解释变化。
6、溴与苯酚的反应在试管中加0.2mol/l苯酚溶液2滴,逐滴加饱和溴水、振摇,直至白色沉淀生成,观察和解释变化。
7、酚与三氯化铁的反应取试管3支,分别加入0.2mol/l苯酚溶液、0.2mol/l邻苯二酚溶液、0.2mol/l苯甲醇溶液各数滴,再加入0.06mol/l三氯化铁溶液1滴,振摇,观察和解释变化。
8、酚的氧化在试管中加入2.5mol/l氢氧化钠溶液5滴,0.03mol/l高锰酸钾溶液1-2滴,再加入0.2mol/l苯酚溶液2-3滴,观察和解释变化。
9、醚生成镁盐的反应取干燥大试管2支,分别加入浓盐酸、浓硫酸各2ml,都放在冰浴中冷却。
再取2支小试管,各加入乙醚1ml,也放在冰浴中冷却。
然后在冷却和振摇下,分别把冷的乙醚加到上述2支大试管中去,摇匀,观察现象,注意是否还有乙醚的气味?
然后王上述2支试管中各倒入冰水5ml,振摇,观察乙醚的气味是否重要?
解释这些现象。
【注意事项】
1、醇与金属钠的反应的关键操作是试管和试剂必须是无水的,如果本实验过程中有水存在的话,金属钠首先是和水发生反应,反应会很剧烈。
并会对实验结果产生干扰。
2、叔醇分子中没有α-H,不能被重铬酸钾溶液所氧化,但在强酸性条件下,叔醇有可能发生脱水反应,生成烯烃,而烯烃是很容易被氧化的,所以会观察到橙红色变绿色,即出现“假氧化”现象。
因此,本实验过程中,只要观察到伯醇、仲醇被氧化后,即可停止实验,以避免出现“假氧化”现象。
3、卢卡斯实验,只适用于区分含6个碳原子以下的伯、仲、叔醇、而不能用来鉴别醇与其他物质。
4、做具有邻二醇结构的多元醇的鉴别实验时,应先制备氢氧化铜,然后再加入醇,才能得到非常明显的变化,而且制备氢氧化铜时,氢氧化钠略过量。
5、苯酚有较强的腐蚀性,做酚的弱酸性实验时,要注意安全。
6、在完成醚生成镁盐的反应时,考虑到保护环境和学生的安全,特意使用的是叔丁基醚,这也是为了适应“绿色化学”的教学理念。
同理,如果可能的话,本实验最好采用“小量”,既达到了实验效果,又可以减少对环境的污染,还能节约试剂。
1、为什么乙醇与金属钠作用时必须使用干燥试管和无水乙醇?
2、哪些试剂可以用于正丁醇、仲丁醇、叔丁醇的鉴别?
3、一元醇和邻二醇可用什么方法来鉴别?