电化学含答案Word格式.docx
《电化学含答案Word格式.docx》由会员分享,可在线阅读,更多相关《电化学含答案Word格式.docx(44页珍藏版)》请在冰豆网上搜索。
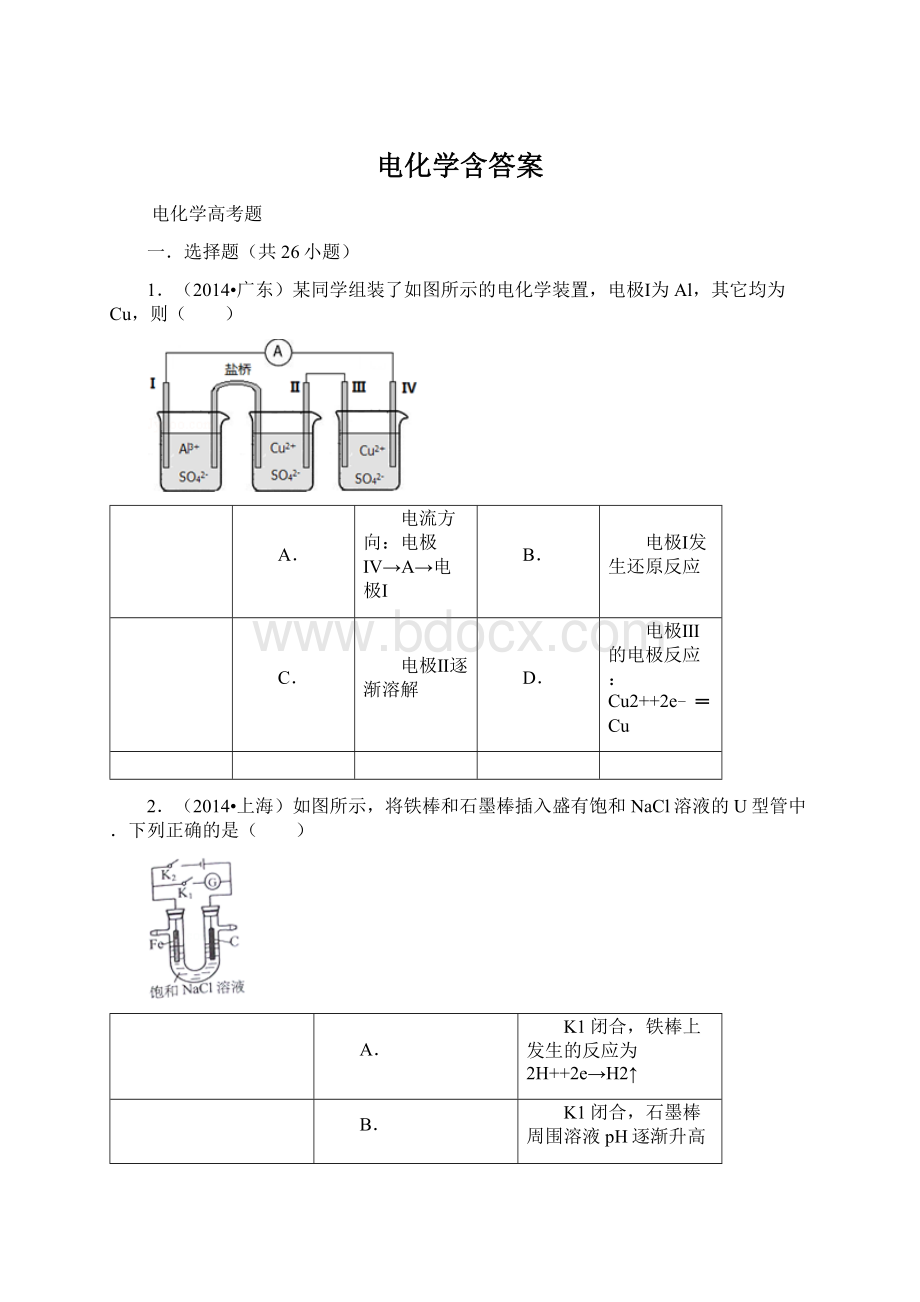
4.(2013•天津)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.反应原理如下:
电池:
Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)
电解池:
2Al+3H2O
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池
电解池
A
H+移向Pb电极
B
每消耗3molPb
生成2molAl2O3
C
正极:
PbO2+4H++2e﹣═Pb2++2H2O
阳极:
2Al+3H2O﹣6e﹣═Al2O3+6H+
D
5.(2013•海南)如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
选项
X
Y
MgSO4
CuSO4
AgNO3
Pb(NO3)2
FeSO4
Al2(SO4)3
6.(2013•北京)下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
水中的钢闸门连接电源的负极
金属护拦表面涂漆
汽车底盘喷涂高分子膜
地下钢管连接镁块
8.(2013•江苏)Mg﹣H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg电极是该电池的正极
H2O2在石墨电极上发生氧化反应
石墨电极附近溶液的pH增大
溶液中Cl﹣向正极移动
9.(2012•安徽)某兴趣小组设计如下微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;
一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是( )
断开K2,闭合K1时,总反应的离子方程式为:
2H++2Cl﹣
Cl2↑+H2↑
断开K2,闭合K1时,石墨电极附近溶液变红
断开K1,闭合K2时,铜电极上的电极反应为:
Cl2+2e﹣=2Cl﹣
断开K1,闭合K2时,石墨电极作正极
10.(2012•福建)将如图所示实验装置的K闭合,下列判断正确的是( )
Cu电极上发生还原反应
电子沿Zn→a→b→Cu路径流动
片刻后甲池中c(SO42﹣)增大
片刻后可观察到滤纸b点变红色
11.(2012•上海)如图装置中发生反应的离子方程式为:
Zn+2H+═Zn2++H2↑,下列说法错误的是( )
a、b不可能是同种材料的电极
该装置可能是电解池,电解质溶液为稀盐酸
该装置可能是原电池,电解质溶液为稀盐酸
该装置可看作是铜﹣锌原电池,电解质溶液是稀硫酸
12.(2012•四川)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:
CH3CH2OH﹣4e﹣+H2O=CH3COOH+4H+.下列有关说法正确的是( )
检测时,电解质溶液中的H+向负极移动
若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
电池反应的化学方程式为:
CH3CH2OH+O2=CH3COOH+H2O
正极上发生的反应为:
O2+4e﹣+2H2O=4OH﹣
13.(2012•山东)下列与金属腐蚀有关的说法正确的是( )
图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
14.(2012•海南)下列叙述错误的是( )
生铁中含有碳,抗腐蚀能力比纯铁弱
用锡焊接的铁质器件,焊接处易生锈
在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
铁管上镶嵌锌块,铁管不易被腐蚀
15.(2011•江西)铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2
电池充电过程中,阴极附近溶液的pH降低
电池充电时,阳极反应为2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O
16.(2011•广东)某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
a和b不连接时,铁片上会有金属铜析出
a和b用导线连接时,铜片上发生的反应为:
Cu2++2e﹣=Cu
无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
17.(2011•福建)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源.该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.关于该电池的下列说法不正确的是( )
水既是氧化剂又是溶剂
放电时正极上有氢气生成
放电时OH﹣向正极移动
总反应为:
2Li+2H2O=2LiOH+H2↑
18.(2011•北京)结合图判断,下列叙述正确的是( )
Ⅰ和Ⅱ中正极均被保护
Ⅰ和Ⅱ中负极反应均是Fe﹣2e﹣=Fe2+
Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e﹣=4OH﹣
Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
19.(2011•上海)用电解法提取氯化铜废液中的铜,方案正确的是( )
用铜片连接电源的正极,另一电极用铂片
用碳棒连接电源的正极,另一电极用铜片
用氢氧化钠溶液吸收阴极产物
用带火星的木条检验阳极产物
20.(2011•海南)根据图,下列判断中正确的是( )
烧杯a中的溶液pH升高
烧杯b中发生氧化反应
烧杯a中发生的反应为2H++2e﹣═H2
烧杯b中发生的反应为2Cl﹣﹣2e﹣═Cl2
21.(2011•安徽)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:
5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
正极反应式:
Ag+Cl﹣﹣e﹣=AgCl
每生成1molNa2Mn5O10转移2mol电子
Na+不断向“水”电池的负极移动
AgCl是还原产物
22.(2011•海南)一种充电电池放电时的电极反应为:
H2+2OH﹣﹣2e﹣=2H2O;
NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣当为电池充电时,与外电源正极连接的电极上发生的反应是( )
H2O的还原
NiO(OH)的还原
H2的氧化
Ni(OH)2的氧化
23.(2010•江西)根据如图可判断下列离子方程式中错误的是( )
2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)
Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)
2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)
2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)
24.(2010•福建)铅蓄电池的工作原理为:
Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是( )
K闭合时,d电极反应式:
PbSO4+2H2O﹣2e﹣═PbO2+4H++SO42﹣
当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2mol
K闭合时,II中SO42﹣向c电极迁移
K闭合一段时间后,II可单独作为原电池,d电极为正极
25.(2010•浙江)Li﹣Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:
2Li++FeS+2e﹣=Li2S+Fe.有关该电池的下列说法中,正确的是( )
Li﹣Al在电池中作为负极材料,该材料中Li的化合价为+1价
该电池的电池反应式为:
2Li+FeS=Li2S+Fe
负极的电极反应式为Al﹣3e﹣=Al3+
充电时,阴极发生的电极反应式为:
Li2S+Fe﹣2e﹣=2Li++FeS
26.(2010•安徽)某固体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构见图,电池总反应可表示为:
2H2+O2═2H2O,下列有关说法正确的是( )
电子通过外电路从b极流向a极
b极上的电极反应式为:
O2+2H2O+4e﹣═4OH﹣
每转移0.1mol电子,消耗1.12L的H2
H+由a极通过固体酸电解质传递到b极
电化学高考题
一.选择题(共26小题)
解答:
解:
电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,
A.电流从正极沿导线流向负极,即电极Ⅳ→A→电极Ⅰ,故A正确;
B.电极Ⅰ上电极反应式为Al﹣3e﹣=Al3+,发生氧化反应,故B错误;
C.电极Ⅱ是正极,正极上发生反应为Cu2++2e﹣=Cu,所以电极Ⅱ质量逐渐增大,故C错误;
D.电极Ⅲ为阳极,电极反应式为Cu﹣2e﹣═Cu2+,故D错误;
故选A.
点评:
本题考查了原电池原理,正确判断正负极是解本题关键,再结合各个电极上发生的反应来分析解答,题目难度中等.
A、若闭合K1,该装置没有外接电源,所以构成了原电池,较活泼的金属铁作负极,负极上铁失电子,Fe﹣2e﹣=Fe2+,故A错误;
B、若闭合K1,该装置没有外接电源,所以构成了原电池;
不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e﹣=4OH﹣,所以石墨棒周围溶液pH逐渐升高,故B正确;
C、K2闭合,Fe与负极相连为阴极,铁棒不会被腐蚀,属于外加电源的阴极保护法,故C错误;
D、K2闭合,电路中通过0.002NA个电子时,阴极生成0.001mol氢气,阳极生成0.001mol氯气,两极共产生0.002mol气体,故D错误.
故选B.
本题考查了原电池原理和电解池原理,能正确判断电池的类型及两极的反应是解本题的关键,题目难度中等.
根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子生成氯离子,其电极反应为:
Cl2+2e﹣═2Cl﹣,故A错误;
B、放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧溶液中有大量白色沉淀生成,故B错误;
C、根据电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;
D、放电时,当电路中转移0.01mole﹣时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,故D正确.
故选:
本题考查了原电池原理的应用及沉淀反应,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.
A.原电池中,溶液中氢离子向正极二氧化铅电极移动,故A错误;
B.串联电池中转移电子数相等,每消耗3molPb,根据电子守恒生成lmolAl2O3,故B错误;
C.原电池正极上二氧化铅得电子生成硫酸铅,故C错误;
D.原电池中铅作负极,负极上铅失电子和硫酸根离子反应生成难溶性的硫酸铅,所以质量增加,在电解池中,Pb阴极,阴极上氢离子得电子生成氢气,所以铅电极质量不变,故D正确;
故选D.
本题考查原电池和电解池原理,根据电极上得失电子、离子放电顺序来分析解答即可,难度中等.
电极b、d均为阴极,在它们上面均没有气体逸出,但质量均增大,且增重b>d,则所电解的盐溶液中金属元素应该在金属活动顺序表中(H)以后,转移相同电子时,b析出金属质量大于d,
A.在金属活动性顺序表中,Mg在H之前,所以电解镁盐溶液时阴极上不能得到金属单质,故A错误;
B.在金属活动性顺序表中,Pb在H之前,所以电解硝酸铅溶液时,阴极上不能得到金属单质,故B错误;
C.在金属活动性顺序表中,Fe、Al都在H之前,电解亚铁盐、铝溶液溶液时阴极上都不能得到金属单质,故C错误;
D.两池中的电极上转移的电子是相等的,设转移2mol电子,b增重64g,d增重216g,所以质量增加b<d,故D正确;
本题考查电解原理,同时考查学生对金属活动性顺序表、电解原理的理解及应用,明确离子放电顺序是解本题关键,题目难度不大.
A.水中的钢闸门连接电源负极,阴极上得电子被保护,所以属于使用外加电流的阴极保护法,故A正确;
B.对健身器材涂油漆使金属和空气、水等物质隔离而防止生锈,没有连接外加电源,故B错误;
C.汽车底盘喷涂高分子膜阻止了铁与空气、水的接触,从而防止金属铁防锈,没有连接外加电源,故C错误;
D.镁的活泼性大于铁,用牺牲镁块的方法来保护船身而防止铁被腐蚀,属于牺牲阳极的阴极保护法,故D错误;
本题考查了金属的腐蚀与防护,解答时要从钢铁生锈的条件方面进行分析、判断,从而找出科学的防锈方法.
7.(2013•上海)糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
脱氧过程是吸热反映,可降低温度,延长糕点保质期
脱氧过程中铁作原电池正极,电极反应为:
Fe﹣3e→Fe3+
脱氧过程中碳做原电池负极,电极反应为:
2H2O+O2+4e→4OH﹣
含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
A.铁粉、氯化钠溶液、炭粉构成原电池,原电池放电过程是放热反应,故A错误;
B.脱氧过程中铁作原电池负极,负极上铁失电子生成亚铁离子,电极反应为:
Fe﹣2e﹣→Fe2+,故B错误;
C.脱氧过程中碳做原电池正极,故C错误;
D.由电子守恒知,消耗氧化剂氧气的体积(标况下)v(O2)=
=336mL,故D正确;
本题考查了原电池原理,明确正负极的判断、正负极上得失电子、物质间的反应来分析解答即可,难度中等.
A、组成的原电池的负极被氧化,镁为负极,而非正极,故A错误;
B、双氧水作为氧化剂,在石墨上被还原变为水和氢氧根离子,发生还原反应,故B错误;
C、双氧水作为氧化剂,在石墨上被还原变为水和氢氧根离子,电极反应为,H2O2+2e﹣=2OH﹣,故溶液pH值增大,故C正确;
D.溶液中Cl﹣移动方向同外电路电子移动方向一致,应向负极方向移动,故D错误;
故选C.
本题考查了原电池原理的分析判断,电极名、称电极反应,是解题关键,题目难度中等.
A、断开K2,闭合K1时,是电解池装置,电解饱和食盐水的总反应的离子方程式为2H2O+2Cl﹣
Cl2↑+H2↑+2OH﹣;
故A错误;
B、断开K2,闭合K1时,是电解池装置,两极均有气泡产生,说明两极产生的气体分别是氢气和氯气,因此活泼金属Cu不能做阳极,Cu做阴极,石墨做阳极,阳极上(石墨电极上)氯离子离子失电子发生氧化反应,阴极上(Cu电极上)氢离子得到电子发生还原反应,依据水的电离平衡,氢氧根离子浓度增大酚酞变红;
故B错误;
C、断开K1,闭合K2时,发现电流表指针偏转,证明是原电池反应,形成氢氯燃料电池,据上述分析可知,Cu电极上产生了氢气,石墨电极上产生了氯气,因此铜做负极发生氧化反应,氢气失电子生成氢离子的反应;
故C错误;
D、断开K1,闭合K2时,发现电流表指针偏转,证明是原电池反应,形成氢氯燃料电池,石墨电极上产生的是氯气,做原电池正极;
故D正确;
本题考查学生原电池和电解质的工作原理,是一道物理电路和化学电池联系的一道综合题目,难度中等.
A,Zn作原电池的负极,Cu作原电池的正极,Cu电极是发生还原反应;
故A正确;
B、电子流向是负极到正极,但a→b这一环节是在溶液中导电,是离子导电,电子并没沿