备战高考化学备考之化学反应的速率与限度压轴突破训练培优 易错 难题篇Word文档格式.docx
《备战高考化学备考之化学反应的速率与限度压轴突破训练培优 易错 难题篇Word文档格式.docx》由会员分享,可在线阅读,更多相关《备战高考化学备考之化学反应的速率与限度压轴突破训练培优 易错 难题篇Word文档格式.docx(31页珍藏版)》请在冰豆网上搜索。
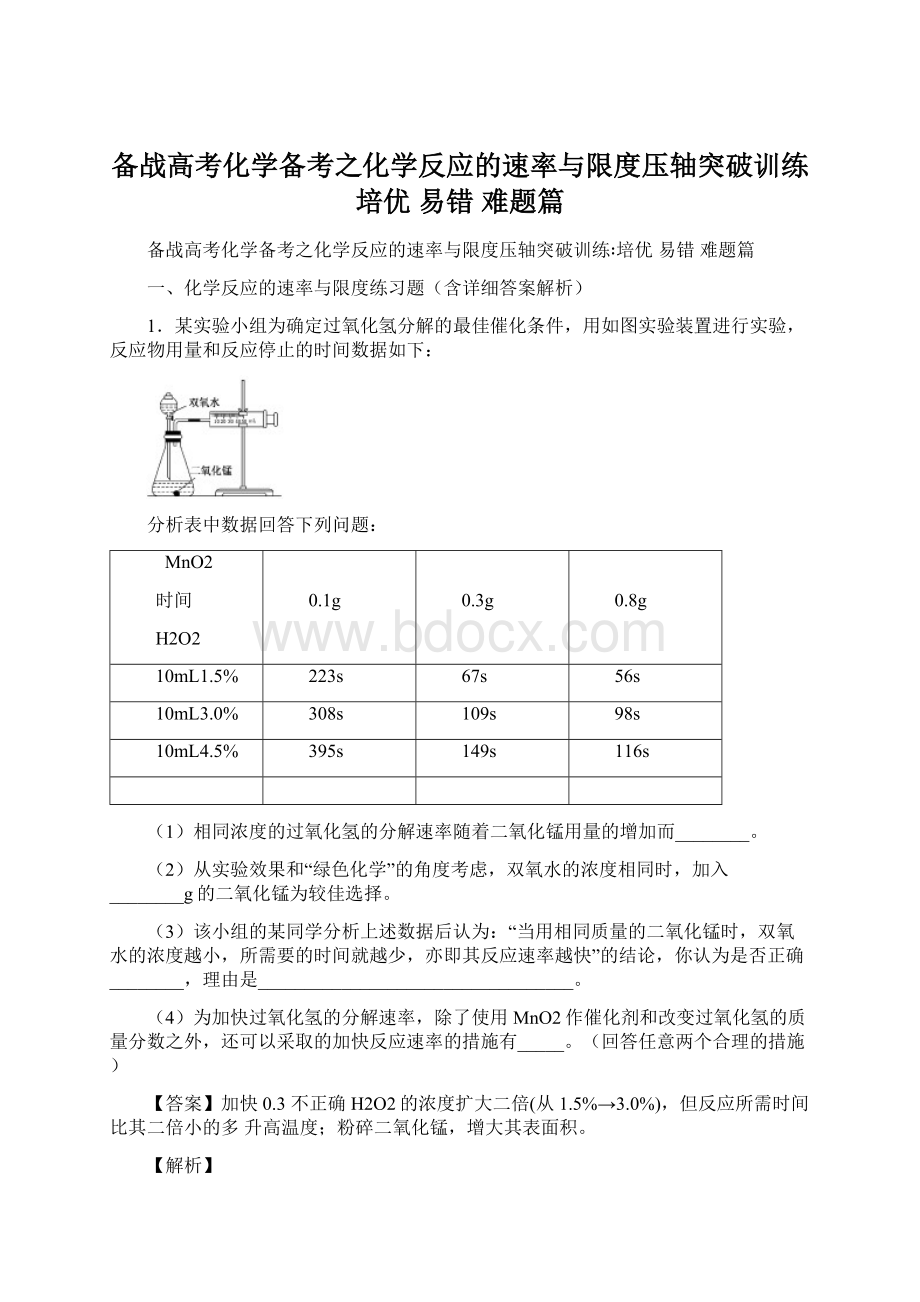
【解析】
【分析】
由题可知,该实验研究浓度和催化剂对反应速率的影响,通过表中数据可分析得出浓度和催化剂对反应速率的影响规律,因为该实验不是直接测出反应速率,而是测出反应停止的时间,要考虑反应物增多对反应时间的影响。
【详解】
(1)由表格中的数据可知:
相同浓度的H2O2,加入的MnO2越多,反应所用的时间越短,即分解速率越快。
(2)用0.1g催化剂的反应速率明显小于用0.3g和0.8g催化剂的反应速率;
用0.8g催化剂和用0.3g催化剂的反应速率及反应时间相差不多,但用0.3g催化剂节约药品。
(3)从表中数据可知,相同体积3.0%的双氧水中的溶质含量是1.5%的双氧水中溶质含量的二倍,但反应的时间却比其反应时间的二倍小得多,由反应速率计算公式可得出,此实验条件下双氧水的浓度越大分解速率越快,由此得出上述结论不正确;
(4)加快反应速率的措施常见的有:
增加反应物浓度、适当升高温度、增加反应物表面积(接触面积)、使用催化剂等。
2.铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。
原料中除铁矿石和焦炭外含有____________。
除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为______________、______________;
高炉排出气体的主要成分有N2、CO2和______________(填化学式)。
(2)已知:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH=+494kJ·
mol-1
②CO(g)+
O2(g)=CO2(g)ΔH=-283kJ·
③C(s)+
O2(g)=CO(g)ΔH=-110kJ·
则反应Fe2O3(s)+3C(s)+
O2(g)=2Fe(s)+3CO2(g)的ΔH=________kJ·
mol-1。
理论上反应________放出的热量足以供给反应__________所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的_____部分,主要反应的化学方程式为_________________________;
熔融造气炉相当于高炉的____部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是________________。
【答案】石灰石CaCO3
CaO+CO2↑CaO+SiO2
CaSiO3CO-355②③①炉身Fe2O3+3CO
2Fe+3CO2炉腹用碱液吸收(氢氧化钠溶液或氨水等)
(1)铁矿石中含有氧化铁和脉石,为除去脉石,可以加入石灰石,石灰石分解为氧化钙,氧化钙和二氧化硅反应生成硅酸钙,方程式为CaCO3
CaO+CO2↑、CaO+SiO2
CaSiO3;
加入焦炭,先生成CO,最后生成CO2所以高炉排出气体的主要成分有N2、CO2和CO;
利用盖斯定律将①+②×
3得到Fe2O3(s)+3C(s)+
O2(g)=2Fe(s)+3CO2(g)的ΔH=-355kJ·
mol-1,因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应;
(3)高炉炼铁时,炉身部分发生Fe2O3+3CO
2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2
2CO以及CaCO3
CaO+CO2↑,CaO+SiO2
CaSiO3反应;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应。
3.光气(COCl2)常作有机合成、农药、药物、燃料及其他化工制品的中间体。
(1)COCl2结构与甲醛相似,写出COCl2电子式_____;
解释COCl2的沸点比甲醛高的原因是_____。
(2)密闭容器中吸热反应COCl2(g)
Cl2(g)+CO(g)达到平衡后,改变一个条件,各物质的浓度变化如图所示(10~14min时有一物质浓度变化未标出)。
①说明该反应已达到平衡状态的是_____。
a.C(COCl2)=C(Cl2)
b.ʋ正(COCl2)=ʋ逆(CO)
c.容器内温度保持不变
d.容器内气体密度保持不变
②4~10min平均反应速率v(COCl2)为_____;
10min时改变的反应条件是_____。
③0~4min、8~10min和16~18min三个平衡常数依次为K1、K2、K3,比较其大小____;
说明理由____。
【答案】
均为分子晶体,COCl2式量较大,范德华力较强,沸点较高bc0.0025mol/(L·
min)分离出COK1<
K2=K34min时改变条件为升温,吸热反应升温K变大
(1)甲醛的结构式是
;
COCl2的相对分子质量大于甲醛;
(2)①根据平衡标志分析;
②根据
计算4~10min平均反应速率v(COCl2);
由图象可知10min时CO的浓度突然减小,后逐渐增大,10min时Cl2的浓度逐渐增大;
③根据图象可知,4min时改变的条件是升高温度、14min时,各物质浓度均减小,改变的条件是减小压强。
,COCl2结构与甲醛相似,COCl2电子式是
甲醛、COCl2均为分子晶体,COCl2式量较大,范德华力较强,沸点较高;
(2)①a.c(COCl2)=c(Cl2)时,浓度不一定不再改变,反应不一定平衡,故不选a;
b.反应达到平衡状态时,正逆反应速率比等于系数比,ʋ正(COCl2)=ʋ逆(CO),一定平衡,故选b;
c.正反应吸热,密闭容器内温度是变量,容器内温度保持不变,反应一定平衡,故选c;
d.气体质量不变、容器体积不变,根据
,密度是恒量,容器内气体密度保持不变,不一定平衡,故不选d;
选bc;
②根据图象,4~10min内COCl2浓度变化是0.055mol/L-0.04mol/L=0.015mol/L,
0.0025mol/(L·
min);
由图象可知10min时CO的浓度突然减小,后逐渐增大,10min时Cl2的浓度逐渐增大,可知10min时改变的条件是分离出CO,平衡正向移动,氯气浓度增大;
③根据图象可知,4min时改变的条件是升高温度,正反应吸热,升高温度平衡正向移动,平衡常数增大,所以K1<
K2,14min时改变的条件是减小压强,平衡常数只与温度有关,所以K2=K3,故K1、K2、K3的大小关系是K1<
K2=K3;
4.某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如表所示:
t/s
50
150
250
350
n(NH3)
0.36
0.48
0.50
0~50s内的平均反应速率v(N2)=__________。
(3)已知:
键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。
H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1molNH3过程中放出46kJ的热量。
则N≡N的键能为_________kJ/mol。
【答案】3X(g)+Y(g)⇌2Z(g)1.8×
10−3mol/(L·
s)946
(1)由图中所给数据看,反应开始前,X、Y的物质的量都为1.0mol,而Z的物质的量为0,所以X、Y为反应物,Z为生成物;
当各物质的量不变时,其物质的量都大于0,表明反应为可逆反应;
再由物质的量的变化量之比等于化学计量数之比,可确定反应的化学计量数关系,从而写出反应方程式。
(2)从表中数据可得出,反应生成n(NH3)=0.36mol,则参加反应的n(N2)=0.18mol,从而求出0~50s内的平均反应速率v(N2)。
(3)利用∆H=E(N≡N)+3E(H-H)-6E(N-H),可求出E(N≡N)。
(1)由图中所给数据可得出,X、Y、Z的变化量分别为0.3mol、0.1mol、0.2mol,从而得出三者的物质的量之比为3:
1:
2,结合上面分析,可得出该反应的化学方程式为3X(g)+Y(g)⇌2Z(g)。
答案为:
3X(g)+Y(g)⇌2Z(g);
(2)从表中数据可得出,反应生成n(NH3)=0.36mol,则参加反应的n(N2)=0.18mol,从而得出0~50s内的平均反应速率v(N2)=
=1.8×
s)。
1.8×
s);
(3)利用∆H=E(N≡N)+3E(H-H)-6E(N-H),可求出E(N≡N)=∆H-3E(H-H)+6E(N-H)=-46×
2kJ/mol-3×
436kJ/mol+6×
391kJ/mol=946kJ/mol。
946。
【点睛】
由图中数据确定反应方程式时,对于方程式中的每个关键点,都需认真求证,不能随意表示,否则易产生错误。
如我们在书写方程式时,很容易将反应物与生成物之间用“==”表示。
5.某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min
1
2
3
4
5
氢气体积/mL
120
232
290
310
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水B.NaCl溶液C.Na2CO3溶液D.CuSO4溶液
【答案】2~3min该反应是放热反应,2~3min时间段内温度较高4~5min4~5min时间段内H+浓度较低0.1mol·
L-1·
min-1AB
根据表格数据可得:
“0~1min”产生氢气的量为50mL,“1~2min”产生氢气的量为120mL-50mL=70mL,“2~3min”产生氢气的量为232mL-120mL=112mL,“4~5min”产生的氢气的量为310mL-290mL=20mL,再根据公式
分析解答问题。
(1)反应速率最大,则单位时间内产生的氢气最多,“2~3min”产生氢气的量为232mL-120mL=112mL,又因该反应是放热反应,此时间段内温度较高,故答案为:
2~3min;
该反应是放热反应,2~3min时间段内温度较高;
(2)速率最小,即单位内产生的氢气最少,4~5min共产生20mL氢气,主要原因是随着反应的进行,此时间段内H+浓度较低,故答案为:
4~5min;
4~5min时间段内H+浓度较低;
(3)根据公式
,“2~3min”产生氢气的量为232mL-120mL=112mL,则
,根据方程式:
Zn+2HCl===ZnCl2+H2↑可知,消耗
的物质的量n(HCl)=2n(H2)=0.01mol,然后再根据
可求得盐酸的反应速率
,故答案为0.1mol·
min-1;
(4)加入蒸馏水和NaCl溶液相当于降低盐酸浓度,反应速率减小,加入Na2CO3溶液,会消耗盐酸,则会减少生成氢气的量,CuSO4溶液会消耗锌,会减少生成氢气的量,且反应放热会增大反应速率,故答案选AB。
6.制造一次性医用口罩的原料之一丙烯是三大合成材料的基本原料,丙烷脱氢作为一条增产丙烯的非化石燃料路线具有极其重要的现实意义。
丙烷脱氢技术主要分为直接脱氢和氧化脱氢两种。
(1)根据下表提供的数据,计算丙烷直接脱氢制丙烯的反应C3H8(g)
C3H6(g)+H2(g)的∆H=___。
共价键
C-C
C=C
C-H
H-H
键能/(kJ∙mol-1)
348
615
413
436
(2)下图为丙烷直接脱氢制丙烯反应中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中压强分别为1×
104Pa和1×
105Pa)
①在恒容密闭容器中,下列情况能说明该反应达到平衡状态的是__(填字母)。
A.∆H保持不变
B.混合气体的密度保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内生成1molH-H键,同时生成1molC=C键
②欲使丙烯的平衡产率提高,下列措施可行的是____(填字母)
A.增大压强B.升高温度C.保持容积不变充入氩气
工业生产中为提高丙烯的产率,还常在恒压时向原料气中掺入水蒸气,其目的是_____。
③1×
104Pa时,图中表示丙烷和丙烯体积分数的曲线分别是___、____(填标号)
④1×
104Pa、500℃时,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度计算,分压=总压×
物质的量分数,计算结果保留两位有效数字)
(3)利用CO2的弱氧化性,科学家开发了丙烷氧化脱氢制丙烯的新工艺,该工艺可采用铬的氧化物作催化剂,已知C3H8+CO2(g)
C3H6(g)+CO(g)+H2O(l),该工艺可以有效消除催化剂表面的积炭,维持催化剂的活性,其原因是____,相对于丙烷直接裂解脱氢制丙烯的缺点是_____。
【答案】+123kJ∙mol-1CB该反应是气体分子数增多的反应,恒压条件下充入水蒸气容器体积增大,平衡右移ⅳⅰ3.3×
103C与CO2反应生成CO,脱离催化剂表面生成有毒气体CO(或其他合理说法)
(1)比较丙烷与丙烯的结构,可确定断裂2个C-H键和1个C-C键,形成1个C=C键和1个H-H键,利用表中键能可计算C3H8(g)
C3H6(g)+H2(g)的∆H。
(2)①A.对于一个化学反应,方程式确定后,∆H确定,与反应进行的程度无关;
B.混合气体的质量和体积都不变,密度始终不变;
C.混合气体的质量不变,物质的量增大,平均摩尔质量不断减小;
D.反应发生后,总是存在单位时间内生成1molH-H键,同时生成1molC=C键。
②A.增大压强,平衡逆向移动;
B.升高温度,平衡正向移动;
C.保持容积不变充入氩气,平衡不受影响。
工业生产中为提高丙烯的产率,还常在恒压时向原料气中掺入水蒸气,可增大混合气的体积,减小与反应有关气体的浓度。
104Pa与1×
105Pa进行对比,从平衡移动的方向确定图中表示丙烷和丙烯体积分数的曲线。
104Pa、500℃时,丙烷、丙烯、氢气的体积分数都为33.3%,由此可计算该反应的平衡常数Kp。
(3)CO2具有氧化性,能与催化剂表面的积炭发生反应生成一氧化碳气体,由此可确定原因及缺点。
C3H6(g)+H2(g)的∆H=(2×
413+348)kJ∙mol-1-(615+436)kJ∙mol-1=+123kJ∙mol-1。
+123kJ∙mol-1;
(2)①A.对于一个化学反应,方程式确定后,∆H确定,与反应进行的程度无关,A不合题意;
B.混合气体的质量和体积都不变,密度始终不变,所以密度不变时不一定达平衡状态,B不合题意;
C.混合气体的质量不变,物质的量增大,平均摩尔质量不断减小,当平均摩尔质量不变时,反应达平衡状态,C符合题意;
D.反应发生后,总是存在单位时间内生成1molH-H键,同时生成1molC=C键,反应不一定达平衡状态,D不合题意;
故选C。
C;
②A.增大压强,平衡逆向移动,丙烯的平衡产率减小,A不合题意;
B.升高温度,平衡正向移动,丙烯的平衡产率增大,B符合题意;
C.保持容积不变充入氩气,平衡不受影响,C不合题意;
故选B。
B;
工业生产中为提高丙烯的产率,还常在恒压时向原料气中掺入水蒸气,可增大混合气的体积,减小与反应有关气体的浓度,其目的是该反应为气体分子数增多的反应,恒压条件下充入水蒸气容器体积增大,平衡右移。
该反应是气体分子数增多的反应,恒压条件下充入水蒸气容器体积增大,平衡右移;
③升高温度,平衡正向移动,丙烷的体积分数减小,丙烯的体积分数增大,则ⅰ、ⅲ为丙烷的曲线,ⅱ、ⅳ为丙烯的曲线,1×
105Pa相比,压强减小,平衡正向移动,从而得出表示丙烷体积分数的曲线为ⅳ,表示丙烯体积分数的曲线为ⅰ。
ⅳ;
ⅰ;
104Pa、500℃时,丙烷、丙烯、氢气的体积分数都为33.3%,由此可计算该反应的平衡常数Kp=
=3.3×
103。
答案:
3.3×
103;
(3)CO2具有氧化性,能与催化剂表面的积炭发生反应生成一氧化碳气体,其原因是C与CO2反应生成CO,脱离催化剂表面;
相对于丙烷直接裂解脱氢制丙烯的缺点是生成有毒气体CO(或其他合理说法)。
C与CO2反应生成CO,脱离催化剂表面;
生成有毒气体CO(或其他合理说法)。
利用键能计算反应热时,比较反应物与生成物的结构式,确定键的断裂与形成是解题的关键。
丙烷的结构式为
,丙烯的结构式为
,H2的结构式为H-H,由此可确定断键与成键的种类及数目。
7.Ⅰ.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
ΔH=+88.6kJ/mol,则M、N相比,较稳定的是______。
(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式为___________。
Ⅱ.无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。
N2O4与NO2转换的热化学方程式为N2O4(g)
2NO2(g) ΔH=+24.4kJ/mol。
(3)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是_________。
A.v正(N2O4)=2v逆(NO2)B.体系颜色不变
C.气体平均相对分子质量不变D.气体密度不变
达到平衡后,升高温度,再次到达新平衡时,混合气体颜色_____(填“变深”、“变浅”或“不变”)。
Ⅲ.(4)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;
pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则
=________。
(5)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合。
若所得混合溶液呈中性,则a∶b=________。
(6)已知常温下HCN的电离平衡常数K=5.0×
10-10。
将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中c(H+)、c(OH-)、c(CN-)、c(Na+)大小顺序为________________。
【答案】M2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)ΔH=-290kJ/molBC变深
1:
100c(Na+)>
c(CN-)>
c(OH-)>
c(H+)
Ⅰ.
(1)M转化为N是吸热反应,能量低的物质更稳定;
(2)有1molCl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,结合物质聚集状态和对应反应焓变书写热化学方程式;
Ⅱ.(3)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
正反应是吸热反应,其他条件不变,温度升高平衡正向移动,NO2的浓度增大;
Ⅲ.(4)酸抑制水电离,含有弱根离子的盐促进水电离;
(5)混合溶液呈中性,则酸碱恰好完全中和,即酸中c(H+)等于碱中c(OH﹣);
(6)CN﹣的水解平衡常数Kh=
=2×
10﹣5>Ka,说明相同浓度的NaCN和HCN,NaCN水解程度大于HCN电离程度。
Ⅰ.
(1)有机物M经过太阳光光照可转化成N,△H=+88.6kJ•mol﹣1,为吸热反应,可知M的能量低,能量越低越稳定,说明M稳定;
(2)有1molCl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=﹣290kJ•mol﹣1;
Ⅱ.(3)A.应是2v正(N2O4)=v逆(NO2)时反应达到平衡状态,故A错误;
B.体系颜色不变,说明二氧化氮浓度不变,反应到达平衡状态,故B正确;
C.混合气体总质量不变,随反应减小混合气体总物质的量增大,平均相对分子质量减小,当气体平均相对分子质量不变时,反应到达平衡状态,故C正确;
D.混合气体的总质量不变,容器的容积不变,气体密度始终不变,故D错误,
故答案为:
BC;
正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增加,颜色加深;
Ⅲ.(4)常温下,设pH=5的H2SO4的溶液中由水电离出的H+浓度C