届高考化学一轮复习强化酸碱中和滴定及其拓展应用解析版Word格式文档下载.docx
《届高考化学一轮复习强化酸碱中和滴定及其拓展应用解析版Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《届高考化学一轮复习强化酸碱中和滴定及其拓展应用解析版Word格式文档下载.docx(10页珍藏版)》请在冰豆网上搜索。
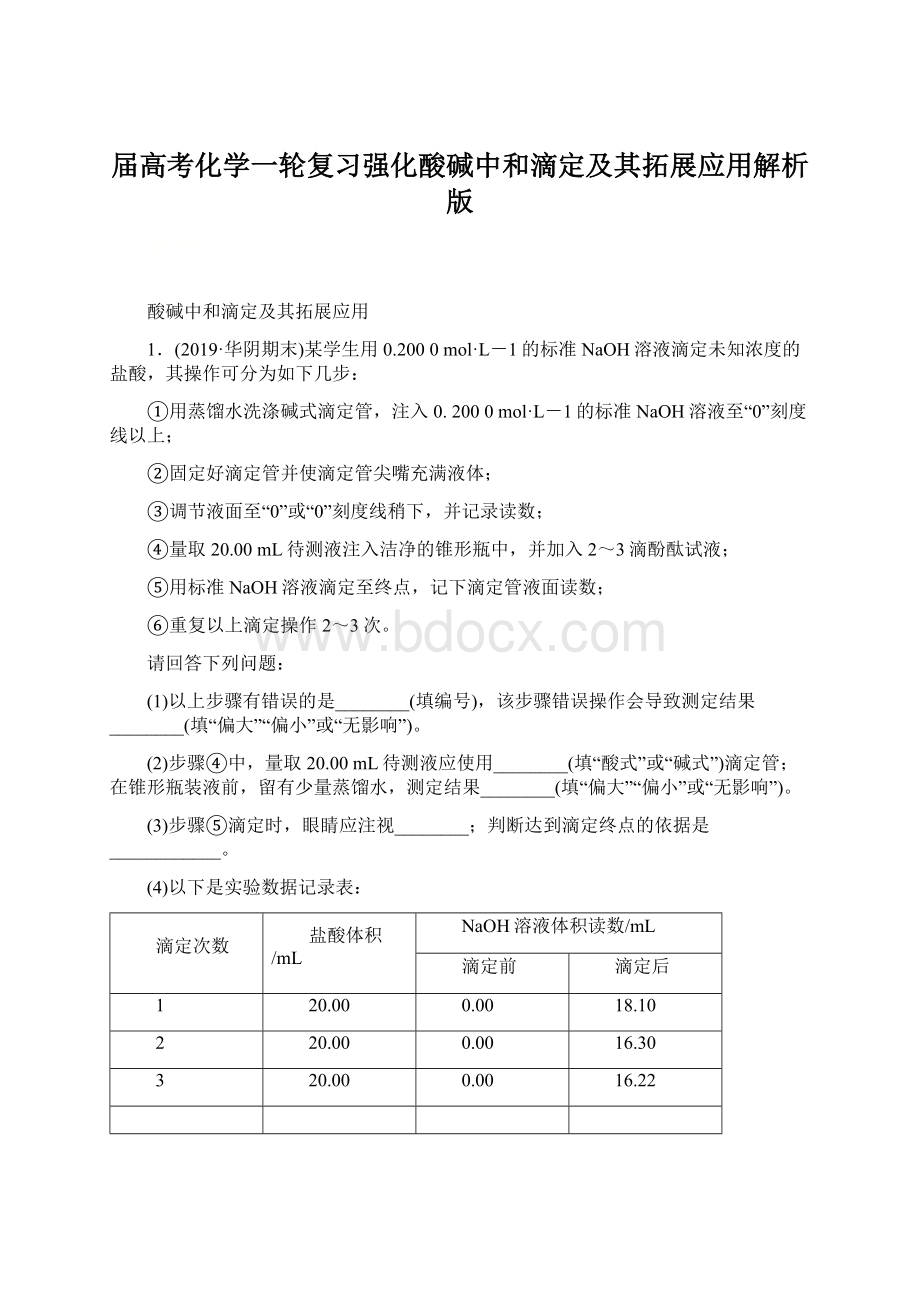
18.10
2
16.30
3
16.22
从上表可以看出,第1次滴定记录的NaOH溶液体积明显大于后两次的体积,其可能的原因是________(填字母)。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,待测盐酸的物质的量浓度为________mol·
L-1。
解析:
(1)用蒸馏水洗涤盛装0.2000mol·
L-1标准NaOH溶液的碱式滴定管后,要先用标准NaOH溶液润洗2~3次,再装入标准NaOH溶液。
若用蒸馏水洗涤后,直接装入标准NaOH溶液,则c(NaOH)偏小,滴定过程中消耗标准NaOH溶液的体积偏大,使测得的c(HCl)偏大。
(2)待测液是未知浓度的盐酸,故量取20.00mL待测液要选用酸式滴定管。
在锥形瓶装液前,留有少量蒸馏水,消耗标准NaOH溶液的体积不变,故对测定结果无影响。
(3)步骤⑤滴定时,眼睛应注视锥形瓶中溶液颜色变化。
向盐酸中滴加2~3滴酚酞,溶液呈无色,达到滴定终点时,溶液由无色变为浅红色,且半分钟内不褪色。
(4)滴定前滴定管尖嘴有气泡,滴定结束无气泡,由于原来气泡占据的空间被标准NaOH溶液充满,则消耗标准NaOH溶液的体积偏大,A符合题意;
锥形瓶用待测液润洗,则锥形瓶内待测液中n(HCl)偏大,滴定时消耗标准NaOH溶液的体积偏大,B符合题意;
滴定结束时,俯视读数,读取消耗标准NaOH溶液的体积偏小,C不符合题意。
(5)第1次实验数据存在明显误差,舍去,根据第2、3次数据可知,消耗标准NaOH溶液的平均体积为16.26mL,根据滴定过程中c(HCl)·
V(HCl)=c(NaOH)·
V(NaOH),则有c(HCl)×
20.00×
10-3L=0.2000mol·
L-1×
16.26×
10-3L,解得c(HCl)=0.1626mol·
答案:
(1)① 偏大
(2)酸式 无影响 (3)锥形瓶中溶液颜色变化 锥形瓶中溶液由无色变为浅红色,且半分钟内不褪色 (4)AB (5)0.1626
2.(组合题)
(1)(2020·
湖北调研)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为2Ba2++Cr2O
+H2O===2BaCrO4↓+2H+、4NH
+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:
称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O
完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200mol·
L-1NaOH标准溶液滴定至终点。
重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积________(填“偏大”“偏小”或“无影响”);
滴定时边滴边摇动锥形瓶,眼睛应观察________。
②滴定结果如下表所示:
待测溶液的体积/mL
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
25.00
1.07
21.06
0.88
20.89
0.20
21.20
4
0.66
20.66
该样品中氮元素的质量分数为________。
(2)测定POCl3含量。
用PCl3氧化法制备的POCl3中常含有PCl3杂质。
已知:
PCl3遇水生成H3PO3和HCl,POCl3遇水生成H3PO4和HCl。
Ⅰ.准确称取1.455g制得的POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
Ⅱ.将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
Ⅲ.加入10.00mL0.3200mol·
L-1AgNO3溶液,使氯离子完全沉淀;
向其中加入少许硝基苯用力摇动;
Ⅳ.以Fe3+为指示剂,用0.0200mol·
L-1KSCN标准溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
Ag++SCN-===AgSCN↓;
Ksp(AgCl)>
Ksp(AgSCN)。
①滴定终点的现象为____________。
②实验过程中加入硝基苯的目的是______________;
若无此操作,则所测POCl3含量将会____________(填“偏大”“偏小”或“不变”)。
③产品中POCl3的百分含量为________________(保留三位有效数字)。
(3)CuSO4·
5H2O的含量通常利用“间接碘量法”测定,步骤如下:
①称取1.250g产品配成100mL溶液。
②取其中25.00mL溶液,加入足量的NaF溶液后,滴加KI溶液至不再产生沉淀。
③用0.1000mol·
L-1Na2S2O3标准溶液滴定,平行滴定3次。
已知Cu2+与F-不反应,Fe3+与F-反应生成FeF
,氧化性I2>
FeF
;
I2+2Na2S2O3===2NaI+Na2S4O6。
步骤②中,若不加足量的NaF溶液,最终的测量值将________(填“偏大”“偏小”或“无影响”)。
滴加KI溶液,有白色碘化物沉淀生成,反应的离子方程式为__________________;
若Na2S2O3标准溶液的平均用量为10.00mL,则胆矾产品纯度为________%。
(1)4次滴定消耗氢氧化钠溶液体积依次为19.99mL、20.01mL、21.00mL、20.00mL,第3次测定误差较大,舍去,取剩下3次滴定的平均值得消耗氢氧化钠溶液体积为20.00mL。
由题给关系可知(NH4)2Cr2O7~4OH-,则w(N)=
×
100%=10.00%。
(2)①滴加KSCN标准溶液,先生成AgSCN沉淀,达到滴定终点时,溶液变为红色,且半分钟不褪色。
②根据题给信息,加入硝基苯可覆盖AgCl沉淀,避免AgCl与KSCN标准溶液反应,若无此操作,则KSCN标准溶液用量偏多,测得的Ag+浓度偏大,从而使所测POCl3含量偏小。
③Ⅰ~Ⅲ涉及的反应有PCl3+3H2O===H3PO3+3HCl,POCl3+3H2O===H3PO4+3HCl,HCl+AgNO3===AgCl↓+HNO3,此过程消耗AgNO3的物质的量为0.01L×
0.3200mol·
L-1-0.01L×
0.0200mol·
L-1=0.003mol,由关系式PCl3~3HCl~3AgNO3及POCl3~3HCl~3AgNO3可知,10.00mL溶液中n(PCl3)+n(POCl3)=0.001mol,则产品中n(PCl3)+n(POCl3)=0.001×
mol=0.01mol,设POCl3的物质的量为xmol,(153.5×
x)g+[137.5×
(0.01-x)]g=1.455g,则x=0.005mol,故产品的纯度为
100%≈52.7%。
(3)结合题中信息可知Cu2+与I-发生氧化还原反应的离子方程式为2Cu2++4I-===2CuI↓+I2,若步骤②中不加入足量的NaF溶液,Fe3+也消耗I-,导致最终测量值将偏大。
根据关系式2Cu2+~I2~2Na2S2O3,可得c(Cu2+)=0.0400mol·
L-1,则胆矾产品纯度=
100%=80.00%。
(1)①偏大 锥形瓶内溶液颜色的变化
②10.00%
(2)①当滴入最后一滴KSCN标准溶液时,溶液变为红色,且半分钟不褪色
②使生成的AgCl沉淀与溶液隔离,避免滴定过程中SCN-与AgCl反应 偏小
③52.7%
(3)偏大 2Cu2++4I-===2CuI↓+I2 80.00
3.实验室常用准确称量的邻苯二甲酸氢钾(OOKOHO,溶液呈弱酸性)来测定配制的NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。
某学生将配好的待测NaOH溶液放于锥形瓶中,用该溶液标定,进行了四次实验,数据如下表。
实验编号
消耗标准液V
18.60
17.10
16.90
17.00
下列说法正确的是( )
A.实验中最好选择酚酞作指示剂
B.滴定过程中消耗的V(邻苯二甲酸氢钾)平均
=17.40mL
C.配制邻苯二甲酸氢钾溶液时,容量瓶洗净后未经干燥处理,会使最终标定结果偏高
D.锥形瓶在装液前未用待测NaOH溶液润洗会使标定结果偏低
选A A项,邻苯二甲酸为弱酸,滴定终点时生成强碱弱酸盐,溶液呈碱性,所以选用酚酞作指示剂,正确;
B项,第1组数据为18.60mL,与其他三组相差较大,应该舍弃,则滴定过程中消耗的V(邻苯二甲酸氢钾)=
=17.00mL,错误;
C项,配制邻苯二甲酸氢钾溶液时,容量瓶洗净后未经干燥处理,该操作方法不影响配制结果,错误;
D项;
中和滴定过程中,盛放待测液的锥形瓶不能润洗,否则影响滴定结果,错误。
4.(2020·
山东邹平期末)关于滴定实验的下列说法正确的是( )
A.在酸碱中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化
B.用NaOH标准溶液滴定未知浓度的盐酸,达到滴定终点时发现滴定管尖嘴部分有悬滴,会使测定结果偏小
C.用KMnO4标准溶液滴定草酸时,KMnO4标准溶液盛装在碱式滴定管中
D.所有的滴定实验都需要加入指示剂
选A 酸碱中和滴定过程中,左手控制活塞,右手轻轻摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,A正确;
用NaOH标准溶液滴定未知浓度的盐酸,达到滴定终点时发现滴定管尖嘴部分有悬滴,则消耗NaOH标准溶液的体积偏大,测定结果偏大,B错误;
KMnO4溶液具有强氧化性,易腐蚀橡胶管,KMnO4标准溶液要盛放在酸式滴定管中,C错误;
并不是所有的滴定实验都需要加入指示剂,如用KMnO4标准溶液滴定含还原性物质(如草酸等)的溶液时,不需要加指示剂,达到滴定终点时,溶液由无色变为浅红色,且半分钟内不褪色,D错误。
5.
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图Ⅱ表示50mL滴定管中液面的位置,D与E刻度间相差1mL。
如果刻度A和D都是10,则两处液面的读数是( )
A.Ⅰ中是9.2mL,Ⅱ中是9.40mL
B.Ⅰ中是10.8mL,Ⅱ中是9.40mL
C.Ⅰ中是10.8mL,Ⅱ中是10.60mL
D.Ⅰ中是9.2mL,Ⅱ中是10.60mL
选D 由图可知,Ⅰ中为量筒,小刻度在下方,A与B、B与C刻度间相差1mL,刻度A是10,则读数为9.2mL;
Ⅱ表示50mL滴定管,小刻度在上方,D与E刻度间相差1mL,刻度D是10,则读数为10.60mL。
6.实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列对测定结果评价错误的是( )
选项
操作
测定结果评价
A
酸式滴定管在装液前未用标准盐酸润洗2~3次
偏高
B
开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C
锥形瓶未干燥
无影响
D
盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
偏低
选D A项,酸式滴定管在装液前未用标准盐酸润洗2~3次,导致标准液被稀释,滴定时消耗标准液体积偏大,测定结果偏高,正确;
B项,开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失,导致消耗标准液体积偏大,测定结果偏高,正确;
C项,锥形瓶未干燥,对待测液没有影响,则不影响测定结果,正确;
D项,盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次,导致待测液中NaOH的物质的量偏大,滴定时消耗标准液体积偏大,测定结果偏高,错误。
7.下列关于酸碱中和滴定实验的说法正确的是( )
A.用图B的滴定管可准确量取25.00mL的酸性KMnO4溶液
B.滴定过程中,眼睛要时刻注视滴定管中液面的变化
C.滴定管装入液体前不需用待装液润洗
D.滴定前平视,滴定结束后仰视读数,会使测定结果偏大
选D A项,酸性高锰酸钾溶液具有酸性和强氧化性,应该选用酸式滴定管(A)盛放,B为碱式滴定管,错误;
B项,滴定过程中,眼睛要时刻注视锥形瓶中溶液颜色的变化,错误;
C项,为了避免待装液被稀释,滴定管装入液体前必须需用待装液润洗,错误;
D项,滴定前平视,滴定结束后仰视读数,读出的标准液体积偏大,会使测定结果偏大,正确。
8.下列有关滴定的说法正确的是( )
A.用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B.用标准KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则测定结果偏低
C.用c1mol·
L-1酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高锰酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为
mol·
L-1
D.用未知浓度的盐酸滴定已知浓度的NaOH溶液,若读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
选B 滴定管的精确度为0.01mL,读数时应精确到小数点后两位,故A错误;
KOH的摩尔质量大于NaOH的摩尔质量,若配制标准溶液的固体KOH中有NaOH杂质,使配制的溶液中c(OH-)偏高,滴定未知浓度的盐酸时,消耗标准溶液的体积偏小,使测得的盐酸浓度偏低,故B正确;
酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液,反应的离子方程式为2MnO
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,n(KMnO4)∶n(H2C2O4)=2∶5,则测得H2C2O4溶液的浓度为
L-1,故C错误;
用未知浓度的盐酸滴定已知浓度的NaOH溶液,若读数时,滴定前仰视,滴定到终点后俯视,则读取的盐酸体积偏小,导致测定结果偏高,故D错误。
9.已知Ag2CrO4是砖红色沉淀,下列滴定反应中,指示剂使用不正确的是( )
A.用标准FeCl3溶液滴定KI溶液,选择KSCN溶液
B.用I2溶液滴定Na2SO3溶液,淀粉作指示剂
C.用AgNO3溶液滴定NaCl溶液,Na2CrO4作指示剂
D.用H2O2溶液滴定KI溶液,淀粉作指示剂
选D 铁离子与碘离子反应,生成亚铁离子和碘单质,KSCN溶液遇铁离子显红色,当溶液显红色时,说明碘离子完全反应,达到滴定终点,故A正确;
淀粉遇碘单质显蓝色,当溶液显蓝色时,说明亚硫酸根离子已经被碘单质充分氧化,碘单质剩余,达到滴定终点,故B正确;
Ag2CrO4是砖红色沉淀,当溶液中有砖红色沉淀时,待测液中的氯离子被充分沉淀,银离子剩余,故C正确;
待测液中的碘离子被双氧水氧化生成碘单质,淀粉显蓝色,即开始滴定就出现蓝色,蓝色加深,碘离子完全反应时,蓝色不再加深,但是不易观察,不能判断滴定终点,故D错误。
10.
H2S2O3是一种弱酸,实验室欲用0.01mol·
L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法合理的是( )
A.该滴定可用甲基橙作指示剂
B.Na2S2O3是该反应的还原剂
C.该滴定可选用如图所示装置
D.该反应中每消耗2molNa2S2O3,电子转移数为4NA
选B 溶液中有单质碘,应加入淀粉溶液作指示剂,碘与硫代硫酸钠发生氧化还原反应,当反应达到终点时,单质碘消失,蓝色褪去,故A错误;
Na2S2O3中S元素化合价升高被氧化,作还原剂,故B正确;
Na2S2O3溶液显碱性,应该用碱式滴定管,故C错误;
反应中每消耗2molNa2S2O3,电子转移数为2NA,故D错误。
11.
用0.100mol·
L-1酸性高锰酸钾溶液滴定25.00mL某未知浓度的草酸(H2C2O4)溶液,滴定曲线如图所示,其中E为电动势,反映溶液中c(MnO
)的变化。
下列有关叙述错误的是( )
A.酸性高锰酸钾溶液应盛放在酸式滴定管中
B.滴定过程中不需要使用指示剂
C.滴定结束后俯视读数,会导致所测草酸溶液的浓度偏低
D.若草酸溶液的浓度为0.200mol·
L-1,则a点的c(Mn2+)=0.100mol·
选D 酸性高锰酸钾溶液显酸性,且有强氧化性,应盛放在酸式滴定管中,A正确;
酸性高锰酸钾溶液本身有颜色,当达到滴定终点时溶液由无色变为浅紫色,且半分钟内不褪色,故不需要使用指示剂,B正确;
俯视读数,会导致所读标准溶液体积偏低,则待测液浓度也偏低,C正确;
根据滴定曲线可知,a点为滴定终点,根据反应的离子方程式2MnO
+6H++5H2C2O4===2Mn2++10CO2↑+8H2O可计算出此时消耗酸性高锰酸钾溶液的体积为20.00mL,若不考虑混合前后溶液体积的变化,c(Mn2+)=
≈0.044mol·
L-1,D错误。
12.某学习小组用“间接碘量法”测定某CuCl2晶体试样的纯度,试样不含其他能与I-发生反应的氧化性杂质,已知:
2Cu2++4I-===2CuI↓+I2,I2+2S2O
===S4O
+2I-。
取mg试样溶于水,加入过量KI固体,充分反应,用0.1000mol·
L-1Na2S2O3标准溶液滴定,部分实验仪器和读数如图所示。
A.试样在甲中溶解,滴定管选乙
B.选用淀粉作指示剂,当甲中溶液由蓝色变为无色时,即达到滴定终点
C.丁图中滴定前,滴定管的读数为a-0.50mL
D.对装有标准液的滴定管读数时,滴定前后读数方式如丁图所示,则测得的结果偏小
选D A项,甲中盛装的是含有I2的溶液,则滴定管中盛装的为Na2S2O3标准溶液,该溶液显碱性,应选用碱式滴定管(丙),不正确;
B项,溶液变色且经过半分钟左右溶液不恢复原来颜色,视为滴定终点,不正确;
C项,滴定管“0”刻度在上端,故滴定前的读数为(a+0.50)mL,不正确;
D项,滴定后俯视读数,将导致读数偏小,故测得的结果偏小,正确。