北京市重点高中届高三化学上学期期末专题汇编物质结构与元素周期律氧化还原反应Word文件下载.docx
《北京市重点高中届高三化学上学期期末专题汇编物质结构与元素周期律氧化还原反应Word文件下载.docx》由会员分享,可在线阅读,更多相关《北京市重点高中届高三化学上学期期末专题汇编物质结构与元素周期律氧化还原反应Word文件下载.docx(16页珍藏版)》请在冰豆网上搜索。
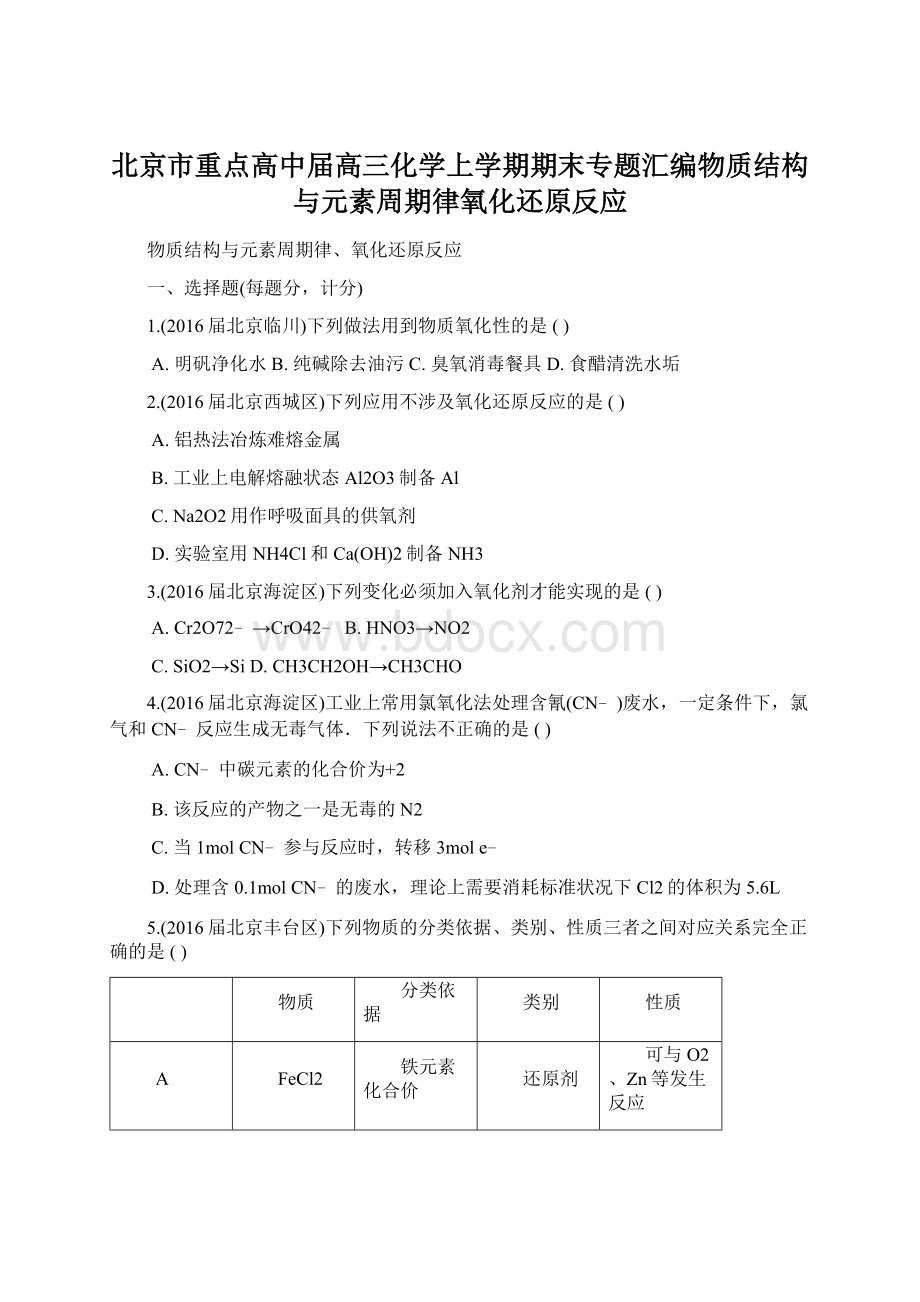
可与O2、Zn等发生反应
B
电离产生的微粒
盐
可发生水解反应,溶液显碱性
C
HNO3
在水中能电离出H+
酸
可与CuO反应生成NO
D
氮元素的化合价
氧化剂
可与Al、I﹣等发生反应
A.AB.BC.CD.D
6.(2016届北京朝阳)下列推测或结论不合理的是()
A.X2﹣和Y+核外电子层结构相同,原子序数:
X<Y
B.气态氢化物的稳定性HCl>HBr,还原性:
Cl﹣>Br﹣
C.硅、锗都位于金属与非金属的交界处,用途:
都可以做半导体材料
D.铷(37Rb)和锶(38Sr)分别位于第五周期IA和IIA族,碱性:
RbOH>Sr(OH)2
7.(2016届北京丰台区)依据元素周期表及元素周期律,下列推断正确的是()
A.碱性:
Ca(OH)2>Mg(OH)2B.酸性:
H3BO3>H2CO3
C.热稳定性:
NH3<PH3D.还原性:
S2﹣<F﹣
8.(2016届北京临川)部分短周期元素化合价与原子序数的关系可用如图表示,下列说法正确的是()
A.原子半径:
Z>Y>X
B.X和Z形成的化合物能溶于NaOH溶液
C.Q和X形成的化合物不能与酸反应
D.R元素的含氧酸和W元素的含氧酸,酸性一定前者强
9.(2016届北京西城区)已知34Se、35Br位于同一周期,根据元素在周期表中的位置,判断下列说法正确的是()
A.离子还原性:
B.气态氢化物的稳定性:
H2S>H2Se
C.原子半径:
Cl>Br>Se
D.酸性:
H2SeO4>HBrO4>HClO4
二、解答题(每题分,计分)
10.(2016届北京东城)X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号
X
Y
Z
M
Q
R
原子半径/nm
0.160
0.143
0.102
0.089
0.074
0.037
主要化合价
+2
+3
+6,﹣2
﹣2
+1
(1)Z在元素周期表中的位置是 .
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是 (填离子符号).
(3)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是 .
(4)Q和R按原子个数比1:
1组成的化合物甲,是一种“绿色”氧化剂.
①甲中所含共价键类型是 .
②空气阴极法电解制备甲的装置如图所示.在碱性溶液中,利用
空气中的氧气还原得到甲和稀碱的溶液.图中直流电源的a是 极,阴极的电极反应式是 .
11.(2016届北京临川)X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;
Q与X同主族;
Z、R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) .
(2)由以上某些元素组成的化合物A.B.C.D有如下转化关系:
B(在水溶液中进行)其中,C是溶于水显酸性的气体;
D是淡黄色固体.写出C的结构式:
;
D的电子式:
.
①如果A.B均由三种元素组成,B为两性不溶物,则A的化学式为 ;
由A转化为B的离子方程式为 .
②如果A由三种元素组成,B由四种元素组成,A.B溶液均显碱性.用离子方程式表示A溶液显碱性的原因:
12.(2016届北京西城区)金属Na、Mg、Al有广泛的应用.
(1)周期表中Na、Mg、Al所在周期是 .
(2)为比较Na、Mg、Al的金属性,进行了如下实验:
实验1:
各取1.0g金属钠和镁,分别加入到5mL水中,钠与水反应剧烈,镁与水反应缓慢.
实验2:
各取1.0g的镁条和铝条,分别加入到5mL1.0mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈.
已知:
元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度来判断.
由实验1和实验2得出的结论是 ,用原子结构理论解释:
同周期元素从左到右, .
(3)Na、Mg、Al都可以用于制备储氢的金属氢化物.
①NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是 .
②NaAlH4是一种良好的储氢材料.NaAlH4与水反应的化学方程式是 .
参考答案:
1.下列做法用到物质氧化性的是()
【考点】氧化还原反应.
【专题】氧化还原反应专题.
【分析】生活中常常利用物质的强氧化性进行杀菌消毒,在反应中有元素化合价变化,且该反应属于氧化还原反应,据此分析解答.
【解答】解:
A.明矾中铝离子易水解生成氢氧化铝胶体,胶体具有吸附性,所以能净水,该反应过程中没有元素化合价变化,所以不是氧化还原反应,是利用了物质易水解的特性,故A错误;
B.纯碱是强碱弱酸盐易水解而使其溶液呈碱性,其水解反应中没有元素化合价变化,属于非氧化还原反应,是利用了物质易水解的特性,故B错误;
C.臭氧具有强氧化性,所以能杀菌消毒,该过程是利用了物质的强氧化性,故C正确;
D.食醋和碳酸钙反应生成醋酸钙、二氧化碳和水,该反应是复分解反应,所以不是氧化还原反应,故D错误;
故选C.
【点评】本题考查了氧化还原反应,明确反应原理是解本题关键,难度不大.
2.下列应用不涉及氧化还原反应的是()
【分析】不涉及氧化还原反应,说明该反应中没有电子转移,其特征是没有元素化合价升降,据此分析解答.
A.铝热法冶炼难熔金属还属于置换反应,有电子转移,属于氧化还原反应,故A不选;
B.电解熔融状态Al2O3制备Al,Al元素化合价由+3价变为0价,所以有电子转移,属于氧化还原反应,故B不选;
C.过氧化钠和二氧化碳、水反应生成氧气,O元素化合价由﹣1价变为0价,所以属于氧化还原反应,故C不选;
D.该反应中各元素化合价不变,所以不属于氧化还原反应,属于复分解反应,故D选;
故选D.
【点评】本题考查氧化还原反应,侧重考查基本概念,明确元素化合价变化即可解答,注意其特征与本质区别,题目难度不大.
3.下列变化必须加入氧化剂才能实现的是()
【考点】重要的氧化剂.
【分析】需要加入适当的氧化剂才能实现,说明给予物质作还原剂,在反应中失电子化合价升高,据此分析解答.
需要加入适当的氧化剂才能实现,说明给予物质作还原剂,在反应中失电子化合价升高,
A.该反应中Cr元素化合价都是+6价,所以没有发生氧化还原反应,故A错误;
B.该反应中N元素化合价由+5价变为+4价,所以硝酸得电子作氧化剂,故B错误;
C.该反应中Si元素化合价由+4价变为0价,得电子化合价降低而作氧化剂,故C错误;
D.该反应中C元素化合价由﹣2价变为﹣1价,所以失电子化合价升高而作还原剂,故D正确;
【点评】本题以氧化还原反应为载体考查氧化剂、还原剂,侧重考查基本概念,根据元素化合价变化分析解答即可,知道常见元素化合价,题目难度不大.
4.工业上常用氯氧化法处理含氰(CN﹣)废水,一定条件下,氯气和CN﹣反应生成无毒气体.下列说法不正确的是()
【考点】氧化还原反应;
氯、溴、碘及其化合物的综合应用.
【分析】用氯氧化法处理含氰(CN﹣)废水,一定条件下,氯气和CN﹣反应生成无毒气体,反应的方程式为:
2KCN+5Cl2+4H2O=2KCl+8HCl+N2+2CO2,反应中C.N元素的化合价升高,Cl元素的化合价降低,据此分析.
A.CN﹣中N元素的化合价为﹣3价,则碳元素的化合价为+2,故A正确;
B.一定条件下,氯气和CN﹣反应生成无毒气体,反应的方程式为:
2KCN+5Cl2+4H2O=2KCl+8HCl+N2+2CO2,则反应的产物之一是无毒的N2,故B正确;
C.反应CN﹣中C元素从+2价升高到+4价,N元素从﹣3价升高到0价,则1molCN﹣参与反应时,转移5mole﹣,故C错误;
D.已知反应的方程式为:
2KCN+5Cl2+4H2O=2KCl+8HCl+N2+2CO2,则0.1molCN﹣的废水,消耗氯气0.25mol,即标准状况下Cl2的体积为5.6L,故D正确.
【点评】本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.
5.下列物质的分类依据、类别、性质三者之间对应关系完全正确的是()
电解质在水溶液中的电离.
【分析】A.FeCl2与Zn反应时作氧化剂;
B.FeCl2水解显酸性;
C.HNO3与金属氧化物反应生成盐和水;
D.HNO3具有氧化性,能与还原性物质反应.
A.FeCl2中Fe元素的化合价为+2,既有氧化性又有还原性,Zn反应时作氧化剂,故A错误;
B.FeCl2属于强酸弱碱盐,在溶液中水解显酸性,故B错误;
C.HNO3在水中能电离出H+属于酸,与CuO反应生成硝酸铜和水,不能生成NO,故C错误;
D.HNO3具有氧化性,常作氧化剂,能与还原性物质反应,可与Al、I﹣等发生反应,故D正确.
【点评】本题考查了物质的分类、氧化还原反应,题目难度不大,侧重于基础知识的考查,注意把握物质分类的依据.
6.下列推测或结论不合理的是()
【考点】同一周期内元素性质的递变规律与原子结构的关系;
同一主族内元素性质递变规律与原子结构的关系.
【分析】A.X得电子与Y失电子后电子数相同;
B.氢化物越稳定,对应阴离子的还原性越弱;
C.位于金属与非金属的交界处的元素具有半导体的性质;
D.同周期从左到右金属元素的最高价氧化物的水化物的碱性依次减弱.
A.若X2﹣和Y+的核外电子层结构相同,则X得电子与Y失电子后电子数相同,所以原子序数:
X<Y,故A正确;
B.氢化物越稳定,对应阴离子的还原性越弱,所以气态氢化物的稳定性HCl>HBr,则还原性:
Cl﹣<Br﹣,故B错误;
C.位于金属与非金属的交界处的元素具有半导体的性质,硅、锗都位于金属与非金属的交界处,具有半导体的性质,都可以做半导体材料,故C正确;
D.同周期从左到右金属元素的最高价氧化物的水化物的碱性依次减弱,铷(37Rb)和锶(38Sr)分别位于第五周期IA和IIA族,则碱性:
RbOH>Sr(OH)2,故D正确.
故选B.
【点评】本题考查了原子结构、阴离子还原性性的判断、元素周期表的应用、元素周期律等,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.
7.依据元素周期表及元素周期律,下列推断正确的是()
【考点】元素周期律的作用.
【专题】元素周期律与元素周期表专题.
【分析】A.元素的金属性越强,最高价氧化物对应的水化物的碱性越强;
B.元素的非金属性越强,最高价氧化物对应的水化物的酸性越强;
C.元素的非金属性越强,气态氢化物的热稳定性越强;
D.元素的非金属性越强,其离子的还原性越弱.
A.因金属性Ca>Mg,所以碱性:
Ca(OH)2>Mg(OH)2,故A正确;
B.因非金属性C>B,所以酸性:
H3BO3<H2CO3,故B错误;
C.因非金属性N>P,所以热稳定性:
NH3>PH3,故C错误;
D.因非金属性F>S,所以还原性S2﹣>F﹣,故D错误;
故选A.
【点评】本题考查元素周期律,学生熟悉元素的金属性与非金属性的递变规律是解答本题的关键,难度不大.
8.部分短周期元素化合价与原子序数的关系可用如图表示,下列说法正确的是()
【考点】元素周期律和元素周期表的综合应用.
【分析】由图中化合价可知,X的化合价为﹣2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,由原子序数可知Z、Q、R均处于第三周期,Z为+3价,为Al元素,Q化合价为+4、﹣4价,则Q为Si,W的化合价为+6、﹣2价,故W为S元素,R有+7、﹣1价,则R为Cl,据此解答.
由图中化合价可知,X的化合价为﹣2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,由原子序数可知Z、Q、R均处于第三周期,Z为+3价,为Al元素,Q化合价为+4、﹣4价,则Q为Si,W的化合价为+6、﹣2价,故W为S元素,R有+7、﹣1价,则R为Cl.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>O,即Y>Z>X,故A错误;
B.X和Z形成的化合物为氧化铝,属于两性氧化物,能溶于NaOH溶液,故B正确;
C.Q和X形成的化合物为二氧化硅,能与氢氟酸反应,故C错误;
D.R(Cl)的非金属性较W(S)强,则R的最高价含氧酸的酸性较强,不是最高价含氧酸则不一定,如硫酸为强酸,而次氯酸为弱酸,故D错误,
故选:
B.
【点评】本题考查结构性质与位置关系、元素周期律等,难度不大,根据推断元素是解题的关键,根据化合价结合原子序数进行推断.
9.已知34Se、35Br位于同一周期,根据元素在周期表中的位置,判断下列说法正确的是()
【考点】位置结构性质的相互关系应用.
【分析】A.同一主族非金属元素单质氧化性越强,其离子的还原性越弱;
B.非金属性越强,对应的气态氢化物的稳定性越强;
C.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小;
D.非金属性越强,对应的最高价氧化物的水化物的酸性越强.
A.溴单质的氧化性小于氯气,则对应离子的还原性:
Cl﹣<Br﹣,故A错误;
B.非金属性:
S>Se,则气态氢化物的稳定性:
H2S>H2Se,故B正确;
C.Br、Se原子Cl多1个电子层,则Cl的原子半径最小,Br、Se的电子层相同,Br的原子序数大于Se,则原子半径:
Br<Se,所以原子半径大小为:
Se>Br>S,故C错误;
D.非金属性大小为:
Cl>Br>Se,则酸性大小为:
HClO4>HBrO4>H2SeO4,故D错误;
【点评】本题考查位置、结构与性质关系的综合应用,题目难度中等,明确原子结构与元素周期律的关系为解答关键,注意熟练掌握元素周期律内容,试题培养了学生灵活应用基础知识的能力.
10.X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
(1)Z在元素周期表中的位置是 第3周期ⅥA族 .
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是 O2﹣ (填离子符号).
(3)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是 BeO+2OH﹣=BeO22﹣+H2O .
①甲中所含共价键类型是 极性共价键和非极性共价键 .
空气中的氧气还原得到甲和稀碱的溶液.图中直流电源的a是 正 极,阴极的电极反应式是 O2+2e﹣+2H2O=H2O2+2OH﹣ .
【分析】X和M的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知M为Be,X为Mg;
Z和Q的化合价都有﹣2价,应为周期表第ⅥA族元素,Z的最高价为+6价,应为S元素,Q无正价,应为O元素;
Y的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于Z小于X可知应和X同周期,为Al元素,R为+1价,且原子半径小于O,则R为H元素,然后结合元素周期律知识解答该题.
X和M的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知M为Be,X为Mg;
Y的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于Z小于X可知应和X同周期,为Al元素,R为+1价,且原子半径小于O,则R只能位于第一周期,则R为H元素,
(1)Z为S元素,原子序数为16,位于周期表中第3周期ⅥA族,
故答案为:
第3周期ⅥA族;
(2)X、Y、Q分别为Mg、Al、O元素,对应离子的电子层都是2,其原子序数越小,离子半径越大,所以离子半径最大的为O2﹣,
O2﹣;
(3)M为Be,其与Al具有相似的性质,则BeO与氢氧化钠反应的离子方程式为:
BeO+2OH﹣=BeO22﹣+H2O,
BeO+2OH﹣=BeO22﹣+H2O;
(4)①Q和R按原子个数比1:
1组成的化合物甲为H2O2,双氧水分子中含有非极性共价键和极性共价键,
极性共价键和非极性共价键;
②b连接的电解氧气得到电子生成双氧水,电极反应为:
O2+2e﹣+2H2O=H2O2+2OH﹣,该反应为还原反应,则b为电源负极、a为正极,
正极;
O2+2e﹣+2H2O=H2O2+2OH﹣.
【点评】本题考查了位置、结构与性质关系的综合应用,题目难度中等,试题涉及元素推断、离子方程式的书写、电解原理的应用等知识,试题知识点较多、综合性较强,充分考查了学生的学生的分析、理解能力及灵活应用基础知识的能力.
11.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;
(1)五种元素原子半径由大到小的顺序是(写元素符号) Na>Al>C>O>H .
O=C=O ;
.
①如果A.B均由三种元素组成,B为两性不溶物,则A的化学式为 NaAlO2 ;
由A转化为B的离子方程式为 AlO2﹣+2H2O+CO2=Al(OH)3+HCO3﹣或2AlO2﹣+3H2O+CO2=2Al(OH)3+CO32﹣ .
CO32﹣+H2O⇌HCO3﹣+OH﹣ .
【分析】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;
X、Y两元素最高正价与最低负价之和均为0,原子序数均小于O元素,为ⅠA族、ⅣA族元素,故X为H元素、Y为C元素;
Q与X同主族,结合原子序数可知,Q为