高中化学专题:氯气的实验室制取.docx
《高中化学专题:氯气的实验室制取.docx》由会员分享,可在线阅读,更多相关《高中化学专题:氯气的实验室制取.docx(5页珍藏版)》请在冰豆网上搜索。
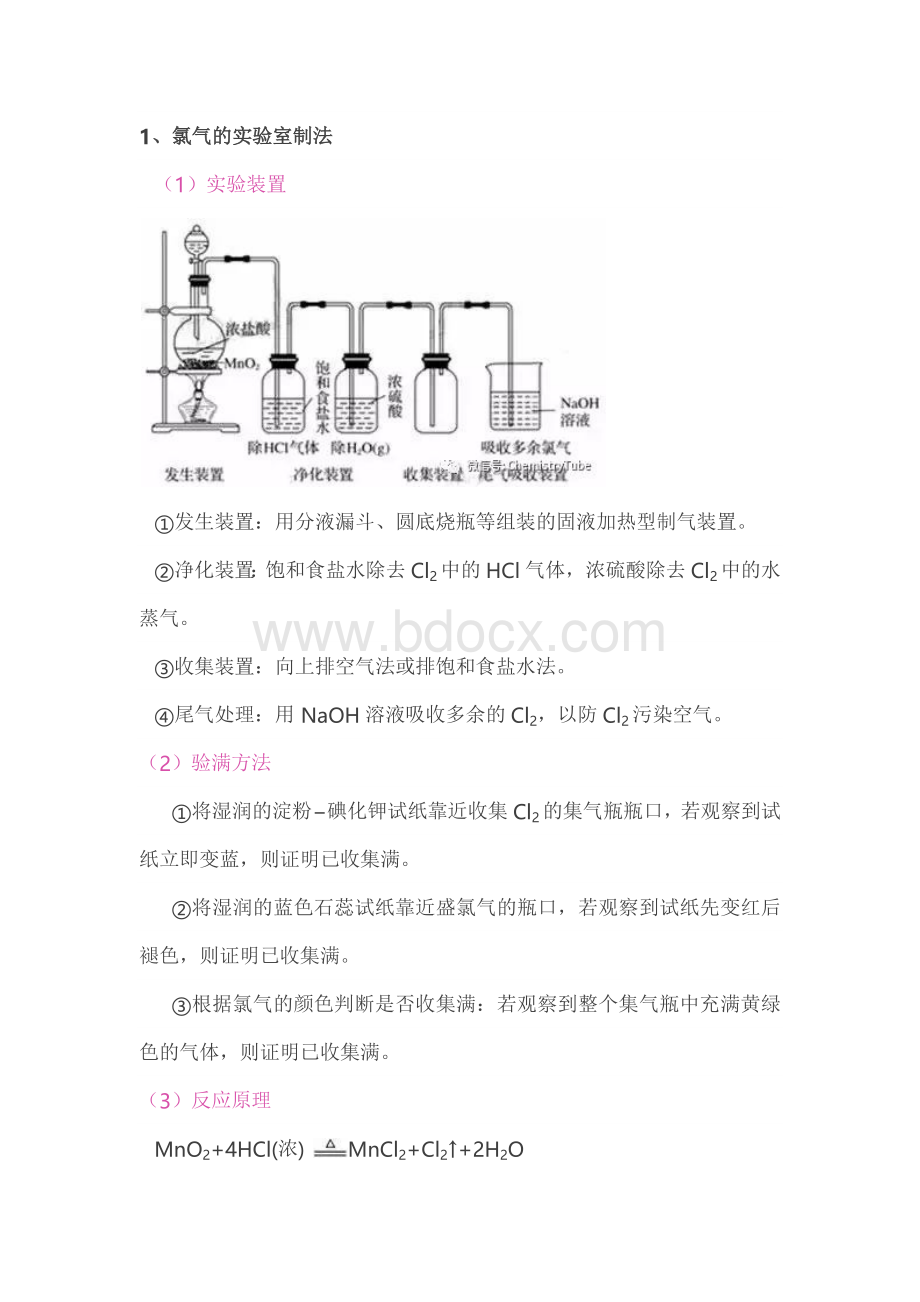
1、氯气的实验室制法
(1)实验装置
①发生装置:
用分液漏斗、圆底烧瓶等组装的固液加热型制气装置。
②净化装置:
饱和食盐水除去Cl2中的HCl气体,浓硫酸除去Cl2中的水蒸气。
③收集装置:
向上排空气法或排饱和食盐水法。
④尾气处理:
用 NaOH溶液吸收多余的Cl2,以防Cl2污染空气。
(2)验满方法
①将湿润的淀粉−碘化钾试纸靠近收集Cl2的集气瓶瓶口,若观察到试纸立即变蓝,则证明已收集满。
②将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,若观察到试纸先变红后褪色,则证明已收集满。
③根据氯气的颜色判断是否收集满:
若观察到整个集气瓶中充满黄绿色的气体,则证明已收集满。
(3)反应原理
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnO2也可用KMnO4、K2Cr2O7等氧化剂代替,如:
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
(4)实验室制取氯气的注意事项
①为了减少制得的Cl2中HCl的含量,加热时温度不宜过高,以减少HCl的挥发。
②制取时一定要注意反应条件是“浓盐酸”和“加热”,一旦浓盐酸变为稀盐酸,反应将不再发生。
③尾气吸收时,不能用澄清石灰水吸收Cl2,因为澄清石灰水中Ca(OH)2浓度小,吸收不完全。
工业上常采用石灰乳来吸收Cl2。
2、氯气实验室制法的本质
(1)若无浓盐酸,可用NaCl和浓H2SO4代替:
MnO2+2NaCl+3H2SO4(浓)MnSO4+2NaHSO4+Cl2↑+2H2O。
(2)反应物若无MnO2,可用其他强氧化剂如KClO3、Ca(ClO)2、KMnO4等代替:
KClO3+6HCl(浓) ===KCl+3Cl2↑+3H2O
Ca(ClO)2+4HCl(浓) ===CaCl2+2Cl2↑+2H2O
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
【考试规范答题】
规范书写装置中试剂的作用
装置中试剂的用途回答时一般包括直接作用和根本目的两部分内容,根据各部分装置的用途不同,可采用下列模板回答:
发生装置 生成……产生……制取……
↓
除杂装置 除去(吸收) ……防止……干扰(影响)
除去……中的杂质,以免影响测量结果
↓
性质实验装置 与……反应 验证……说明……
比较…… 检验……
↓
收集装置
尾气吸收装置 吸收……防止……的污染(影响)
【例题】
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如图所示的实验装置,按要求回答问题:
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
b接________,________接________,________接a。
(2)U形管中所盛试剂的化学式为 _____________________。
(3)装置③中CCl4的作用是________________________________。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液的气体只有一种。
为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某个装置之后再加装置⑤。
你认为装置⑤应加在________之后(填装置序号),瓶中可以放入________。
(5)丙同学看到甲同学设计的装置后提出无需多加装置⑤,只需将原烧杯中AgNO3溶液换成其他溶液。
你认为可将溶液换成________,如果观察到__________的现象,则证明制Cl2时有HCl挥发出。
(6)若取过量的MnO2与一定体积的浓HCl(含溶质HCl为0.4mol)制备Cl2(假设HCl的挥发不计,装置气密性良好),则制备的Cl2总小于0.1mol的原因是______________。
【答案】
(1)efdc(e和f顺序可以交换)
(2)CuSO4 (3)吸收Cl2
(4)③ 湿润的KI淀粉试纸(或湿润的有色布条等其他合理答案)
(5)紫色石蕊试液 紫色石蕊试液变红而不褪色
(6)随着反应的进行,浓盐酸变为稀盐酸,稀盐酸与MnO2不反应,反应停止,故盐酸中的HCl不可能全部参加反应
【解析】
为验证其猜测,应先检验水蒸气的存在,之后再检验HCl的存在。
水蒸气的检验一般使用无水CuSO4(变蓝),HCl的检验一般使用AgNO3溶液(生成白色沉淀)。
但是Cl2的存在会干扰HCl的检验,故在检验HCl之前应先除去其中的Cl2(用CCl4吸收)。
在检验HCl之前为确认Cl2已经除尽,可在③之后增加装置⑤,其中可以放入湿润的KI淀粉试纸或湿润的有色布条等。
由于HCl的水溶液有酸性,能够使酸碱指示剂变为红色,而氯气的水溶液既有酸性也有漂白性,能够使紫色的石蕊试液先变红,后褪色,所以丙同学看到甲同学设计的装置后提出无需多加装置⑤,只需将原烧杯中AgNO3溶液换成其他溶液,可将溶液换成紫色石蕊试液,如果观察到紫色石蕊试液变红而不褪色的现象,则证明制Cl2时有HCl挥发出。