中考化学《流程图的综合》专项训练及答案Word格式文档下载.docx
《中考化学《流程图的综合》专项训练及答案Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《中考化学《流程图的综合》专项训练及答案Word格式文档下载.docx(16页珍藏版)》请在冰豆网上搜索。
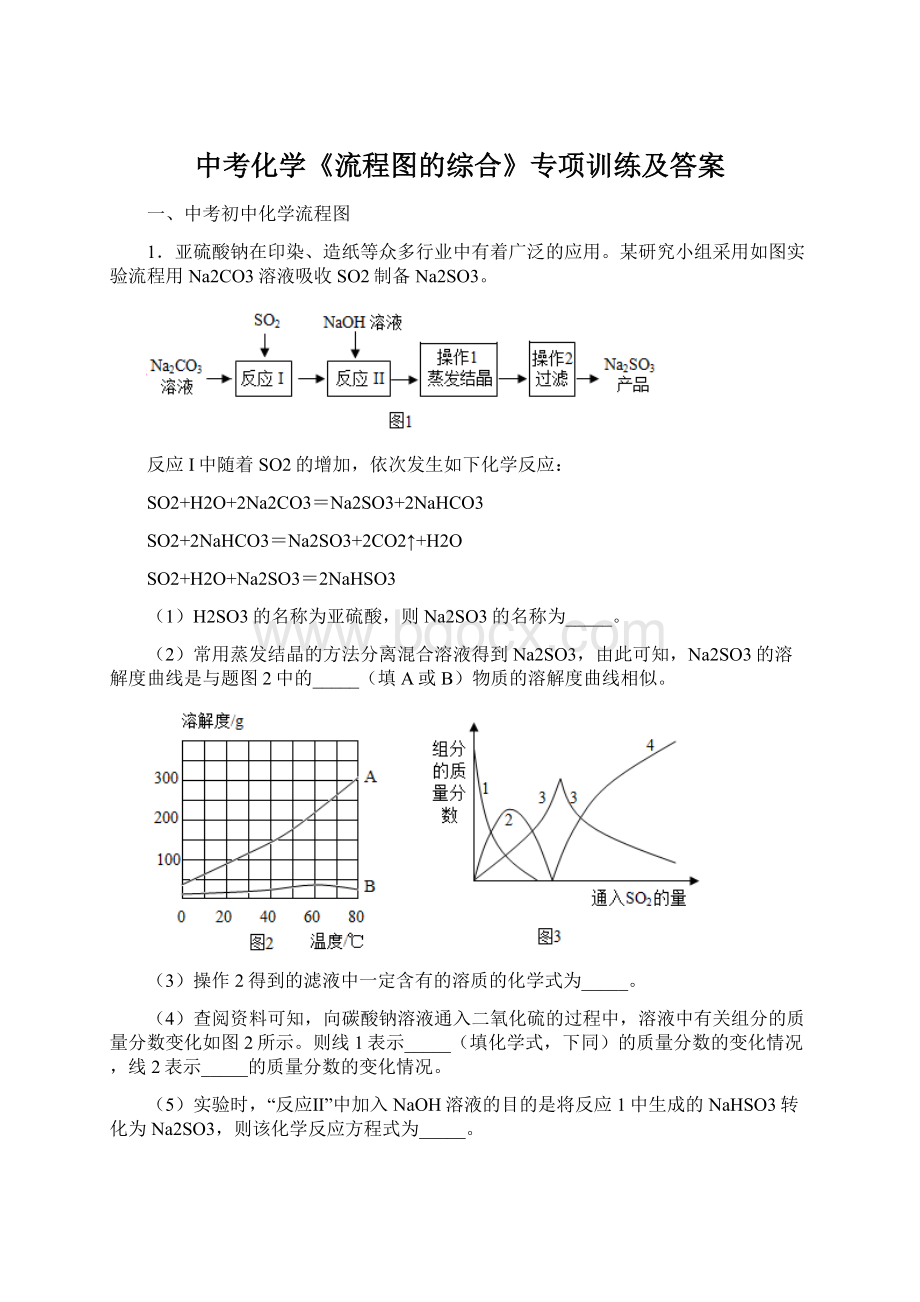
Na2SO3
(4)向碳酸钠溶液通入二氧化硫的过程中,碳酸钠应该越来越少,所以线1表示Na2CO3的质量分数的变化情况,而线2表示Na2SO3的质量分数的变化情况,最终亚硫酸钠转化为亚硫酸氢钠,所以线2是亚硫酸钠。
Na2CO3;
(5)实验时,“反应Ⅱ”中加入NaOH溶液的目的是将反应1中生成的NaHSO3转化为Na2SO3,是氢氧化钠和亚硫酸氢钠反应生成亚硫酸钠和水,对应的化学反应方程式为NaOH+NaHSO3=H2O+Na2SO3。
NaOH+NaHSO3=H2O+Na2SO3
(6)实验后,将Na2SO3样品放置在烧杯中,一段时间后,检测发现样品中出现Na2SO4杂质,且放置时间越长产生的Na2SO4越多,是亚硫酸钠和空气中的氧气反应生成硫酸铵,对应的化学反应方程式为O2+2Na2SO3=2Na2SO4。
O2+2Na2SO3=2Na2SO4
【点睛】
读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息捕捉的有效性。
解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识。
2.CaCO3在生产生活中有广泛的用途。
(1)烧石灰石可制得活性CaO,反应的化学方程式为_________________________。
为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等份,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图所示。
由此可知:
CaO与水反应会__________热量(填“放出”或“吸收”),上述温度中,_________℃煅烧所得CaO活性最高。
(2)以电石渣[主要成分为Ca(OH)2还含有少量MgO等杂质]为原料制备高纯CaCO3的流程如下:
①上图为NH4Cl浓度对钙、镁浸出率的影响(
),为进一步提升CaCO3的产量和纯度,据图分析,较适宜的NH4Cl溶液的质量分数为_______,浸取时主要反应的化学方程式为______________________________。
②流程中框线内若改用溶液_________________(填化学式),可一步得到与原流程完全相同的生成物。
③流程中框线内若改用Na2CO3溶液,也能得到高纯CaCO3。
试从生成物的角度分析原流程的优点:
a.NH3可循环利用;
b._______;
【答案】CaCO3
CaO+CO2↑放出90010%2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2ONH4HCO3或(NH4)2CO3NH4Cl可循环利用;
(1)烧石灰石生成CaO和二氧化碳,反应的化学方程式为CaCO3
CaO+CO2↑。
CaO与水反应生成氢氧化钙,同时放出热量,根据曲线图可知,在900℃煅烧所得CaO与水反应放出热量最高,故900℃煅烧所得CaO活性最高。
(2)①据图分析,NH4Cl溶液的质量分数为10%时,镁的浸出率较低,钙的浸出最大。
浸取时主要反应是氯化铵与氢氧化钙反应,生成氯化钙、水和氨气,化学方程式为2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O。
②流程中框线内先加入氨水,再通入二氧化碳,生成碳酸钙和氯化铵,若改用溶液(NH4)2CO3,也可以一步得到碳酸钙和氯化铵。
③从生成物的角度分析原流程的优点:
a.NH3可循环利用,因为浸取产生的氨气可用于碱化;
b.NH4Cl可循环利用,因为合成过程中产生的氯化铵可用于浸取电石渣。
判断某物质是否可循环利用,方法是看该物质在流程中既能做反应物,又是生成物。
3.用金属铁制备自来水新型消毒、净水剂Na2FeO4的流程如下,请回答下列问题:
(1)固体B中的物质是_______;
Na2FeO4属于______(填“酸”、“碱”、“盐”、“氧化物”).
(2)操作Ⅰ的名称是________;
该操作能使A、B分离的原因是_________.
(3)反应②的基本反应类型为:
_______;
反应③的化学方程式为:
________.
(4)溶液C中的溶质组成存在_________种可能性.
【答案】Fe和Cu盐过滤A是液体,B是固体(合理皆可)复分解反应2Fe(OH)2+H2O2=2Fe(OH)3三
(1)由反应的流程可知,过量的铁粉与硫酸铜反应,生成了硫酸亚铁和铜,由于铁是过量的,在过滤后得到的固体B是Cu,Fe的混合物;
Na2FeO4是金属离子和酸根离子构成的化合物,属于盐。
Fe和Cu;
盐;
(2)由上述反应①得到是固液的混合物,要将固液分开,应进行的操作是过滤。
过滤;
A是液体,B是固体(合理皆可);
(3)反应②是硫酸亚铁与氢氧化钠反应生成氢氧化亚铁和硫酸钠,反应的方程式是:
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,该反应是两种化合物交换成分生成另外两种化合物,属于复分解反应;
反应③是氢氧化亚铁被过氧化氢氧化为氢氧化铁,方程式是:
2Fe(OH)2+H2O2=2Fe(OH)3。
复分解反应;
2Fe(OH)2+H2O2=2Fe(OH)3;
(4)若氢氧化钠溶液与硫酸亚铁溶液恰好完全反应,所得溶液中只有一种溶质——硫酸钠;
若氢氧化钠过量,则有两种溶质﹣﹣硫酸钠和氢氧化钠;
若硫酸亚铁过量,则有两种溶质﹣﹣硫酸钠和硫酸亚铁。
三。
本题给出了制取物质的反应流程图,对于这类题目,需要搞清楚每一步反应物、生成物,清楚工艺流程原理.再结合有关的知识分析解答有关的问题。
4.我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,得到一种外观似金子的锌和铜的合金(黄铜)。
(1)黄铜可用来做热交换器,说明黄铜具有良好的_____;
(2)试写出赤铜(Cu2O)和木炭粉混合后加热的化学方程式_____;
(3)鉴别黄铜和黄金多种方法,用灼烧法鉴别产生的现象及结论是_____;
(4)用含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4∙7H2O)的流程如下:
(1)A的化学式____;
B的化学式_____。
(2)除铁过程中,图1和图2分别表示温度、pH对除铁效果的影响。
由图可知除铁时温度应控制在____为宜,pH应控制在_____为宜。
【答案】导热性2Cu2O+C
CO2↑+4Cu灼烧变黑的为黄铜,无明显现象的是黄金H2SO4Zn823.2
(1)黄铜可用来做热交换器,热交换器是能量传递的设备,所以利用的是黄铜具有良好的导热性,故填:
导热性。
(2)赤铜(Cu2O)和木炭粉混合后加热,反应物为赤铜和碳,条件是高温,生成的是二氧化碳和铜,对应的化学方程式2Cu2O+C
CO2↑+4Cu,故填:
2Cu2O+C
CO2↑+4Cu。
(3)鉴别黄铜和黄金多种方法,用灼烧法可以鉴别,因为在涉及到的金属单质中只有铜能够和氧气在加热的条件下反应生成黑色的氧化铜,所以用灼烧法鉴别是产生的现象及结论是灼烧变黑的为黄铜,无明显现象的是黄金,故填:
灼烧变黑的为黄铜,无明显现象的是黄金。
(4)①由于实验的目的是“用含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备
七水硫酸锌(ZnSO4.7H2O)”,所以在过程中不能引入硫酸锌之外的杂质,所以加入的酸是
硫酸,硫酸和氧化锌、氧化亚铁氧化铜反应分别生成硫酸锌和水、硫酸亚铁和水、硫酸铜和水,B物质能够除去硫酸锌中的硫酸铜和硫酸亚铁故B为Zn,锌和硫酸铜反应生成硫酸锌和铜,和硫酸亚铁反应生成硫酸锌和铁,故填:
H2SO4;
Zn。
②除铁过程中,图1和图2分别表示温度、pH对除铁效果的影响。
由图可知除铁时温度应控
制在82°
C为宜,pH应控制在3.2为宜(这两个数据都允许有偏差,但是不能偏差太大),故填:
82;
3.2。
5.氯化钙是多用途的干燥剂和建筑防冻剂。
实验室里用石灰石和盐酸制备二氧化碳的含酸废液(含有MgCl2、FeCl3等)通过以下途径制得无水氯化钙。
(1)操作I的名称为_____,操作II的名称为______。
滤渣的化学成分有____________________。
(2)石灰乳的作用是①_____________________,②_________________________,写出其中1个反应的化学方程式____________________________________。
【答案】过滤降温结晶Mg(OH)2、Fe(OH)3中和多余的盐酸除去Mg2+和Fe3+2HCl+Ca(OH)2=CaCl2+2H2O或Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2或3Ca(OH)2+2FeCl3=2Fe=(OH)3↓+3CaCl2。
(1)混合物中有易溶于水的、难溶于水的物质,所以操作I的名称是过滤;
蒸发浓缩过程中溶液温度较高,降低温度使溶质从溶液中析出,操作II的名称是冷却结晶或结晶;
根据流程中发生的反应:
2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2,MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,Mg(OH)2、Fe(OH)3都难溶于水,所以滤渣的化学成分有Mg(OH)2、Fe(OH)3;
(2)石灰乳参加的反应有:
2HCl+Ca(OH)2=CaCl2+2H2O2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2,MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,所以石灰乳的作用是:
①中和废液中的酸,②使废液中的镁、铁完全沉淀,除去Mg2+和Fe3+;
流程中的反应化学方程式有:
2HCl+Ca(OH)2=CaCl2+2H2O或Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2
或3Ca(OH)2+2FeCl3=2Fe=(OH)3↓+3CaCl2。
6.纯碱在工业上有广泛的应用。
实验室模拟工业上利用饱和食盐水生产纯碱的流程图是:
回答下列问题:
(1)反应1的化学方程式为________________________________________。
(2)操作1中,需要用到的玻璃仪器除漏斗、玻璃棒外,还有______________。
(3)纯碱的化学式为_________,X的化学式为________。
(4)“后续处理”主要包括蒸发浓缩、_________、过滤等操作,参考如图的溶解度曲线分析,采用这些操作方法的原因是___________________________。
(5)写出NH4Cl的一种用途_____。
【答案】NaCl+NH3+CO2+H2O==NaHCO3↓+NH4Cl烧杯Na2CO3H2O降温结晶NH4Cl的溶解度随温度的降低而减小用作氮肥
(1).氨气、水】二氧化碳7氯化钠四种物质反应生成碳酸氢钠和氯化铵,方程式为:
NaCl+NH3+CO2+H2O==NaHCO3↓+NH4Cl
(2).过滤操作需要的玻璃仪器除漏斗、玻璃棒外,还有烧杯(3).碳酸钠俗称纯碱,化学式为Na2CO3(4).由反应方程式可知X是H2O(5).由溶解度曲线图可知,NH4Cl的溶解度随温度的降低而减小,而氯化钠的溶解度受温度很小,降温时氯化铵大部分析出,而氯化钠不析出,所以可用降温结晶提纯氯化铵;
(7).氯化铵含有氮元素,可用作氮肥
7.某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2。
小青同学设计了以下实验方案来除去可溶性杂质。
(1)步骤①的化学方程式为___________。
(2)步骤②中得到的白色沉淀是_________(填化学式)。
(3)步骤③中加稀盐酸是为了除去溶液中的______。
ACaCl2BMgCl2CNaOHDNa2CO3
【答案】2NaOH+MgCl2=2NaCl+Mg(OH)2↓CaCO3CD
除钙离子用碳酸根离子,除镁离子用氢氧根离子,加入的试剂都是过量的,后加的试剂要把先加的试剂所带入的杂质除掉,加入过量的稀盐酸,这样可以除去多余的碳酸根离子和氢氧根离子
(1)步骤①的反应是氢氧化钠和氯化镁生成氢氧化镁和氯化钠,反应的化学方程式为2NaOH+MgCl2=2NaCl+Mg(OH)2↓。
(2)步骤②反应是碳酸钠和氯化钙生成碳酸钙和氯化钠,得到的白色沉淀是碳酸钙,化学式为CaCO3。
(3)加适量盐酸,与①中过量NaOH溶液和②中过量Na2CO3溶液发生反应,生成氯化钠、水和二氧化碳气体;
蒸发、结晶,得到精盐,步骤③中加稀盐酸是为了除去溶液中的氢氧化钠和碳酸钠,故选CD。
8.图中A-I是初中化学常见的物质,C、D、E、F均有两种元素组成,C可用作干燥剂,其中G、H、I均为单质;
H在E、G存在的情况下生成铁锈。
图中“﹣”两端的物质间能发生化学反应;
“→”表示物质间存在转化关系;
反应条件、部分反应物和生成物已略去。
(1)写出化学式:
C________,H________;
(2)写出IF反应的化学方程式________;
(3)写出A与D反应的化学方程式________。
【答案】CaCl2FeH2+Cl2
2HClCO2+Ca(OH)2=CaCO3↓+H2O
C有两种元素组成,可用作干燥剂,则C可能是氯化钙;
H在E、G存在的情况下生成铁锈,且G为单质,则H是铁,G是氧气,E是水;
铁能产生单质I,则I是氢气,氢气在氯气中点燃产生氯化氢,则F是氯化氢,水溶液为稀盐酸;
碳在氧气中燃烧产生二氧化碳,则D是二氧化碳,二氧化碳能与氢氧化钙反应产生碳酸钙,则A是氢氧化钙,B是碳酸钙,碳酸钙与稀盐酸反应产生氯化钙;
则物质C是氯化钙;
(1)C的化学式:
CaCl2,H的化学式:
Fe;
(2)I→F:
氢气在氯气中点燃产生氯化氢的化学方程式:
H2+Cl2
2HCl;
(3)A与D:
二氧化碳与氢氧化钙反应产生碳酸钙沉淀和水的化学方程式:
CO2+Ca(OH)2=CaCO3↓+H2O;
9.某化学兴趣小组从某化工厂排污国取得有色废水样品A,并通过如下实验回收处理。
其中固体E经测定是一种具有固定熔点和沸点的复合肥料。
请根据图示回答:
(1)操作Ⅰ的实验步骤是______________,反应的化学方程式是__________。
(2)操作Ⅱ所需的仪器有_____________,得到的固体E是___________。
(3)废水样品A中一定含有的溶质是____________,可能含有的溶质有____________、____________、____________(至少写出三种),此时选择的试剂X为____________。
(4)若X选择其他试剂,操作流程和实验现象不变,实验后测得性溶液D中含有两种不同的酸根离子,则此时选择的试剂X为____________。
【答案】加稍过量的
溶液,充分反应后过滤,再加稀硝酸中和滤液成中性
、
酒精灯、玻璃棒、蒸发皿、铁架台
(写出六种中的三种即可)
溶液
滤液B中加适量的氢氧化钾溶液得到氢氧化铜沉淀和无色滤液C,说明滤液B中一定含有铜离子,无色滤液C一定含有钾离子。
固体纯净物E是一种复合肥料.所以E中含有钾元素又是复合肥,所以E为硝酸钾。
无色滤液C含有硝酸根离子,故滤液B中也含有硝酸根离子,所以B硝酸铜,A是硫酸铜,X为硝酸钡。
(1)操作Ⅰ的实验步骤是加过量的
溶液,充分反应后过滤,再加稀硝酸中和滤液成中性,反应的化学方程式是
。
(2)操作Ⅱ是蒸发结晶,所需的仪器有酒精灯、玻璃棒、蒸发皿、铁架台,得到的固体E是
(3)废水样品A中一定含有的溶质是
,可能含有的溶质有
等,此时选择的试剂X为
溶液。
(4)若X选择其他试剂,操作流程和实验现象不变,实验后测得中性溶液D中含有两种不同的酸根离子,则此时选择的试剂X为
10.粗盐中含有多种可溶性杂质(MgCl2、CaCl2、Na2SO4等)和不溶性杂质(泥沙等)。
(1)在书本实验活动8“粗盐中难溶性杂质的去除”实验中,粗盐经过溶解、过滤、蒸发、计算产率等实验步骤,可以初步提纯,其中过滤蒸发两项操作中都用到玻璃棒,作用分别是__________、____________。
(2)蒸发操作时,当蒸发皿中出现___________时,应停止加热,并观察蒸发皿中食盐外观。
(3)计算产率,以下操作会导致产率(
)偏小的有_______________(填序号,答案不唯一)
a.食盐未完全溶解就开始过滤
b.过滤时液面高于滤纸边缘但低于漏斗口
c.转移固体时有少量固体洒落在地面上
d.蒸发操作时,食盐飞溅剧烈
(4)通过以上操作只能除去粗盐中难溶性杂质,欲除去MgCl2、CaCl2、Na2SO4得到较纯净的NaCl,可采用下图所示流程(部分操作省去)[提示:
BaCO3难溶于水]
①上图中所用甲、乙、丙三种试剂依次可以是____。
a.NaOH溶液、Na2CO3溶液、BaCl2溶液
b.Na2CO3溶液、BaCl2溶液、NaOH溶液
c.NaOH溶液、BaCl2溶液、Na2CO3溶液
②请写出BaC12溶液与Na2SO4溶液反应的化学方程式____________。
③上述试剂中Na2CO3不能用K2CO3代替,原因是____________。
【答案】引流防止液体局部温度过高发生飞溅(意思对即可)较多固体acdc
K2CO3能与CaCl2、BaCl2、盐酸等物质反应生成KCl,引入了新的杂质
(1)过滤操作中玻璃棒的作用是引流,蒸发操作中玻璃棒的作用是使液体均匀受热,防止液体飞溅。
(2)蒸发操作时,当蒸发血中出现较多固体时,应停止加热,利用蒸发皿的余热使其蒸干,并观察蒸发皿中食盐外观。
(3)a、食盐未完全溶解就开始过滤,导致精盐质量偏小,从而导致产率偏小,符合题意;
b、过滤时液面高于滤纸边缘但低于漏斗口,导致不溶于水的物质进入滤液,从而导致产率偏大,不符合题意;
c、转移固体时有少量固体洒落在地面上,导致精盐质量偏小,从而导致产率偏小,符合题意;
d、蒸发操作时,食盐飞溅剧烈,导致精盐质量偏小,从而导致产率偏小,符合题意。
故选acd。
(4)①加入过量的氢氧化钠溶液时,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,加入过量的氯化钡溶液时,氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,加入过量的碳酸钠溶液时,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和过量的氯化钡反应生成碳酸钡沉淀和氯化钠,加入适量稀盐酸时,稀盐酸和过量的氢氧化钠反应生成氯化钠和水,和过量的碳酸钠反应生成氯化钠、水和二氧化碳。
根据分析可知,加入碳酸钠的很重要的作用是除掉前面的加入的过量的氯化钡,所以加入氯化钡必须在碳酸钠之前。
故选c。
②BaCl2溶液与Na2SO4溶液反应生成硫酸钡和氯化钠,该反应的化学方程式:
BaCl2+Na2SO4═BaSO4↓+2NaCl。
③上述试剂中Na2CO3不能用K2CO3代替,原因是过量的碳酸钾和盐酸反应生成氯化钾、水和二氧化碳,会带入氯化钾。
11.钛和钛合金被认为是21世纪重要的金属材料。
钛合金与人体具有很好的“相容性”,可用于制造人造骨骼。
工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料生产钛,其工业流程示意图如下:
请回答:
(1)钛合金属于_______(选填“混合物”、“纯净物”)。
(2)钛酸亚铁FeTiO4中钛的化合价为______价。
(3)以CO和H2在合成塔中生产甲醇(CH3OH)属于化合反应,其化学方程式为________________。
(4)经高温冶炼得到金属钛,则参加反应的镁与生成钛的质量比为_________。
(5)氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2
2TiCl4+2X+6CO,则X的化学式为______。
【答案】混合物+4CO+2H2
CH3OH1:
1FeCl3
(1)由两种或两种以上物质组成的物质叫混合物;
由一种物质组成的物质叫纯净物;
钛合金属于混合物。
(2)化合物中元素的化合价的代数和为零,设钛酸亚铁FeTiO4中钛的化合价为x,亚铁指+2价的铁元素,则
x=+4,故钛酸亚铁FeTiO4中钛的化合价为+4价。
(3)由两种或两种以上物质生成一种物质的反应叫化合反应;
以CO和H2在合成塔中生产甲醇(CH3OH)属于化合反应,化学方程式为CO+2H2
CH3OH;
(4)经高温冶炼得到金属钛,TiCl4+2Mg═Ti+2MgCl2则参加反应的镁与生成钛的质量比为
。
(5)据质量守恒定律可知,化学反应前后原子的