磁珠纯化DNA的原理_精品文档资料下载.pdf
《磁珠纯化DNA的原理_精品文档资料下载.pdf》由会员分享,可在线阅读,更多相关《磁珠纯化DNA的原理_精品文档资料下载.pdf(7页珍藏版)》请在冰豆网上搜索。
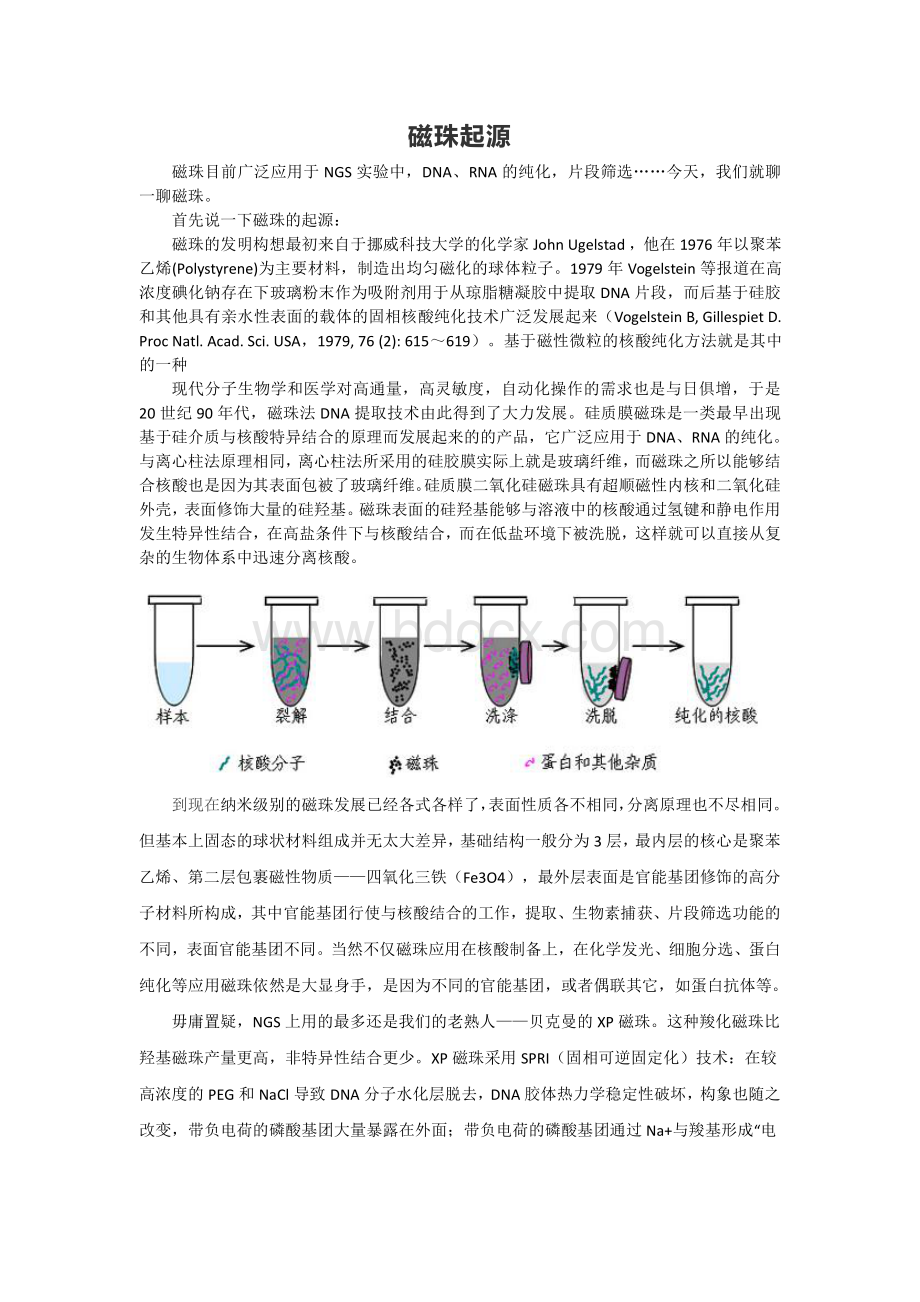
磁珠表面的硅羟基能够与溶液中的核酸通过氢键和静电作用发生特异性结合,在高盐条件下与核酸结合,而在低盐环境下被洗脱,这样就可以直接从复杂的生物体系中迅速分离核酸。
到现在纳米级别的磁珠发展已经各式各样了,表面性质各不相同,分离原理也不尽相同。
但基本上固态的球状材料组成并无太大差异,基础结构一般分为3层,最内层的核心是聚苯乙烯、第二层包裹磁性物质四氧化三铁(Fe3O4),最外层表面是官能基团修饰的高分子材料所构成,其中官能基团行使与核酸结合的工作,提取、生物素捕获、片段筛选功能的不同,表面官能基团不同。
当然不仅磁珠应用在核酸制备上,在化学发光、细胞分选、蛋白纯化等应用磁珠依然是大显身手,是因为不同的官能基团,或者偶联其它,如蛋白抗体等。
毋庸置疑,NGS上用的最多还是我们的老熟人贝克曼的XP磁珠。
这种羧化磁珠比羟基磁珠产量更高,非特异性结合更少。
XP磁珠采用SPRI(固相可逆固定化)技术:
在较高浓度的PEG和NaCl导致DNA分子水化层脱去,DNA胶体热力学稳定性破坏,构象也随之改变,带负电荷的磷酸基团大量暴露在外面;
带负电荷的磷酸基团通过Na+与羧基形成“电桥”,使得DNA被特异吸附到带羧基的磁珠表面。
同时由于磁珠具有超顺磁性,可以通过外加磁场进行收集操作。
去上清后,磁珠可用酒精洗涤,最后用TE洗脱DNA。
SPRI成就了贝克曼尖端的磁珠纯化技术。
这项技术是由人类基因组计划主要负责人之一TrevorHawkins博士(美国能源部的人类基因组计划的前任主任)领导发明,用于人类基因组计划的样品准备工作。
TrevorHawkins博士也曾在西门子诊疗、皇家飞利浦电子公司和通用电气等企业担任高级主管人,在医疗保健领域工作了超过25年,他专注提升医疗技术与创新,贡献巨大,单说SPRI专利现在仍然是生命科学和诊断的磁珠应用领域中最重要的专利之一。
起初SPRI这个专利并不在贝克曼的手里,而是,在Agencourt公司手里。
为了实现在生物医学方面实现核酸提取的自动化和高通量,在2005年贝克曼与Agencourt达成协议,以1.5亿美金的金额成功收购Agencourt公司。
在实现了强强联合后,贝克曼在自动化核酸纯化领域至今一直引领,在NGS兴起后,XP磁珠被广泛用于文库构建工作中,而后贝克曼也推出专用的更为精准的片筛磁珠AgencourtSPRIselect。
顺便说一下,Agencourt公司是两个著名体系的开创者:
AgencourtBioscience的主营产品是用于生化医疗研究的核酸纯化产品。
Agencourt还有另一个重要部门则是APG,发开基于磁珠的大规模并行克隆连接DNA测序法,2006年它被贝克曼1.2亿美元转卖给了ABI。
贝克曼一直持有Agencourt品牌,2007年ABI依靠APG的技术也推出一款连接法的测序仪,是的,它就是号称二代测序碱基读取最准确的SOLiD系统。
当然说到XP,大家更好奇的是它片选筛选原理。
XP磁珠体系中包含:
磁珠、聚乙二醇(PEG)、以及盐离子等,在一定浓度的PEG和盐离子环境中,DNA可吸附到羧基修饰的高分子磁珠表面(即固相载体),该过程是可逆的,在适当条件下,结合的DNA分子可以被洗脱回收。
构建过几次文库的,就很清楚自己要大多片段的文库,改用多少成XP去双选。
磁珠双选很大程度依赖于PEG。
PEG沉淀蛋白、沉淀DNA,DNA连接反应中低浓度PEG做为聚合剂,增强载体与目的片段碰撞的机会(很多公司的建库试剂盒接头连接后,如果要片段筛选,需要先纯化目的是去除PEG的影响。
为了提高连接效率,连接Buffer含有一定的PEG)。
这些都是分子生物学的经典实验,早已收录分子生物学的圣经分子克隆实验指南。
PEG沉淀大分子是很久以前就发现,因为PEG能够通过吸涨作用,通过空间位置排斥效应,诱导水溶液的大分子聚合(MACROMOLECULARCROWDING:
Biochemical,Biophysical,andPhysiologicalConsequences,1993)。
而Lis是最早利用PEG按DNA分子大小沉淀DNA的,早在1975年发有文章。
(Sizefractionationofdouble-strandedDNAbyprecipitationwithpolyethyleneglycol,NucleicAcidsResearch,1975;
FractionationofDNAFragmentsbyPolyethyleneGlycolInducedPrecipitation,1980)LisandSchleif,1975PEG作为一种分子拥挤试剂,达到一定的浓度时,夺取了一定的水,溶液环境变化,会使较大DNA的结构变紧凑,发生坍塌性的转变而凝聚。
不同长度的DNA构像稳定性不同,在遵循热力学规律的情况,这与溶液环境与分子拥挤试剂的浓度有很大的关系。
即在特定的溶液中,当PEG浓度达到某一临界值是,就会发现一定大小以上的DNA分子构象非连续的突变,发生凝聚(CollapseofsingleDNAmoleculeinpoly(ethyleneglycol)solutions,1995;
DNAcondensation,CurrentOpinioninStructuralBiology,1996)。
当然其中细节远远没有想象中的简单,至今不能完全研究清楚,有一篇文章标题就是这样:
Compatiblesoluteinfluenceonnucleicacids:
Manyquestionsbutfewanswers。
做为磁珠Buffer配方,PEG还能保持溶液的粘度,使磁珠保持悬浮不易聚沉。
也不易造成蛋白变性和非特异性吸附。
当然PEG分离效果易受pH、温度等影响,温度低PEG也不易与水相完全互溶(所以磁珠使用前要平衡至室温)。
磁珠的选择随着测序成本超摩尔定律的下降,建库成本逐渐成为NGS推广的主要瓶颈之一,它的优化变得越来越重要。
就整个NGS建库试剂而言,磁珠使用广泛、需求量大,可以说重要性仅次于PCR酶。
XP磁珠无疑是其中的领导者,正是源于市场优势,XP磁珠不仅货期长、价格居高不下;
而且包装规格也不灵活,不利于客户配合建库试剂盒合理采购。
因此不少厂商看到了机遇,想推出一款成本低廉、性能优异的磁珠替换XP磁珠。
但是不说,磁珠中层基质不同,磁珠的基本性质会有所不同;
修饰的官能团不同,磁珠的吸附特性会有所不同。
即便是相同的封闭基质和官能团,基质的包被工艺不同,会造成基质厚度、孔容、孔径、比表面积不同,所能吸附的颗粒粒径偏好也会有所不同;
即便是修饰相同的官能团,官能团修饰工艺不同,会造成官能团密度、臂长不同,所携带的表面电荷、斥力、氢键数量不同,吸附能力会随之改变。
其Buffer配方不同,效果也会有所不同,如Tween-20等润滑剂不同,也会影响磁珠的残留;
还有就是不同分子量的PEG吸涨作用强弱不同;
笔者亲测PEG8000和PEG3350效果差异巨大。
当然我们使用的时候难以看到以上说的那些,不过依然有简单的办法,评价它们。
放在磁力架上澄清时间,可以评估磁珠的磁响应时间;
电镜下可以观察其粒径是否均一,差异明显的普通显微镜下就可以看出差异;
震荡起泡多少,可以看出Buffer的不同。
目前市场磁珠种类繁多,从宣传效果上难以看出优劣,但实际纯化效果质量参差不齐,具有良好的片段筛选能力的磁珠更是较少。
不同磁珠片段筛选能力不同,也需要测试,不能照搬XP的条件。
顺便说一下,NEB的Marker有修饰,导致不同大小ladder都会被回收,不能用来测试片筛,Fermants和英俊的都可以用。
当然不同类型的磁珠会有不同的优势。
比如,有的磁珠磁响应性好但是沉降速度快,更适合磁棒式自动提取仪(KingFisher那种);
有的磁珠沉降速度慢但是磁响应时间长,更适合移液式自动提取仪(移液工作站)。
磁珠的发展。
化学发光、蛋白纯化等应用上的技术,肯定会超越核酸制备。
然而在NGS领域,磁珠运用也是在不断拓展,简单说几种:
KAPA推出“with-bead”策略就更适合自动化建库。
Axygen推出的AxyPrepMagTMPCRNormalizer就可以免去定量的环节,适合于大量样本的自动化建库。
特别是illumina推出的NexteraDNAFlexLibraryPreparationKit的核心技术为Bead-LinkedTransposome(BLT),将Nextera的转座体(transposome)链接在磁珠上。
BLT的On-BeadTagmentation整合了DNA片段化(fragmentation)、片段接头化(adapterligation)、和文库定量归一化(librarynormalization)的步骤,减少手动接触点并节省文库制备时间到2.5小时。
当样本DNA起始量超过BLT的饱和点(大约是100ngDNA),过多的DNA便无法被片段化。
不同于其他种文库制备方法,这样的化学特性使得NexteraDNAFlex片段化结果不会受到DNA定量的准确度影响。
当DNA量介于100-500ng之间,NexteraDNAFlex制备后的文库片段长度和上样量几乎是固定的。
用户可以利用NexteraDNAFlex的广泛样本DNA起始量,灵活支持各种类型的基因组测序,简化日常操作。
当然基于微流控,用磁珠加特异的Barcode区分片段或细胞,实现linked-reads或者单细胞转录组测序,在兴起。
2015年崛起黑马10xGenomics,它的GemCode技术核心是对1ng的DNA进行精确分区,形成含有1条DNA模板链和特定相同的Barcode序列的微小反应体系(GEM,GelBeadinEmulsion),不同GEM反应体系中的Barcode不同。
BD的RhapsodySingle-CellAnalysisSystem也是类似产品。
高通量测序发展如此之快,肯定还有更多关于磁珠在NGS应用会出来,我们一起期待吧!
作者简介:
csp:
熟悉NGS各类建库技术,主攻DNA方向;
微信公众号NGS实验起源