优等生高考化学专题11综合制备实验和性质实验Word格式文档下载.docx
《优等生高考化学专题11综合制备实验和性质实验Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《优等生高考化学专题11综合制备实验和性质实验Word格式文档下载.docx(11页珍藏版)》请在冰豆网上搜索。
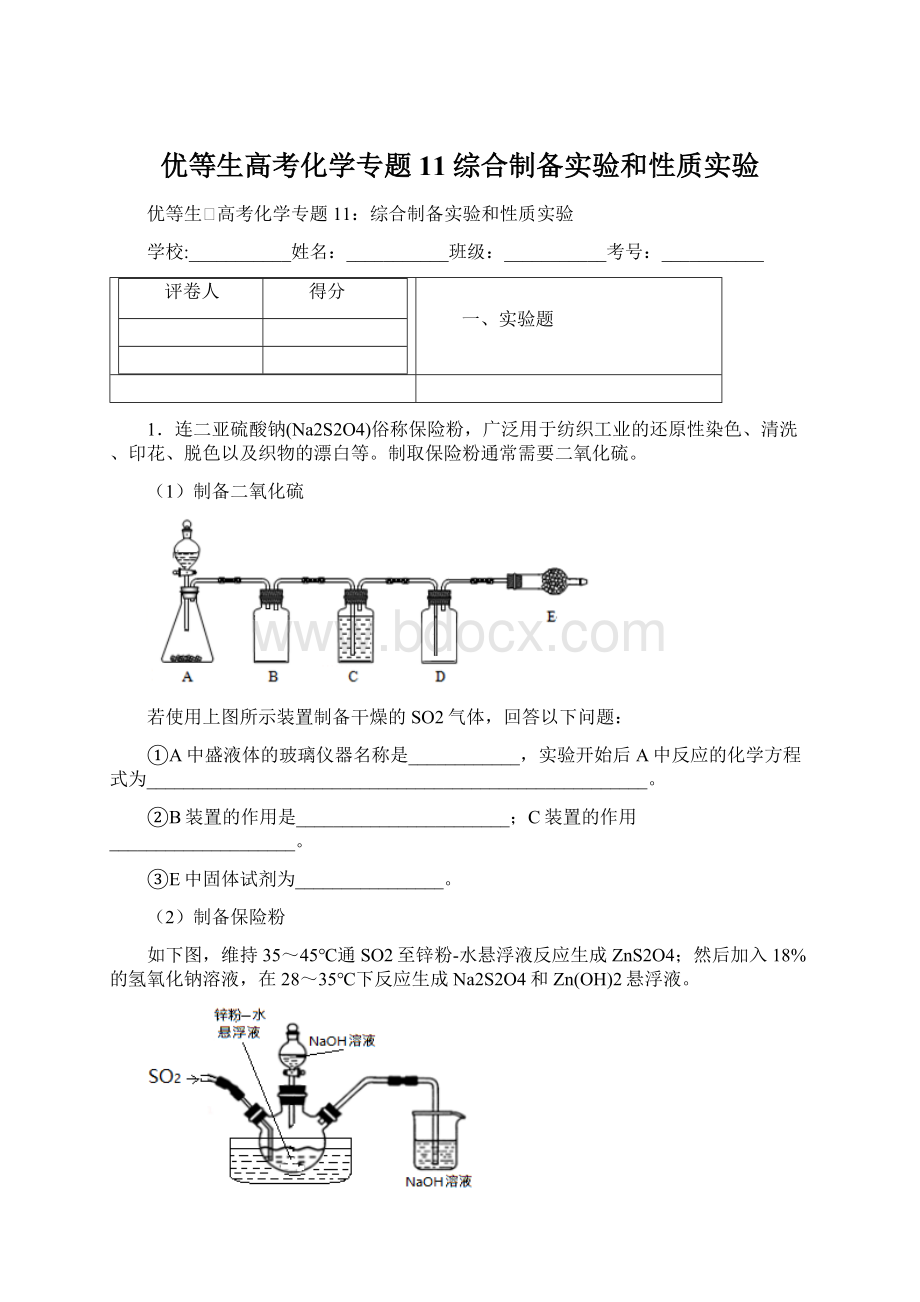
C装置的作用____________________。
③E中固体试剂为________________。
(2)制备保险粉
如下图,维持35~45℃通SO2至锌粉-水悬浮液反应生成ZnS2O4;
然后加入18%的氢氧化钠溶液,在28~35℃下反应生成Na2S2O4和Zn(OH)2悬浮液。
反应物经压滤除去氢氧化锌沉淀后,往滤液中加入氯化钠,并冷却至20℃,使Na2S2O4结晶析出,滤出晶体后用酒精脱水干燥即得产品。
①在制取Na2S2O4过程中发生了氧化还原反应,氧化剂是___________;
生成1molNa2S2O4转移电子______mol。
②滤液中加入氯化钠使_______离子浓度增大,促进Na2S2O4结晶析出;
滤出晶体后用酒精脱水干燥是因为Na2S2O4在酒精中的溶解度_______(填“较大”或“较小”),且酒精易挥发。
③制取Na2S2O4也常用甲酸钠法,控制温度70~80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液微酸性,即可生成Na2S2O4,反应的离子方程式:
_________________________________________。
(3)测定保险粉纯度
Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。
Na2S2O4遇KMnO4酸性溶液发生反应:
5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O
称取3.0gNa2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于试管中,用0.10mol·
L-1的KMnO4溶液滴定。
重复上述操作2次,平均消耗KMnO4溶液18.00mL则该样品中Na2S2O4的质量分数为_____________(杂质不参与反应)。
2.四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃。
分液漏斗中放浓盐酸,仪器a中放MnO2,二者用于制氯气,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。
请回答下列各问题。
(1)仪器a、b的名称分别是______、________,仪器b的作用是__________________。
(2)图中装置F与装置G之间连接干燥管的目的是______________________________。
(3)装置D中Sn发生反应的化学方程式为___________;
装置G的作用是____________。
(4)装置B中的试剂是______________________;
装置C的作用是_________________。
(5)实验过程中。
当观察到________时,即可熄灭装置D处的酒精灯。
(6)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,请写出四氯化锡水解的化学方程式______________________________________。
3.呋喃甲酸是抗菌素一种,在食品工业中作防腐剂,也作涂料添加剂、医药、香料等中间体,可用呋喃甲醛制备,其实验原理和制备步骤如下:
步骤③提纯过程:
溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
已知:
①呋喃甲酸在100℃升华,133℃熔融,230-232℃沸腾,并在此温度下脱羧;
②呋喃沸点为31-32℃,易溶于水;
③无水氯化钙能与醇形成复合物。
(1)步骤①的关键是控制温度,其措施有:
磁力搅拌、______和______。
(2)步骤②中干燥所使用的干燥剂可选用______。
A.98%浓硫酸B.无水硫酸镁
C.无水碳酸钠D.无水氯化钙
(3)呋喃甲酸在A、B、C三种溶剂中溶解度(s)随温度变化的曲线如图:
步骤③提纯时,合适的溶解溶剂是______,其理由______。
(4)利用呋喃甲酸可以制取八甲基四氧杂夸特烯。
①仪器a的名称:
______,装置b的作用:
______,
②脱羧装置中用冰盐浴的目的是______;
③确定产品为八甲基四氧杂夸特烯,可通过测定沸点,还可采用的检测方法有______。
④若用4.5g呋喃甲酸制得了0.5g八甲基四氧杂夸特烯(M=432g·
mol-1),则产率为______(保留4位有效数字)。
4.苯乙酮是一种重要的有机化合物,实验室可用苯和乙酸酐((CH3CO)2O)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
(一)催化剂的制备:
下图是实验室制取少量无水AlCl3的相关实验装置的仪器和药品:
(1)将上述仪器连接成一套制备并保存无水AlCl3的装置,各管口标号连接顺序为:
________
d接e,_______接_______,_________接________,_________接________。
(2)有人建议将上述装置中D去掉,其余装置和试剂不变,也能制备无水AlCl3。
你认为这样做是否可行________(填“可行”或“不可行”),你的理由是_________________。
(二)苯乙酮的制备
苯乙酮的制取原理为:
+(CH3CO)2O+CH3COOH
制备过程中还有CH3COOH+AlCl3CH3COOAlCl2+HCl↑等副反应。
名称
相对分子质量
沸点/℃
密度/(g·
cm-3)
水中溶解性
苯乙酮
120
202.3
1.0
微溶
苯
78
80º
C
0.88
不溶
乙酸酐
102
139℃
能溶于水
主要实验装置和步骤如下:
(Ⅰ)合成:
在三颈瓶中加入20g无水三氯化铝和30mL无水苯。
为避免反应液升温过快,边搅拌边慢慢滴加10.2mL乙酸酐和15.2mL无水苯的混合液,控制滴加速率,使反应液缓缓回流。
滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层。
②水层用苯萃取,分液。
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品。
④蒸馏粗产品得到纯净苯乙酮11g。
回答下列问题:
(3)仪器a的名称:
____;
装置b的作用:
_____________________________。
(4)合成过程中要求无水操作,理由是__________________________________。
(5)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致____。
A.反应太剧烈 B.液体太多搅不动C.反应变缓慢D.副产物增多
(6)分离与提纯操作②的目的是__________________________________________。
(7)本实验中,苯乙酮的产率为_____________。
5.ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。
过氧化氢法制备NaClO2固体的实验装置如图1所示。
2NaClO2+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;
H2O2沸点150℃
请回答:
⑴仪器A的作用是_____;
冰水浴冷却的目的是_____(写出两种)。
⑵空气流速过快或过慢,均降低NaClO2产率,试解释其原因______。
(3)Cl-存在时会催化ClO2的生成。
反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。
该过程可能经两步反应完成,将其补充完整:
①_____(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。
通过图2所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。
该设备的作用是______,馏出物是_______。
(5)抽滤法分离NaClO2过程中,下列操作不正确的是_______
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
6.碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。
制备反应原理为:
LaC13+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;
某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
(l)盛放稀盐酸的仪器为____________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:
F→___→___→___→___→___。
(3)Y中发生反应的化学反应式为________________。
(4)X中盛放的试剂是_____,其作用为________________。
(5)Z中应先通入NH3,后通入过量的CO2,原因为_________。
(6)La2(CO3)3质量分数的测定:
准确称取10.0g产品试样,溶于10.0mL稀盐酸中,加入10mLNH3—NH4Cl缓冲溶液,加入0.2g紫脲酸铵混合指示剂,用0.5mol/LEDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y-=LaY-+2H+),消耗EDTA溶液44.0mL。
则产品中La2(CO3)3的质量分数ω[La2(CO3)3]=_________。
(7)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为_______;
实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,试描述实验过程中观察到的现象为______________。
参考答案
1.分液漏斗Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O防倒吸影响制气干燥气体碱石灰SO22Na+较小2HCOO-+4SO2+CO32-=2S2O42-+H2O+3CO2(HCOO-+2SO2+CO32-+H+=S2O42-+2CO2+H2O)87%
【解析】
(1).①A中盛浓硫酸的玻璃仪器为分液漏斗。
实验室中制备SO2主要采用以下反应Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
②B装置为安全瓶,可防倒吸影响制气,C装置的作用是干燥气体,利用浓硫酸的吸水性,且不与SO2气体反应;
③E的作用是收集尾气,防止SO2气体逸出到空气中,试剂为碱石灰;
(2)①反应后仅SO2中S元素的化合价降低,所以SO2为氧化剂;
生成1molNa2S2O4需要
1molZnS2O4,需要氧化1mol金属Zn,转移电子2mol。
②溶液中加入氯化钠使Na+离子浓度增大,使得Qc(Na2S2O4)增大,促进Na2S2O4结晶析出;
Na2S