高中化学电解池Word格式文档下载.doc
《高中化学电解池Word格式文档下载.doc》由会员分享,可在线阅读,更多相关《高中化学电解池Word格式文档下载.doc(8页珍藏版)》请在冰豆网上搜索。
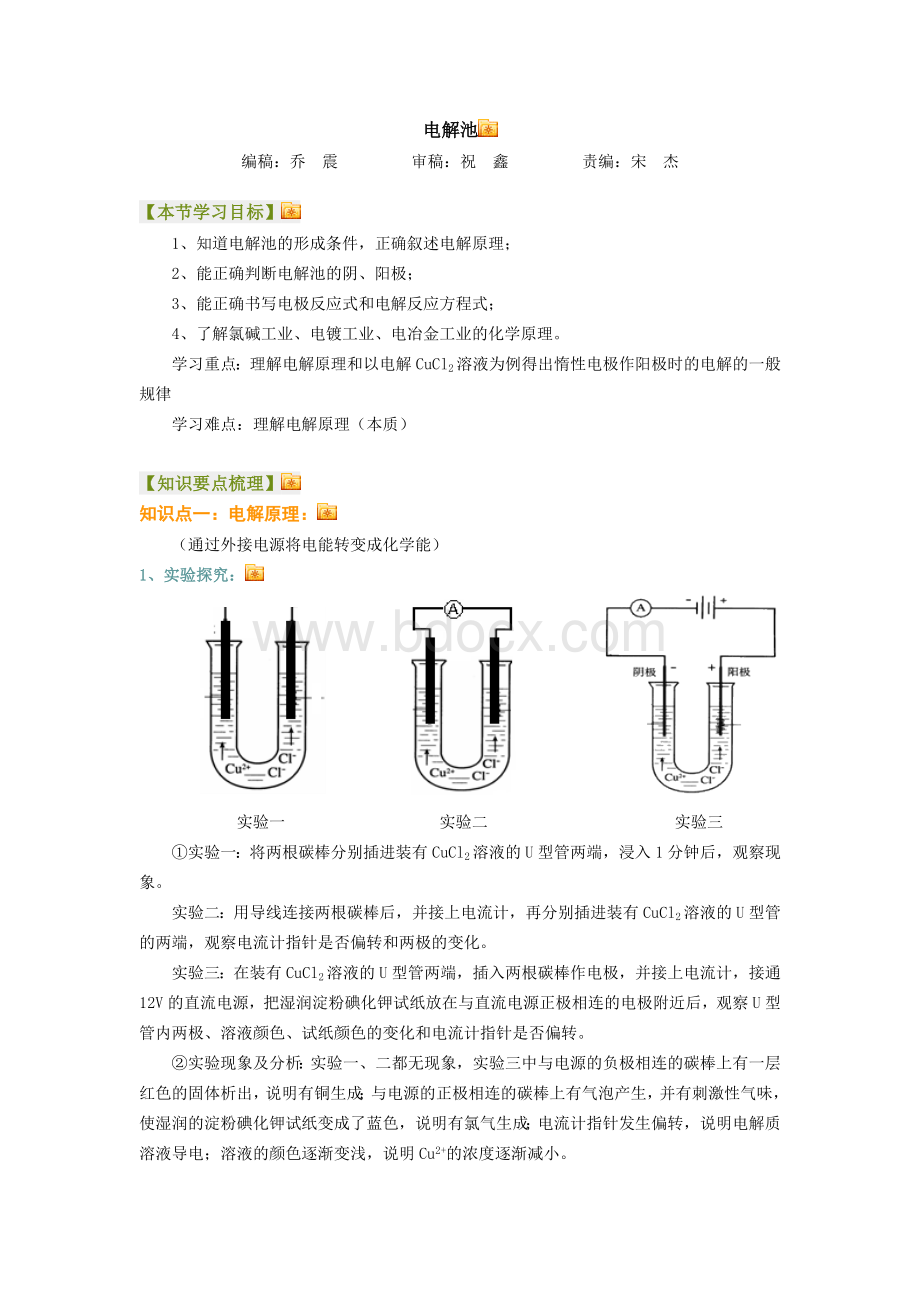
实验二:
用导线连接两根碳棒后,并接上电流计,再分别插进装有CuCl2溶液的U型管的两端,观察电流计指针是否偏转和两极的变化。
实验三:
在装有CuCl2溶液的U型管两端,插入两根碳棒作电极,并接上电流计,接通12V的直流电源,把湿润淀粉碘化钾试纸放在与直流电源正极相连的电极附近后,观察U型管内两极、溶液颜色、试纸颜色的变化和电流计指针是否偏转。
②实验现象及分析:
实验一、二都无现象,实验三中与电源的负极相连的碳棒上有一层红色的固体析出,说明有铜生成;
与电源的正极相连的碳棒上有气泡产生,并有刺激性气味,使湿润的淀粉碘化钾试纸变成了蓝色,说明有氯气生成;
电流计指针发生偏转,说明电解质溶液导电;
溶液的颜色逐渐变浅,说明Cu2+的浓度逐渐减小。
③实验注意事项:
实验完毕后,把沾有浓NaOH溶液的棉花塞在U型管两端,吸收有害气体。
小结:
通过以上三个实验,得出结论:
CuCl2溶液通电时发生了化学变化,生成了Cu和Cl2,电流的作用是这种化学变化的直接原因和动力。
2、电解池:
①电解池的定义:
借助于电流在两极发生氧化还原反应的装置,叫电解池或电解槽。
电解池就是一种把电能转化为化学能的装置。
②电解池的电极名称:
电解池的两极由电极与电源正、负极的连接情况直接判断。
阴极:
与电源的负极相连的电极;
吸引溶液中的阳离子、得电子、还原反应。
阳极:
与电源的正极相连的电极,吸引溶液中的阴离子、失电子、氧化反应。
说明:
阳极有惰性电极和活性电极之分,隋性电极只导电,不参与氧化还原反应(C、Pt、Au);
活性电极既导电又参与氧化还原反应(Cu、Ag等)。
③电解池的组成:
直流电源、电极、电解质溶液或熔融的电解质,用导线连接成闭合电路。
④电解池的工作原理:
在外加直流电源的作用下,使电解质溶液中的离子在阴阳两极引起氧化还原反应的过程,称为电解。
电解质导电的过程就是电解。
电子从电源的负极流向电解池的阴极,溶液中的离子分别向两极做定向移动,阴极吸引溶液中的阳离子Cu2+、H+,Cu2+在阴极上得电子还原为铜;
阳极吸引溶液中的阴离子Cl-、OH-,Cl-在阳极上失电子氧化为氯原子,氯原子结合成氯分子,失去的电子沿导线流回电源正极,从而构成闭合回路。
这就是电解原理。
通电时,阴离子移向阳极,在阳极上失去电子发生氧化反应。
阳离子移向阴极,在阴极得到电子发生还原反应。
通电前:
CuCl2==Cu2++2Cl- H2OH++OH- (电离) 做无规则运动
通电后:
与电源负极相连的碳棒吸引溶液中的阳离子(Cu2+、H+)Cu2++2e-==Cu(发生还原反应)
与电源正极相连的碳棒吸引溶液中的阴离子(Cl-、OH-)2Cl--2e-==Cl2↑(发生氧化反应)
总反应式:
CuCl2Cu+Cl2↑
3、离子的放电顺序:
阴离子失去电子或阳离子得到电子的过程叫放电
①电解通电时,电子从电源的负极沿导线流入电解池的阴极,在阴极区氧化性强的微粒先得电子,被还原。
同时,电子又从电解池的阳流出,沿导线流回电源的正极,即在阳极区还原性强的微粒(包括电极)先失电子被氧化。
②阴极:
阳离子在阴极上的放电顺序(得电子)大体可参照金属活动性顺序来推断。
位于金属活动性顺序表后面的金属,其对应的阳离子越易得到电子。
无论活性电极还是惰性电极都不参加反应,参加反应的是溶液中的阳离子。
Ag+>
Hg2+>
Fe3+>
Cu2+>
H+>
Pb2+>
Sn2+>
Fe2+>
Zn2+>
Al3+>
Mg2+>
Na+>
Ca2+>
K+
位于前边的氧化性强的微粒优先得到电子。
③阳极:
当电极材料(阳极)为Pt或C时,还原性非常弱,此条件不被氧化,称为惰性电极。
当电极材料(阳极)为Cu等金属(除了Pt和C),还原性强,易失电子,易被氧化,称为活性电极。
若阳极是活泼或较活泼金属时,一般是电极的金属失去电子,而不是电解液中阴离子放电。
若阳极是惰性电极时,阴离子在阳极上的放电顺序(失e-)
S2->
I->
Br->
Cl->
OH->
NO3->
SO42-(等含氧酸根离子)>
F-(SO32-/MnO4->
OH-)
位于前边的还原性强的微粒优先失去电子。
(1)活泼金属离子K+、Ca2+、Na+、Mg2+、Al3+在溶液中不会得到电子。
(2)F-、SO42-、CO32-、NO3-等在溶液中不会失去电子。
(3)当离子浓度相差较大时,放电顺序要发生改变,当[Zn2+]>
>
[H+]或[Fe2+]>
[H+]时,Zn2+、Fe2+先得电子而H+后得电子。
(4)石墨和金属铂是惰性电极,不会得失电子。
知识点二:
电解原理的应用
1、电解饱和食盐水:
用一根碳棒作阳极,一根铁棒作阴极,电解饱和食盐水。
溶液中存在的离子有Na+、Cl-、H+、OH-。
根据放电的先后顺序,H+﹥Na+、Cl-﹥OH-,阳极电极反应式为2Cl--2e-=Cl2↑,阴极电极反应式为2H++2e-=H2↑。
总反应式为:
2NaCl+2H2OH2↑+Cl2↑+2NaOH。
其中H2、NaOH是阴极产物,Cl2是阳极产物。
如电解前向溶液中滴加酚酞,随着电解反应的进行,溶液颜色由无色变为红色,两极极板上都有气体产生。
2、铜的电解精炼:
应用电解原理,进行粗铜的提纯。
①粗铜作阳极,纯铜作阴极,用CuSO4溶液(含铜离子的电解质溶液)作电解液。
②电极反应:
阴极:
Cu2++2e-=Cu 阳极:
Cu-2e-=Cu2+
③比铜活泼的金属杂质——以阳离子形式进入溶液中;
比铜不活泼的金属杂质(金银等贵重金属)——形成阳极泥,沉积在阳极底部。
电解精炼铜过程中CuSO4溶液的浓度基本不变
3、电镀铜:
若把阴极精铜棒换成铁棒,电解过程不变,但不是精炼铜了,而叫电镀铜。
①电镀:
应用电解原理在某些金属表面镀上一薄层其他金属或合金的过程。
②电镀材料的选择:
阴极——镀件 阳极——镀层金属 电镀液——含有镀层金属离子的溶液
③电镀过程的特点:
牺牲阳极;
电镀液的浓度(严格说是镀层金属离子的浓度)保持不变;
在电镀的条件下,水电离产生的H+、OH-一般不放电。
④实例:
在铁制品上镀铜:
阳极——铜 阴极——铁制品 电镀液——CuSO4溶液
阴极:
Cu2++2e-=Cu 阳极:
Cu-2e-=Cu2+
注意:
电镀的目的是使金属增强抗腐蚀能力,增加美观和表面硬度,但如果镀层被破坏,会增加金属的腐蚀速率。
4、电冶金:
用来冶炼活泼的金属(适用范围:
活泼金属K~Al)
例:
电解熔融氯化钠:
2NaCl(熔融)2Na+Cl2↑
阳极:
2Cl--2e-=Cl2↑ 阴极:
2Na++2e-=2Na
冶炼铝(Al2O3):
2Al2O34Al+3O2↑
阳极:
6O2--12e-=3O2↑ 阴极:
4Al3++12e-=4Al
工业上用电解熔融氧化铝的方法冶炼铝但不能用AlCl3,原因就是AlCl3是共价化合物,熔融状态下不导电。
[规律方法指导]
一、电解与电离的区别:
电 离
电 解
条件
电解质溶于水或受热熔化状态
电解质电离后再通直流电
过程
电解质电离成为自由移动的离子
阴阳离子定向移动,在两极上失得电子成为原子或分子
特点
只产生自由移动的离子
发生氧化还原反应生成了新物质
联系
电解必须建立在电离的基础上
二、溶液导电与金属导电的区别:
从做定向移动的微粒和是否发生化学变化两个角度比较:
①金属导电是自由电子的定向移动,电解质溶液导电是阴、阳离子的定向移动;
②金属导电是物理变化,电解质溶液导电是非自发的化学变化;
③温度越高,金属导电性越弱、电解质溶液导电性越强;
④电解质溶液电解的过程就是电解质溶液导电的过程,电解质溶液导电的同时必定发生非自发的氧化还原反应。
三、原电池与电解池的比较及判断
原电池
能量转换
化学能转化为电能
电能转化为化学能
离子的迁移方向
阴离子向负极迁移
阳离子向正极迁移
阴离子向阳极迁移
阳离子向阴极迁移
发生氧化反应的电极
负极
阳极(连接电源正极)
发生还原反应的电极
正极
阴极(连接电源负极)
相同点(从原理分析)
都是氧化还原反应
池型的判断:
有外接电源是电解池,无外接电源是原电池;
多池组合时,一般含活泼金属的池为原电池,其余都是在原电池带动下的电解池。
电极的判断:
原电池看电极材料,电解池看电源的正负极连接顺序。
四、电解池电极反应规律(阳氧阴还)
①阴极:
得电子,还原反应。
电极本身不参加反应,一定是电解质溶液中阳离子“争”得电子
②阳极:
失电子,氧化反应。
若为金属(非惰性)电极,电极失电子;
若为惰性电极,电解质溶液中阴离子“争”失电子
五、电解规律:
根据离子的放电顺序,采用惰性电极电解酸碱盐的水溶液时的规律。
1、电解水型:
电解某些含氧酸、强碱及活泼金属的含氧酸盐的水溶液时,实质是电解水。
例:
H2SO4、HNO3、KOH、NaOH、Na2SO4、KNO3、Na2CO3等物质的水溶液。
电解完后加水可使溶液恢复原样。
2H2O2H2↑+O2↑
电解水时加硫酸或氢氧化钠增强导电性,不影响水的电解。
电解硫酸和氢氧化钠时因为氧气溶解度大于氢气,H2和O2之比大于2
2、电解溶质型:
电解不活泼金属无氧酸盐、无氧酸的水溶液时,实质是电解电解质本身。
电解完后加入溶质可使溶液恢复原样。
2HClH2↑+Cl2↑ CuCl2Cu+Cl2↑
3、放氧生酸型:
电解不活泼金属的含氧酸盐的水溶液时,阳极产生氧气,同时生成H+,阴极析出不活泼金属,电解质和水都参加反应。
CuSO4、AgNO3、Cu(NO3)2等物质的水溶液。
2CuSO4+2H2O2Cu+O2↑+2H2SO4 电解完后加入CuO或CuCO3可使溶液恢复原样。
4、放氢生碱型:
电解活泼金属(K、Ca、Na)的无氧酸盐的水溶液时,阴极产生氢气,阳极析出非金属单质,电解质和水都参加反应。
NaCl、KBr、BaCl2等物质的水溶液。
2NaCl+2H2OH2↑+Cl2↑+2NaOH 电解完后加入HCl可使溶液恢复原样。
六、电极反应式的书写
①分析溶液中存在的所有离子(包括水的电离)、并分成阳离子组和阴离子组。
②根据放电规律,阳离子在阴极发生还原反应,而阴离子在阳极发生氧化反应,完成电极反应式。
(注意得失电子守恒)
③由阴阳两电极反应式,合并得总反应式。
若已知