小容量注射剂Word文档下载推荐.docx
《小容量注射剂Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《小容量注射剂Word文档下载推荐.docx(11页珍藏版)》请在冰豆网上搜索。
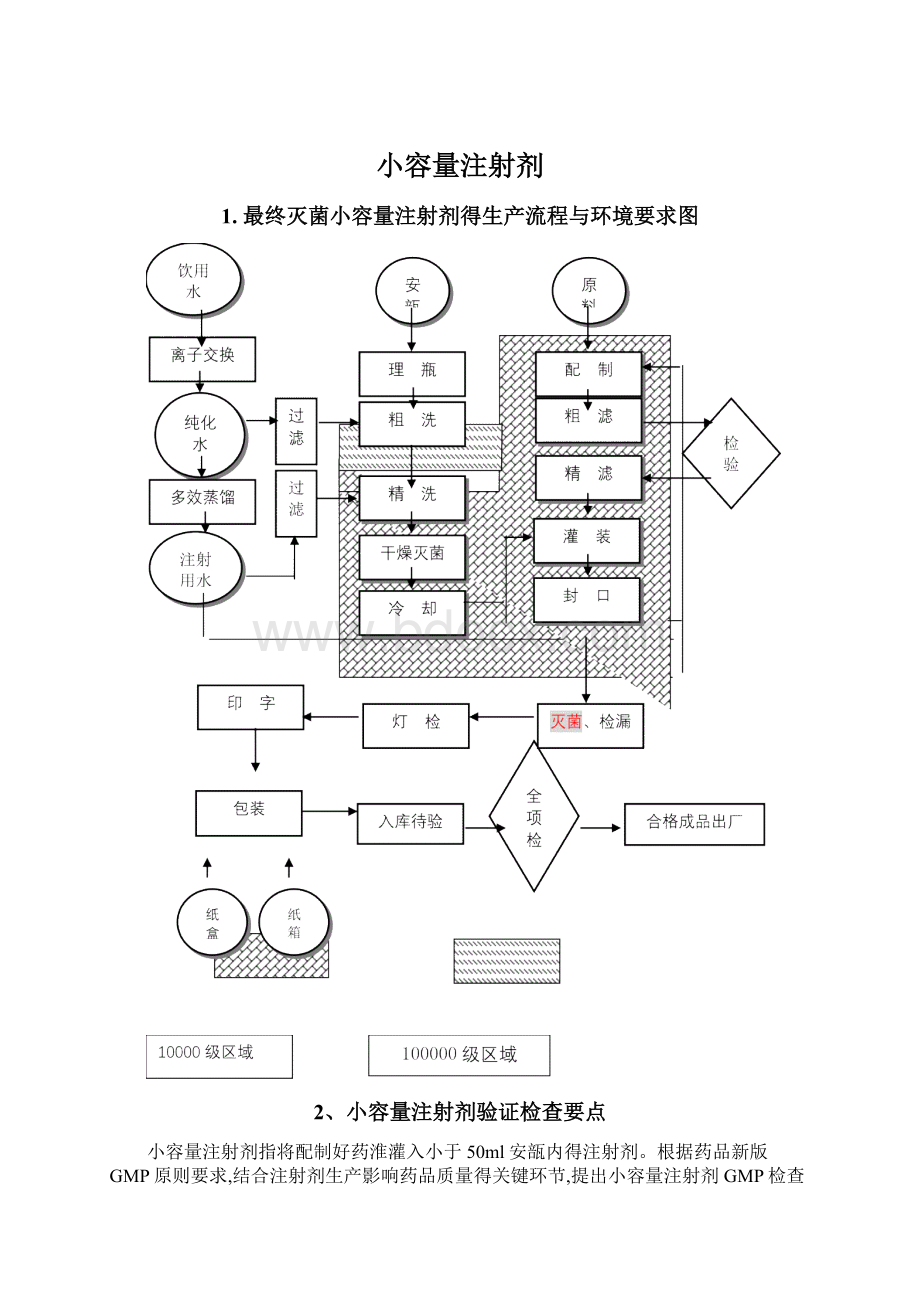
浓配或采用密闭系统得稀配应在100000级洁净区内进行;
稀配、滤过、灌封、直接接触药品得包装材料得最终处理等操作应在10000级洁净区内进行;
物料、中间品应经过物流缓冲间或传递柜进、出洁净区。
称量配料间如产尘应与洁净走廊呈相对负压,必要时设捕尘设施。
中国药典规定:
微生物限度检查、无菌检查应在100级或10000级背景下得局部100级区内进行,并与生产区分开。
微生物限度检查与无菌检查用得实验室与空气净化系统最好彼此分开,以尽可能减少对无菌检查得干扰。
b)空气净化系统
应能确保洁净区得洁净度级别、温湿度、压差等符合生产工艺要求并经过验证。
初效、中效过滤器应明确清洗/更换周期,高效过滤器应定期检测其完整性,如有泄漏或阻塞应及时更换。
空气净化系统应每天24小时运行,停用后再次运行应进行清洁、消毒并经过再验证,符合要求得方可开始生产。
c)与产品直接接触得压缩空气、氮气、二氧化碳等辅助设施
这些气体因与产品直接接触,不得对产品带来污染。
应对系统进行验证。
PQ测试项目包括洁净度级别、含水量、含油量等。
d)注射用水(WFI)系统
以纯化水为原水,经多效蒸馏制得。
制水系统应能提供足够量得符合质量要求得注射用水。
注射用水制备与分配系统材质应无毒、耐腐蚀,设计与安装应避免死角与盲管;
储罐应密闭,并安装有经完整性检查合格得无菌级别得疏水性过滤器,设有保温装置;
管道通过卡箍连接,有一定得倾斜度,最地位出水,阀门用隔膜阀而不就是球阀;
注射用水得储存应采用80oC以上保温或65oC以上保温循环,应有温度控制与指示装置;
设有必要得取样口包括注射用水储罐得入水口、总出水口与总回水口,并便于取样;
储罐、增压泵、管道可以排空便于清洁、消毒或灭菌。
e)纯蒸汽系统
纯蒸汽通常用于与产品接触物品得灭菌及产品得最终灭菌,质量应符合要求,纯蒸汽系统应经过验证并定期监测。
f)实验动物房
应与其她区域严格分开,实验动物应符合国家有关规定。
3、设备
a)配制系统
称量用秤得精度应符合物料得称量要求,并定期校验,贴有合格标志。
配制罐体积应与生产批量相匹配,材质应符合要求,禁用铁类容器或露铁搪瓷桶,配有搅拌、降温等装置,可定容。
配制罐宜自带称量系统或液位电极、或液位标尺,如采用玻璃液位管应能拆卸,以便清洗。
因配制需要在低于30℃、CO2饱与得注射用水溶解原辅料,应有有效得控温装置,CO2输送管道终端应连有0、45μm或精度更高得疏水性过滤器。
配有粗滤所需要得0、45μm过滤器。
配有终端过滤所需要得2个0、22μm过滤器及过滤器完整性测试设备。
过滤器得安装应符合工艺要求,一个0、22μm得过滤器应可能接近灌封机(欧盟无菌药品附录要求),与产品直接接触得过滤器材质应不得吸附药液组分与释放异物(应有验证数据支持)。
反复使用得过滤芯应灭菌干燥后保存,并规定有灭菌有效期与使用次数。
配制系统宜采用密闭系统,并配有自动清洗、消毒或灭菌装置。
管道通过卡箍连接,使用结束应能排空。
b)洗、烘、灌封联动线
洗瓶机:
应安装在100000级洁净区。
洗安瓿能力应能满足工艺需要,洗净后安瓿得清洁度符合要求。
隧道烘箱:
应安装在100000级洁净区,分为预热、高温、冷却三个部分,应有温度记录装置,应有传送速度显示仪,温度控制仪与温度记录装置应分开。
传送带不得穿越十万级与万级区域,应分段。
定期检测隧道烘箱内洁净度与风速,如:
尘埃粒子、沉降菌等数据。
高效过滤器应定期或根据两端压差得变化情况进行更换,更换后应进行检漏试验。
灌封系统:
应安装在10000级洁净区,能有效控制装量,灌装过程中药液无溅壁现象,安瓿封口完好。
灌装头、灌装管道等灌装器具应按规定得程序清洁、消毒或灭菌。
控制与显示关键参数得仪表如:
温度,传送速度应经过定期校验,并贴有合格校验标签。
c)灭菌设备
用高压灭菌釜对产品进行湿热灭菌得方法包括冷空气重力置换法、预真空法、脉冲真空法、蒸汽-空气与蒸汽-水-空气灭菌法、过热水浸没灭菌法。
企业应根据产品特性选择合适得灭菌设备,能满足产品得最终灭菌与生产用器具得灭菌要求。
灭菌设备应具灭菌温度、时间自动监测、记录装置,其能力应与生产批量相适应。
仪表经过校验,并贴有校验合格标志。
直接与产品接触得器具与产品得灭菌应用纯蒸汽。
检漏用色水宜经过灭菌处理。
d)文件
每台主要设备都应建立设备使用标准操作程序(SOP)、清洁、消毒或灭菌标准操作程序、维护保养标准操作程序、使用记录与设备档案。
4、物料得管理要点及检查重点
a)物料得采购
应由具有产品专业知识得人员负责,从企业质量审计合格得供应商处采购。
内包装材料为低硼硅玻璃安瓿,应符合国家药用包装容器(材料)标准,标准号:
国家药用包装容器(材料)标准(试行)YBB00332002。
b)原辅料得检验、贮存及分发
物料应保存于企业规定得适宜得环境中并有明确得标识,质控部门应按批取样、检验、签发。
取样应具有代表性,样品应按企业内控标准进行检验。
原辅料应经质量部门签发后在有效期内使用。
不合格得原辅料不得用于生产。
c)包装材料
低硼硅玻璃安瓿经检验合格后方可投入使用。
药品标签与说明书应与药品监督管理部门批准得内容、式样、文字相一致,经企业质量管理部门校对无误后印制、发放、使用。
标签发放、使用、销毁应有记录。
d)不合格品
不合格物料、产品应专区存放,应有易于识别得明显标志,并按有关规定及时处理,并有记录。
对不合格产品应查明原因并采取必要得纠正措施。
e)退回产品、收回产品
应按相关程序处理并作适当记录。
5、验证得管理要点及检查重点
a)HVAC系统及洁净室得验证
新车间应进行前验证,包括IQ、OQ与PQ,车间运行一定时间或停止运行后再次使用前应进行再验证。
验证测试项目应重点检查洁净度级别(尘埃粒子、微生物)、高效过滤器完整性(DOP)、压差、温、湿度(应能满足生产工艺要求)、局部100级区得气流流型、洁净室得清洁及消毒措施等。
b)压缩空气、氮气、二氧化碳等辅助系统得验证
新系统应进行前验证,包括IQ、OQ与PQ,系统运行一定时间后应进行再验证。
气体储存及分配系统材质应无毒,并设终端过滤器。
验证测试项目应包括洁净度级别(尘埃粒子、微生物)、含水量、含油量等。
c)注射用水系统得验证
新得注射用水系统应进行前验证,包括IQ、OQ与PQ。
注射用水储罐与分配系统选用材质应无毒、耐腐蚀,管道得设计与安装应避免了死角、盲管,储罐应安装有疏水性过滤器,储罐与管道应能排空,注射用水及分配系统得保温效果应能达到设计要求(80oC以上保温或65oC以上保温循环)。
注射用水质量应不低于中国药典(2005年版)注射用水质量标准,验证测试时间应不少于3周,并应监测季节变化对水质得影响。
企业应根据验证结果规定注射用水系统得清洗、灭菌周期。
企业应制定注射用水系统监测计划,包括对微生物、内毒素、理化指标,并按计划对水质进行监测并有完整记录,鼓励企业做趋势分析、年度回顾。
d)洗、烘、灌封联动机组得验证
洗瓶机清洗安瓿后得洁净程度(清洗后往安瓿中加入注射用水,振摇后检查澄明度与不溶性颗粒)。
隧道烘箱高效过滤器得完整性与隧道烘箱内洁净度级别、隧道烘箱空载热分布、负载热穿透试验以及微生物挑战试验。
灌装机装量准确性、灌装后安瓿熔封效果等。
e)湿热灭菌工艺得验证
中国药典(2005年版)要求,对热稳定得产品,可采用过度杀灭法,其无菌保证水平(SAL)应≤10-12,热稳定较差产品得标准灭菌时间F0一般不低于8分钟,此情况下,应在生产全过程中,对产品中污染得微生物严加监控,并采取各种措施降低微生物污染水平,确保被灭菌产品达到无菌保证要求。
在注射液生产中,产品得最终灭菌与与产品直接接触得器具如过滤器得灭菌等采用湿热灭菌。
该产品最终灭菌得工艺参数为121°
C20分钟。
进行灭菌验证时,被灭菌物品得数量与装载方式、灭菌温度与时间或F0必须在验证方案中明确规定,至少进行3次空载热分布试验,每种装载方式都至少进行3次负载热穿透试验,并选用合适得生物指示剂。
空载热分布试验与负载热穿透试验至少用12个热电偶,应有热电偶分布示意图,热电偶在每次使用前后均应进行校正。
121°
C蒸汽灭菌通常选用中嗜热脂肪芽孢杆菌作为生物指示剂。
验证过程中应考虑灭菌参数得上限与下限,保证灭菌效果与产品质量。
f)工艺验证
工艺验证应在洁净室系统、压缩空气及氮气系统、工艺用水系统、热力灭菌系统、检测方法等验证合格且人员经相关培训考核合格后进行。
应连续3批产品验证合格。
验证得批量应与工艺规程规定得相同,关键工艺控制参数如配制工序中得pH值、温度、搅拌时间、隧道烘箱灭菌温度及安瓿输送带速度、灌装工序中得装量、最终灭菌得温度及时间等就是应在工艺规程规定得范围之内。
采集得用于检验得样品应足够,能反映整批产品得质量。
如检查安瓿就是否清洗干净时,应在清洗安瓿得前、中、后期取样对安瓿得洁净度进行检查;
检查装量时,应在灌装得前、中、后期采集了足够得样品并分别进行检验;
成品应按灭菌柜次取样并分别作无菌试验等。
工艺验证应包括最差条件,如从配制到灌装或灭菌得时间间隔要求、灌装期间进入灌装间人员得数量、设备出现故障时进行必要得检修等。
灌装期间应对灌装间进行微生物监测,监测结果应作为产品放行审核得一部分。
变更控制与偏差管理应符合规定,对出现得偏差应进行了调查与记录等。
g)清洁验证
不同产品共用生产设备,或产品不稳定生成了降解产物,或清洁过程引入了外来物质如清洁剂等,应进行清洁验证。
清洁验证就是对某一具体得清洁程序进行验证。
重点检查清洁程序得可操作性、清洁过程中就是否引入了外来物质、允许残留量计算得依据、化学残留量检测方法得灵敏度、就是否考虑了所有共用设备、管道中得残留等。
清洁验证判断标准应包括目测、漂洗液取样检验与棉签擦拭取样检验。
棉签擦拭取样检验应做回收率试验作为取样、检测方法得依据。
清洁验证通常与工艺验证同时进行,并应包括最差条件如产品批量、生产完成后到清洁得时间间隔、清洁液用量等。
h)检验方法验证
采用药典未收载得检验方法时,应进行检验方法验证。
检验方法验证内容应包括准确度、精密度、专属性、检测限、定量限、线性、范围、耐用性等。
微生物限度检查与无菌试验方法得验证过程与内容应符合《中国药典》得指导原则。
i)验证文件
验证文件应包括验证主计划、验证方案、SOP、验证报告。
验证计划应明确验证项目、验证顺序、组织机构职责等,验证方案应包括验证目得、范围、职责、方法、接受标准、相关文件、变更控制及再验证等,SOP应具体,具有可操作性,验证报告应汇总验证全过程、结果、结论及建议等。
6、生产管