高中化学 第四章 金属及其化合物章末复习学案 新人教版必修11Word格式.docx
《高中化学 第四章 金属及其化合物章末复习学案 新人教版必修11Word格式.docx》由会员分享,可在线阅读,更多相关《高中化学 第四章 金属及其化合物章末复习学案 新人教版必修11Word格式.docx(26页珍藏版)》请在冰豆网上搜索。
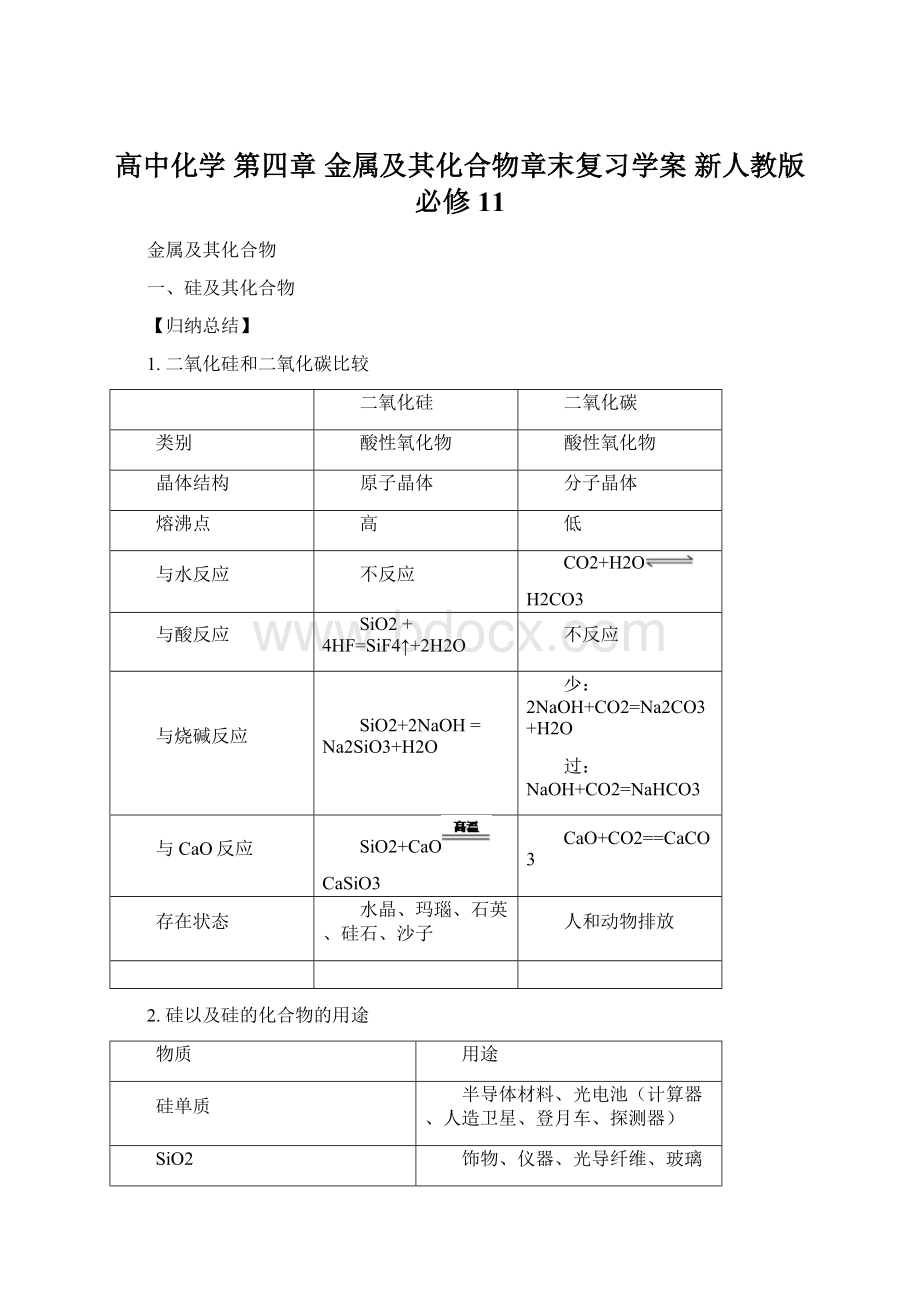
过:
NaOH+CO2=NaHCO3
与CaO反应
SiO2+CaO
CaSiO3
CaO+CO2==CaCO3
存在状态
水晶、玛瑙、石英、硅石、沙子
人和动物排放
2.硅以及硅的化合物的用途
物质
用途
硅单质
半导体材料、光电池(计算器、人造卫星、登月车、探测器)
SiO2
饰物、仪器、光导纤维、玻璃
硅酸钠
矿物胶
SiC
砂纸、砂轮的磨料
【题型过关】
例题1下列叙述中,正确的是( )
A.自然界中存在大量的单质硅
B.石英、水晶、硅石的主要成分都是二氧化硅
C.二氧化硅的化学性质活泼,能跟酸或碱溶液发生化学反应
D.自然界中二氧化硅都存在于石英中
答案
解析
B
自然界中硅元素含量很高,但都以化合态形式存在,A项错误;
硅元素是亲氧元素,主要以氧化物和硅酸盐的形式存在,D项错误;
二氧化硅的性质稳定,C项错误
例题2制备硅单质时,主要化学反应如下:
①SiO2(石英砂)+2C(焦炭)
Si(粗硅)+2CO↑;
②Si(粗硅)+2Cl2
SiCl4;
③SiCl4+2H2
Si(纯硅)+4HCl,下列对上述三个反应的叙述中,不正确的是( )
A.①③为置换反应B.①②③均为氧化还原反应
C.②为化合反应D.三个反应的反应物中硅元素均被还原
D
在反应②中Si元素化合价升高,被氧化
例题3将过量的CO2分别通入:
①CaCl2溶液 ②浓Na2SiO3溶液 ③Ca(OH)2溶液 ④饱和Na2CO3溶液。
最终溶液中有白色沉淀析出的是( )
A.①②③④B.②④C.①②③D.②③
CO2溶于水:
CO2+H2O
H2CO3,H2CO3的酸性比盐酸弱,而比硅酸强。
根据酸与盐反应的规律,CO2通入CaCl2溶液无明显现象;
过量的CO2通入浓Na2SiO3溶液中有白色沉淀H2SiO3生成;
CO2通入Ca(OH)2溶液至过量,Ca(OH)2+CO2===CaCO3↓+H2O,CaCO3+H2O+CO2===Ca(HCO3)2,最终生成Ca(HCO3)2而无沉淀;
过量CO2通入饱和Na2CO3溶液中:
Na2CO3+H2O+CO2===2NaHCO3↓,生成的NaHCO3溶解度比Na2CO3溶解度小而结晶析出,故选B
例题4下图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是( )
A.SiO2属于两性氧化物B.酸性:
H2SiO3>H2CO3
C.硅胶吸水后可重复再生D.图中所示转化反应都是氧化还原反应
C
SiO2是酸性氧化物;
酸性:
H2CO3>H2SiO3;
图中有的转化反应不是氧化还原反应,如SiO2与NaOH溶液的反应
二、氯气的性质
1.液氯、新制的氯水和久置的氯水比较
液氯
新制氯水
久置氯水
分类
纯净物
混合物
颜色
黄绿色
无色
成分
Cl2
Cl2、H2O、HClO、H+、Cl―、ClO―、极少量的为OH―
H+、Cl―、H2O、极少量的OH―
性质
氧化性
氧化性、酸性、漂白性
酸性
2.氯气的性质
与金属钠反应方程式
2Na+Cl2
2NaCl
与金属铁反应方程式
2Fe+3Cl2
2FeCl3
与金属铜反应方程式
Cu+Cl2
CuCl2
与氢气反应方程式
H2+Cl2
2HCl;
2HCl
与水反应方程式
H2O+Cl2=HCl+HClO
制漂白液反应方程式
Cl2+2NaOH=NaCl+NaClO+H2O
制漂白粉反应方程式
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
实验室制法
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
氯离子的检验
Ag++Cl―==AgCl
例题5新制备的氯水,显________色,说明氯水中有________分子存在。
向氯水中滴入几滴AgNO3溶液,立即有________生成,说明氯水中有________存在。
蓝色石蕊试纸遇到氯水后,首先变红,但很快又褪色,这是因为_____________________。
氯水经光照后,颜色逐渐消失,并放出无色________,该反应的化学方程式为____________________。
浅黄绿 Cl2 白色沉淀 Cl- 溶液中有H+显酸性,HClO又有漂白性而使试纸褪色 O2 2HClO
2HCl+O2↑
新制备的氯水中溶解的Cl2使其显浅黄绿色。
新制备的氯水中含有Cl-,当加入AgNO3溶液时,会发生反应:
Ag++Cl-===AgCl↓;
蓝色石蕊试纸遇氯水变红,说明有H+存在,很快褪色,则是因为HClO起漂白作用;
HClO不稳定,见光易分解放出O2
例题6新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。
请设计实验证明有O2生成____________。
(2)氯气能使湿润的红色布条褪色。
对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。
请你设计实验,得出正确结论。
提出问题
收集资料
提出假设
验证假设
得出结论
氯水中何种物质能使湿润的红色布条褪色
①氯气有强氧化性
②氯气与冷水反应生成盐酸和次氯酸
③次氯酸有强氧化性
①_________
②____________
③____________④H2O使布条褪色
实验①:
把红色干布条放入充满氯气的集气瓶中,布条不褪色;
实验②:
_____实验③:
把红色布条放在水里,布条不褪色
(1)将盛满氯水的无色矿泉水瓶倒置在水槽中,光照一段时间后,瓶底有无色气体生成。
将瓶子倒转过来,把带火星的木条放在瓶口,若木条复燃,证明HClO分解生成的气体为氧气
(2)提出假设:
①氯气使红色布条褪色 ②HClO使红色布条褪色 ③盐酸使红色布条褪色
验证假设:
②把红色布条伸入稀盐酸中,红色布条不褪色
结论:
次氯酸使红色布条褪色
(1)要证明O2的生成,应用带火星的木条检验,能使带火星的木条复燃,说明生成了O2。
O2的收集,结合教材实验,是用盛满氯水的瓶子倒置在水槽中,光照一段时间后,收集到无色气体来验证。
(2)提出假设是根据收集到的资料结合所学知识进行的。
氯气有氧化性,那么假设氯气使红色布条褪色,氯气和水生成盐酸和次氯酸,假设盐酸或次氯酸能使红色布条褪色,实验②把红色布条放到稀盐酸中,红色布条不褪色。
氯水中的氯气、稀盐酸、水均不能使红色布条褪色,说明是HClO使红色布条褪色
例题7氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是_______________。
(2)某学习小组利用此原理设计如图所示的装置制取氯气。
①在该实验中,制取氯气的装置是________(填字母)。
②C装置中盛放饱和氯化钠溶液,其作用是_____________________。
③D装置的作用是干燥氯气,其中盛放的试剂是________________。
④该实验存在明显的缺陷,改进的方法是____________________________。
(1)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(2)①c ②除去氯气中的氯化氢 ③浓硫酸 ④在E装置后连接一个盛有氢氧化钠溶液的洗气瓶(合理即可)
实验室用二氧化锰和浓盐酸反应制取氯气的反应原理是MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,该反应是固体和液体需要加热的反应,故选c装置制取氯气。
因为氯化氢易挥发,制取的氯气中含有杂质氯化氢,还有水蒸气,所以要得到干燥纯净的氯气,应先通过饱和氯化钠溶液,除去氯气中的氯化氢,再通过浓硫酸干燥氯气,最后为防止氯气污染环境,要用氢氧化钠溶液吸收尾气
例题8如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞),可以制取氯气,并进行氯气的性质和用途的验证。
试回答下列问题:
(1)乙中的现象是________________________,丙中的现象是______________________,丁中的现象是________________________,分离丁中液体的方法是____________;
(2)橡皮管连通后,分液漏斗的气体压强p1与烧瓶中的气体压强p2的关系为________(填“>
”“<
”或“=”),连接橡皮管的目的是________________________;
(3)烧瓶内发生反应的离子方程式为________________________。
(1)干燥的红布条不褪色 湿润的红布条褪色 下层CCl4层呈紫红色 分液
(2)p1=p2 有利于分液漏斗中的浓盐酸顺利流下
(3)MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
利用图示装置制得的Cl2通过浓H2SO4(甲中),浓H2SO4干燥Cl2;
Cl2与干红布条不反应(乙中);
Cl2与H2O生成HClO,HClO起漂白作用(丙中);
Cl2与KI溶液反应生成I2,CCl4萃取I2,溶液分层(丁中);
用向上排空气法收集Cl2(戊中);
进行尾气吸收(己中),利用针头连接后,分液漏斗与烧瓶内气压相等,有利于液体流下
三、硫及其化合物
1.二氧化硫的性质:
物理性质
颜色状态
密度
毒性
无色气体
比空气大
有毒
化学性质
SO2+H2O
H2SO3
SO2+2NaOH=Na2SO3+H2O
Na2SO3+SO2+H2O=2NaHSO3
SO2+NaOH=NaHSO3
漂白性
漂白原理:
能跟某些有色物质生成不稳定的无色物质
吸附漂白:
活性炭
氧化漂白:
HClO、O3、Na2O2
还原性
与氧气反应
2SO2+O2
2SO3
与氯水反应
SO2+Cl2+2H2O=H2SO4+2HCl
与硫化氢反应
SO2+2H2S=3S↓+2H2O
2.浓硫酸的特性:
浓硫酸是无色油状液体,难挥发,与水以任意比混溶,溶解时放出大量热。
实验室稀释浓硫酸时应将浓硫酸沿容器内壁缓缓注入水或溶液中,并用玻璃棒不断搅拌
特性
吸水性
浓硫酸的吸水性是指浓硫酸有吸收游离的水份的性能,不仅能吸收空气中、物质表面的水,还能夺取结晶水合物中的结晶水。
浓硫酸常做干燥剂,可以干燥中性、酸性的且无还原性的气体,不能干燥如NH3、H2S等气体
脱水性
硫酸的脱水性是指浓硫酸可以使许多有机物中的氢、氧原子按2:
1的比例,形成水分子而脱去
强氧化性
在常温下遇铁、铝则发生钝化
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
C+2