物质的制备.docx
《物质的制备.docx》由会员分享,可在线阅读,更多相关《物质的制备.docx(31页珍藏版)》请在冰豆网上搜索。
物质的制备
物质的制备第2课时
一.选择题(共16小题)
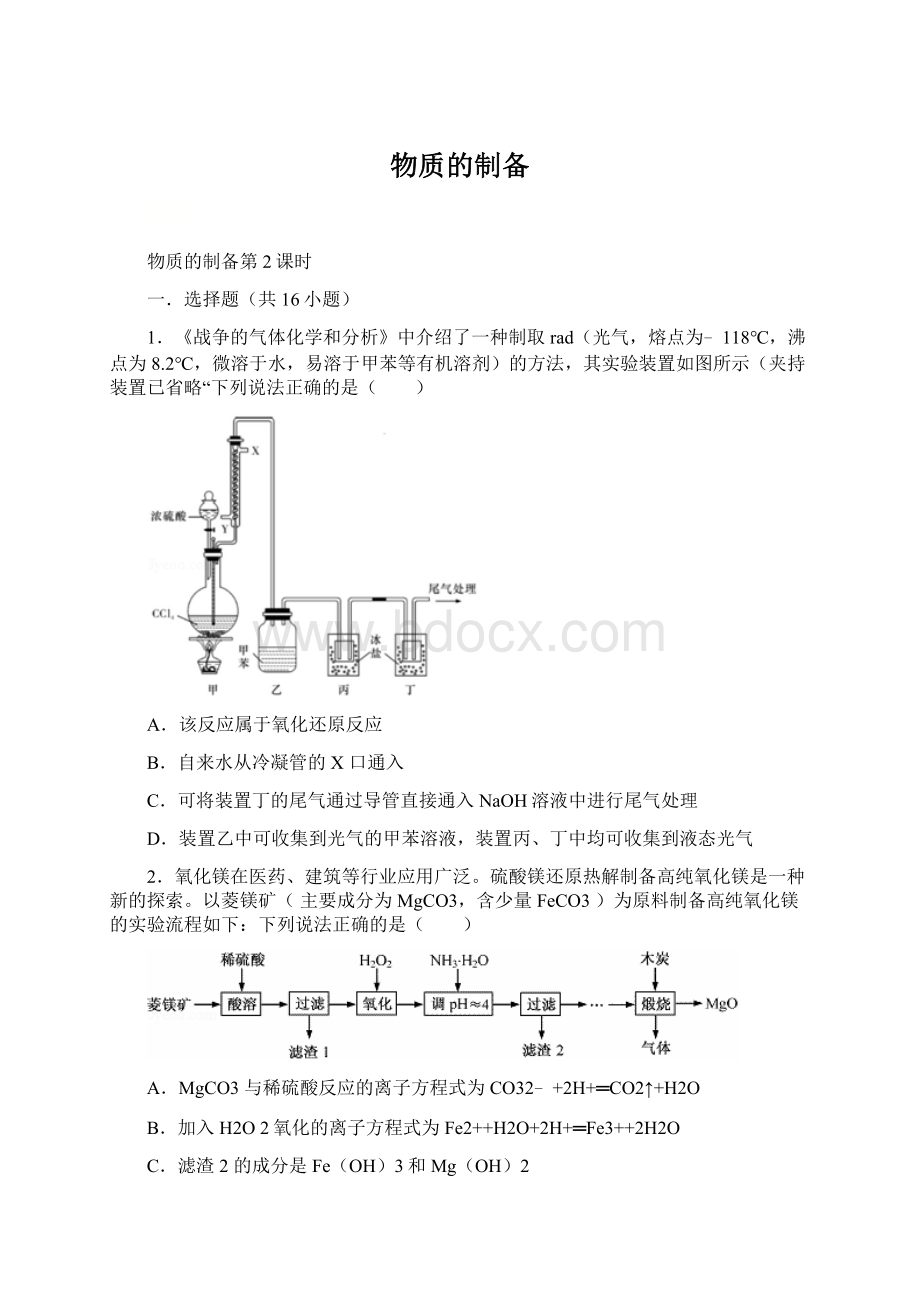
1.《战争的气体化学和分析》中介绍了一种制取rad(光气,熔点为﹣118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)的方法,其实验装置如图所示(夹持装置已省略“下列说法正确的是( )
A.该反应属于氧化还原反应
B.自来水从冷凝管的X口通入
C.可将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理
D.装置乙中可收集到光气的甲苯溶液,装置丙、丁中均可收集到液态光气
2.氧化镁在医药、建筑等行业应用广泛。
硫酸镁还原热解制备高纯氧化镁是一种新的探索。
以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
下列说法正确的是( )
A.MgCO3与稀硫酸反应的离子方程式为CO32﹣+2H+═CO2↑+H2O
B.加入H2O2氧化的离子方程式为Fe2++H2O+2H+═Fe3++2H2O
C.滤渣2的成分是Fe(OH)3和Mg(OH)2
D.流程图中过滤与煅烧之间有一系列的实验操作,最后得到MgSO4•7H2O晶体,对MgSO4•7H2O晶体直接加热可以得到无水MgSO4固体
3.利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:
下列说法错误的是( )
A..向大气中排放SO2可能导致酸雨发生
B..中和器中发生反应的离子方程式为HSO3﹣+OH﹣═SO32﹣+H2O
C..进入离心机的分散系是悬浊液
D.检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
4.氮化锂(Li3N)常作固体电解质和催化剂,遇水蒸气剧烈反应生成氢氧化锂和氨气。
某实验小组用一瓶氮气样品制备纯净的氮化锂的装置如图所示。
已知:
连苯三酚碱性溶液能定量吸收少量O2,氯化亚铜盐酸溶液能定量吸收少量CO生成Cu(CO)Cl•H2O且易被O2氧化;在加热条件下,CO2与锂发生剧烈反应。
下列说法正确的是( )
A.干燥管e中试剂为无水CuSO4,用于检验氮气中的水蒸气
B.为了减少气体用量,先点燃酒精灯再通入氮气
C.a、C中试剂分别为连苯三酚碱性溶液、浓硫酸
D.a装置可以换成盛装赤热铜粉的硬质玻璃管
5.某学生的实验报告中,描述合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20gNaCl
C.用25mL碱式滴定管量取出15.00mLKMnO4溶液
D.用25mL碱式滴定管做酸碱中和滴定实验时,共用去某浓度的碱溶液21.70mL
6.ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示:
下列说法不正确的是( )
A.步骤a的操作包括过滤、洗涤和干燥
B.工业上可将ClO2制成NaClO2固体,便于贮存和运输
C.吸收器中生成NaClO2的离子方程式:
2ClO2+H2O2=2ClO2+O2↑+2H+
D.通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
7.氮化镁常用于制备其它超硬、高导热、耐高温的氮化物,实验室用以下装置制取氮化镁。
已知:
Mg+2NH3
Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。
下列说法不正确的是( )
A.实验开始时应先点燃乙处酒精灯,再点燃丁处酒精灯
B.装置乙的目的是制备N2
C.装置丙与装置戊可以对调
D..取装置丁所得固体少许,滴人少量蒸馏水,可检验是否有Mg3N2
8.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O
9.实验室制备硝基苯(难溶于水,密度比水大的油状液体)的反应原理为:
下列关于硝基苯的制备和纯化的装置不正确的是( )
A.
浓硫酸与浓硝酸混合
B.
制备硝基苯
C.
用氢氧化钠溶液分离硝基苯中混有的酸
D.
分离硝基苯中混有的苯
10.下列实验操作正确的是( )
实验
操作
A
证明某溶液中存在Fe2+
先加少量氯水,再滴加KSCN溶液,出现血红色
B
测定熔融苛性钠的导电性
在瓷坩埚中熔化氢氧化钠固体后进行测量
C
证明氯的非金属性大于碳
向碳酸钙中滴加盐酸,有气泡产生
D
制备氯化镁固体
将MgCl2晶体在氯化氢的气流中加热
A.AB.BC.CD.D
11.对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )
A.实验Ⅰ:
产生红褐色沉淀
B.实验Ⅱ:
溶液颜色变红
C.实验Ⅲ:
放出大量气体
D.实验Ⅳ:
先出现白色沉淀,后溶解
12.实验室中某些气体的制取、收集及尾气处理装置如图所示(夹持和净化装置省略)。
仅用以下实验装置和表中提供的物质完成相关实验,最合理的选项是( )
选项
a中的液体
b中的物质
c中收集的气体
d中的液体
A
浓氨水
碱石灰
NH3
H2O
B
浓硝酸
Cu
NO2
H2O
C
浓硫酸
Na2SO3
SO2
NaOH溶液
D
稀硝酸
Cu
NO
NaOH溶液
A.AB.BC.CD.D
13.
选项
实验操作和现象
结论
A
某溶液
生成使石灰水变浑浊的无色气体
原溶液中一定含有CO32﹣
B
用湿润的pH试纸测某碱液的pH,测定值偏小
混润的pH试纸测量任何溶液都会产误差
C
将浓硫酸倒入蔗糖中搅拌蔗糖迅速变黑并伴有刺激性气味
浓硫酸具有脱水性和强氧化性
D
将乙烯和苯分别加入到溴水中,都能使溴水层褪色
乙烯和苯分子中都含有碳碳双键
A.AB.BC.CD.D
14.关于下图中各装置的叙述错误的是( )
A.装置①可用于制取NH3
B.装置②可用于制取NH3
C.装置③可用于吸收多余的NH3
D.装置④可用于吸收多余的NH3
15.下列化学实验操作或事故处理方法不正确的是( )
A.浓盐酸沾到皮肤上时,立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液
B.酒精灯不慎碰倒起火时,可用水泼灭
C.强碱溶液沾到皮肤上时,立即用大量水冲洗,再涂上硼酸溶液
D.CO气体有毒,处理CO尾气时可将其点燃,转化为无毒的CO2
16.用右图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
气体
a
b
c
A
Cl2
浓盐酸
MnO2粉末
NaOH溶液
B
SO2
浓硫酸
Cu
酸性KMnO4溶液
C
NH3
浓氨水
生石灰
碱石灰
D
CO2
稀硫酸
Na2CO3粉末
浓硫酸
A.AB.BC.CD.D
二.填空题(共6小题)
17.磺酰氯(SO2Cl2)主要用作氯化剂或氯磺化剂,也用于制造医药品、染料、表面活性剂等,熔、沸点分别为﹣54.1℃和69.2℃。
(1)SO2Cl2中S的化合价为 ,SO2Cl2在潮湿空气中发生剧烈反应,散发出具有刺激性和腐蚀性的“发烟”,该反应的化学方程式为 。
(2)拟用干燥的SO2和Cl2通入如图装置(省略夹持装置)制取磺酰氯。
①仪器A的名称为 ,通水方向为 (填“a→b”或“b→a”),装置B的作用是 。
②反应装置中的活性炭的作用可能为:
。
③若SO2和Cl2未经干燥,就通入装置中,也散发出具有刺激性和腐蚀性的“发烟”,该反应的化学方程式为 。
④滴定法测定磺酰氯的纯度:
取1.800g产品,加入到100mL0.5000mol•L﹣1NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol•L﹣1标准HCl溶液滴定至终点,重复实验三次取平均值,消耗10.00mL.达到滴定终点的现象为 ,产品的纯度为 。
18.金属蚀刻加工过程中,常用盐酸对其表面氧化物进行清洗,会产生酸洗废水。
pH在1.5左右的某酸洗废水中含铁元素质量分数约3%,其他金属元素如铜、镍、锌、铬浓度较低,工业上综合利用酸洗废水可制备三氯化铁。
制备过程如下:
相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物
Fe(OH)3
Cu(OH)2
Ni(OH)2
Zn(OH)2
Cr(OH)3
Fe(OH)2
开始沉淀的pH
1.5
4.2
7.1
5.4
4.3
7.6
沉淀完全的pH
3.7
6.7
9.2
8.0
5.6
9.6
回答下列问题:
(1)“中和”时发生反应的化学方程式为 ,调节pH至 范围,有利于后续制备得纯度较高的产品。
(2)酸溶处理中和后的滤渣,使铁元素浸出。
滤渣和工业盐酸反应时,不同反应温度下铁浸出率随时间变化如图(a)所示,可知酸溶的最佳温度为 。
按照不同的固液比(滤渣和工业盐酸的投入体积比)进行反应时,铁浸出率随时间变化如图(b)所示,实际生产中固液比选择1.5:
1的原因是 。
(3)氧化时,可选氯酸钠或过氧化氢为氧化剂,若100L“酸溶”所得溶液中Fe2+含量为1.2mol•L﹣1,则需投入的氧化剂过氧化氢的质量为 。
(4)氧化时,除可外加氧化剂外,也可采用惰性电极电解的方法,此时阴极的电极反应式为 ,电解总反应的离子方程式是 。
(5)将得到的FeCl3溶液在HCl气氛中 、过滤、洗涤、干燥得FeCl3•6H2O晶体。
19.三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。
制三氯化铬的流程如下:
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是 。
(3)用如图装置制备CrCl3时,主要步骤包括:
①将产物收集到蒸发皿中;
②加热反应管至400℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;
③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;
④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;
⑤停止加热CCl4,继续通入氮气;
⑥检查装置气密性。
正确的顺序为:
⑥→③→ 。
(4)已知反应管中发生的主要反应有:
Cr2O3+3CCl4→2CrCl3+3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。
移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72﹣存在,再加入