专题七分布系数图及溶液中粒子浓度关系.docx
《专题七分布系数图及溶液中粒子浓度关系.docx》由会员分享,可在线阅读,更多相关《专题七分布系数图及溶液中粒子浓度关系.docx(13页珍藏版)》请在冰豆网上搜索。
专题七分布系数图及溶液中粒子浓度关系
专题七分布系数图及溶液中粒子浓度关系
【考情分析】借助分布系数图判断电解质溶液中粒子浓度的关系,是高考常考题型,其中不同阶段粒子浓度关系的判断是近几年高考的热点和亮点。
如2018江苏化学14题考查NaOH溶液滴定H2C2O4过程中微粒的物质的量浓度关系;2017全国Ⅰ卷13题考查二元酸与NaOH溶液反应过程中粒子关系;2017全国Ⅱ卷12题考查二元酸随pH变化粒子关系等,该类题目的解题关键是正确判断溶液中溶质的成分及其量的关系,以及离子的电离程度和水解程度的大小。
该题型一般综合性强、难度较大,能够很好考查学生的分析推理能力,复习备考中应特别关注。
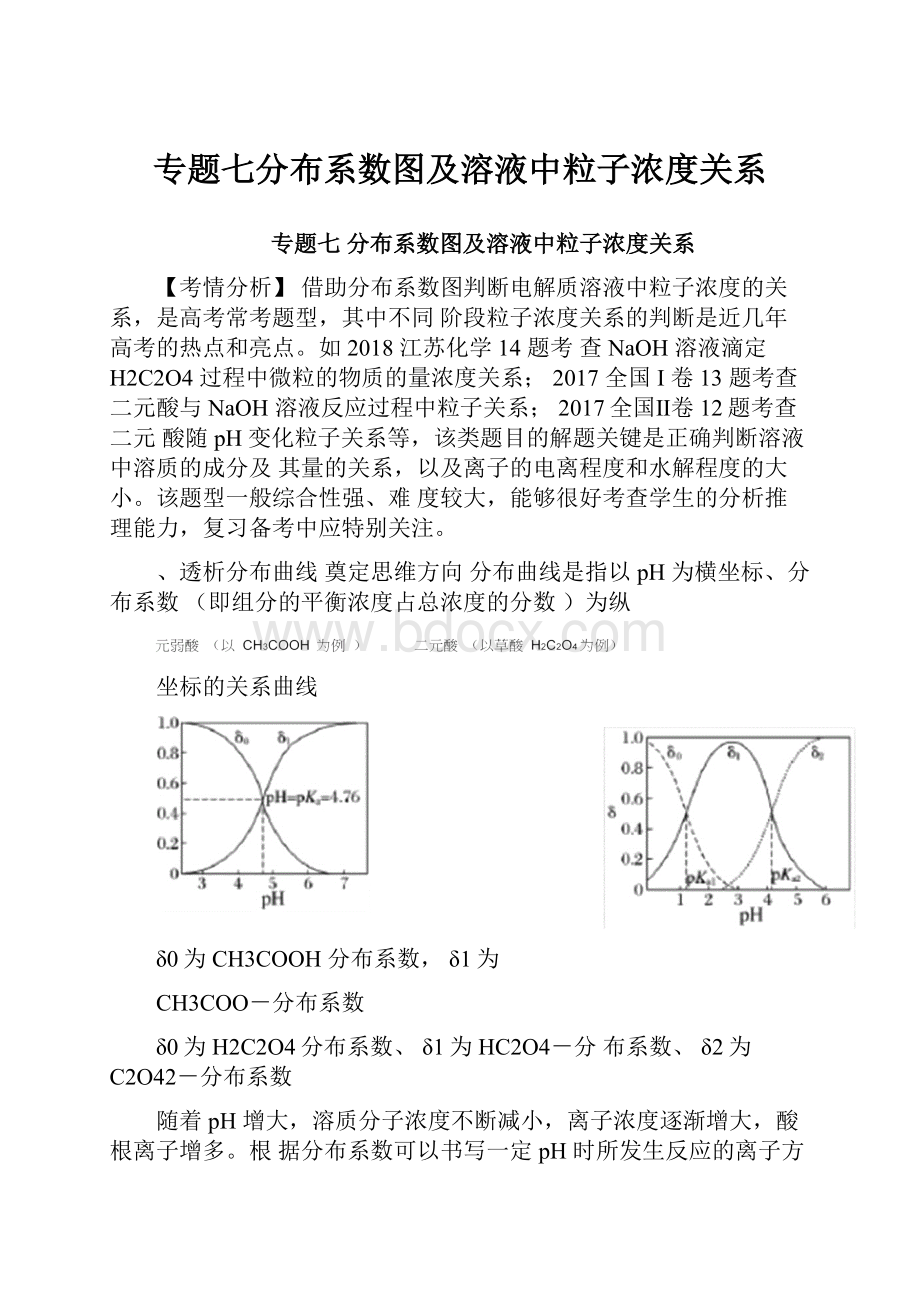
、透析分布曲线奠定思维方向分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵
坐标的关系曲线
δ0为CH3COOH分布系数,δ1为
CH3COO-分布系数
δ0为H2C2O4分布系数、δ1为HC2O4-分布系数、δ2为C2O42-分布系数
随着pH增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。
根据分布系数可以书写一定pH时所发生反应的离子方程式同一pH条件下可以存在多种溶质微粒。
根据在一定pH的微粒分布系数和酸的分析浓度,就可以计算各成分在该pH时的平衡浓度
、熟悉两大理论构建思维基点
1.电离平衡→建立电离过程是微弱的意识
弱电解质(弱酸、弱碱、水)的电离是微弱的,且水的电离能力远远小于弱酸和弱
碱的电离能力
如在稀醋酸溶液中:
CH3COOHCH3COO-+H
H2OOH-+H+,在溶液中,粒子浓度由大到小的顺序:
c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)。
2.水解平衡→建立水解过程是微弱的意识弱酸根离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程度。
如稀的CH3COONa溶液中,CH3COONa===CH3COO-+Na+,CH3COO-+
H2OCH3COOH+OH-,H2OH++OH-,溶液中,c(Na+)>
c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)。
三、把握三大守恒明确定量关系
1.电荷守恒
在电解质溶液中,阳离子的电荷总数与阴离子的电荷总数相等,即溶液呈电中性。
2.物料守恒(原子守恒)在电解质溶液中,由于某些离子能够水解,粒子种类增多,但这些粒子所含某些原子的总数始终不变,符合原子守恒。
3.质子守恒
在水溶液中由水电离出的H+和OH-总数相等。
四、抓准五个关键点形成思维模型
以室温时用0.1molL·-1NaOH溶液滴定0.1molL·-1HA溶液为例。
滴定曲线
关键点
离子浓度关系
原点(点0)
原点为HA的单一溶液,0.1molL·-1HA溶液pH>1说明HA是弱酸;c(HA)>c(H+)>c(A-)>c(OH-)
反应一半点
两者反应生成等物质的量的NaA和HA混合
(点①)
液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
中性点(点②)
此时溶液pH=7,溶液是中性,酸没有完全被中和,c(Na+)=c(A-)>c(HA)>c(H+)=c(OH-)
恰好完全反
应点(点③)
此时二者恰好完全反应生成NaA,为强碱弱酸盐,溶液显碱性,c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+)
过量点(点④)
此时,NaOH溶液过量,得到NaA与NaOH等物质的量的混合液,溶液显碱性,c(Na+)>c(OH-)>c(A-)>c(H+)
考点指导1单一溶液中离子浓度关系
【典例1】(安徽理综)室温下,下列溶液中粒子浓度关系正确的是()
A.Na2S溶液:
c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:
c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.Na2CO3溶液:
c(Na+)+c(H+)=2c(CO23-)+c(OH-)
D.CH3COONa和CaCl2混合溶液:
c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
解析A项,由于S2-+H2OHS-+OH-、HS-+H2OH2S+OH-、
H2OH++OH-,故离子浓度关系应为c(Na+)>c(OH-)>c(HS-)>c(H2S),
错误;B项,符合电解质溶液中质子守恒关系,正确;C项,根据电荷守恒有c(Na+)+c(H+)=c(HCO3-)+2c(CO23-)+c(OH-),错误;D项,根据物料守恒,
21离子浓度的关系应为c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-),错误。
答案B
【对点训练】
1.常温下,浓度均为0.1molL·-1的下列溶液中,粒子的物质的量浓度关系正确的
是()
A.氨水中,c(NH4+)=c(OH-)=0.1molL·-1
B.NH4Cl溶液中,c(NH4+)>c(Cl-)
C.Na2SO4溶液中,c(Na+)>c(SO24-)>c(OH-)=c(H+)
D.Na2SO3溶液中,c(Na+)=2c(SO23-)+c(HSO3-)+c(H2SO3)
解析氨水为弱碱溶液,只能部分电离出氢氧根离子,结合电荷守恒c(NH4+)+
c(H+)=c(OH-)可得:
c(NH4+)<c(OH-)<0.1molL·-1,A错误;NH4Cl溶液中,铵根离子部分水解、氯离子浓度不变,则溶液中c(NH4+)<c(Cl-),B错误;Na2SO4溶液显中性,c(OH-)=c(H+),结合电荷守恒可得:
c(Na+)=2c(SO24-),溶液中离子浓度大小为c(Na+)>c(SO24-)>c(OH-)=c(H+),C正确;根据亚硫酸钠溶液中的物料守恒可得:
c(Na+)=2c(SO23-)+2c(HSO3-)+2c(H2SO3),D错误。
答案C
2.(2018·郴州质检)已知NaHSO3溶液显酸性,NaHCO3溶液显碱性,现有浓度均为0.1mol/L的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S元素或C元素),其中正确的一组是()
+-+2--
A.c(Na+)>c(HRO3-)>c(H+)>c(RO23-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO23-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO23-)+c(OH-)
D.c(Na+)=c(HRO3-)+c(H2RO3)+2c(RO32-)
解析A项,NaHCO3溶液显碱性,说明HCO3-的水解程度大于电离程度,离子
浓度大小为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),A错;B项,根据电荷守恒得,c(Na+)+c(H+)=c(HRO3-)+2c(RO23-)+c(OH-),B错;C项,根据质子守恒得(可联合电荷守恒和物料守恒得到),c(H+)+c(H2RO3)=c(OH-)+
c(RO23-),C正确;D项,根据物料守恒得c(Na+)=c(RO23-)+c(HRO3-)+c(H2RO3),D错。
答案C
考点指导2混合溶液及反应过程中离子浓度关系
【典例2】(四川理综)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度/mol·L-1
反应后溶液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是()
A.实验①反应后的溶液中:
c(K+)>c(A-)>c(OH-)>c(H+)
-+-Kw
B.实验①反应后的溶液中:
c(OH-)=c(K+)-c(A-)=1×10-9mol/L
C.实验②反应后的溶液中:
c(A-)+c(HA)>0.1mol/L
D.实验②反应后的溶液中:
c(K+)=c(A-)>c(OH-)=c(H+)解析实验①反应后溶液的pH=9,即溶液显碱性,说明HA为弱酸,二者等浓度等体积混合恰好反应生成KA,A-水解,A项正确;实验①反应后的溶液中,由电荷守恒式c(H+)+c(K+)=c(A-)+c(OH-)知,c(K+)-c(A-)=c(OH-)-c(H+),B项错误;因为HA为弱酸,如果与等体积等浓度的KOH溶液混合,溶液显碱性,若溶液显中性,则在两溶液体积相等的条件下,HA溶液的浓度应大于
0.2mol/L,所以实验②反应后的溶液中,c(A-)+c(HA)>0.1mol/L,C项正确;实验②反应后溶液显中性,根据电荷守恒式c(H+)+c(K+)=c(A-)+c(OH-),且
c(H+)=c(OH-),则c(K+)=c(A-),即c(K+)=c(A-)>c(H+)=c(OH-),D项正答案B
思维建模】
酸、碱中和型离子浓度的关系
对点训练】
3.向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2)≤0.015mol时发生的反应是:
2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3。
下列对应关系正确的是()
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO2-)+c(OH-)
B
0.01
+--2-
c(Na+)>c(AlO2-)>c(OH-)>c(CO32-)
C
0.015
c(Na+)>c(HCO3-)>c(CO23-)>c(OH-)
D
0.03
c(Na+)>c(HCO3-)>c(OH-)>c(H+)
解析A项,NaAlO2与NaOH的混合溶液,由电荷守恒有:
c(Na+)+c(H+)=c(AlO2-)+c(OH-),有c(Na+)<c(AlO-2)+c(OH-),错误;B项,通入CO2,先与NaOH反应:
2NaOH+CO2===Na2CO3+H2O(若NaAlO2先反应生成Al(OH)3溶于NaOH),此时为NaAlO2与Na2CO3的混合溶液,因AlO2-水解程度大(由题给反应可知AlO2-结合H+能力强于CO23-),有c(CO32-)>c(AlO2-),错误;C项,继续通CO2,发生题给反应:
2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3,当n(CO2)=0.015mol,此时为Na2CO3溶液,有c(CO23-)>c(HCO3-),错误;D项,继续通
CO2发生反应:
Na2CO3+CO2+H2O===2NaHCO3,当n(CO2)=0.03mol,此时为
NaHCO3溶液,因HCO3-水解程度大于电离程度,溶液呈碱性,正确。
答案D
4.[2018·江苏化学,14]H2C2O4为二元弱酸,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)。
室温下用NaOH溶液滴定25.00mL0.1000molL-·1H2C2O4溶液至终点。
滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是(双选)()
A.0.1000mol·L-1H2C2O4溶液:
c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
B.c(Na+)=c(总)的溶液:
c(Na+)>c(H2C2O4)>c(C2O24-)>c(H+)
C.pH=7的溶液:
c(Na+)=0.1000molL-·1+c(C2O42-)-c(H2C2O4)
D.c(Na+)=2c(总)的溶液:
c(OH-)-c(H+)=2c(H2C2O4)+c(HC2O4-)解析H2C2O4溶液中存在电荷守恒:
c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),物料守恒:
c(H2C2O4)+c(HC2O4-)+c(C2O24-)=0.1000molL-·1,将两式相加,可得:
c(H+)=0.1000molL-·1+c(C2O42-)+c(OH-)-c(H2C2O4),A项正确;c(Na+)
=c(总)的溶液,相当于等物质的量的H2C2O4与NaOH反应后的溶液,即为
Kh(HC2O4-)=KKaw1=1×10--142Ka15.4×10-2
HC2O4-的电离程度大于其水解程度,故NaHC2O4溶液显酸性,则c(C2O24-)>c(H2C2O4),B项错误;起始时,H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O24-)=0.1000molL-·1,滴入NaOH溶液后,c(H2C2O4)+c(HC2O-4)+c(C2O42-)<0.1000molL-·1,溶液中存在电荷守恒:
c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),pH=7的溶液中,c(Na+)=c(HC2O4-)+2c(C2O24-)<0.1000mol·L-1+c(C2O24-)-c(H2C2O4),C项错误;c(Na+)=2c(总)的溶液,相当于1mol
H2C2O4与2molNaOH反应后的溶液,即为Na2C2O4溶液,Na2C2O4中存在质子
守恒:
c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),D项正确。
答案AD
考点指导3分布系数图
【典例3】(2018·天津理综,6)LiH2PO4是制备电池的重要原料。
室温下,LiH2PO4溶液的pH随c初始(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数δ随pH的变化如图2所示δ=c总(含P元素的粒子)。
下列有关LiH2PO4溶液的叙述正确的是()
A.溶液中存在3个平衡
B.含P元素的粒子有H2PO4-、HPO24-和PO43-
C.随c初始(H2PO4-)增大,溶液的pH明显变小
D.用浓度大于1mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
解析LiH2PO4溶液中存在H2PO4-的电离平衡:
H2PO4-H++HPO42-、
HPO24-H++PO43-,H2PO4-的水解平衡:
H2PO4-+H2OH3PO4+OH
-,H2O的电离平衡:
H2OH++OH-,溶液中存在4个平衡,A项错误;
含P元素的粒子有H2PO4-、HPO24-、PO34-、H3PO4,B项错误;根据图1,随着c初始(H2PO4-)增大,溶液的pH先逐渐减小后趋向不变,C项错误;根据图2,当pH=4.66时,δ=0.994,即H2PO4-的分布分数为0.994,故当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4,D项正确。
答案D
【对点训练】
5.
(2017·课标全国Ⅰ,13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
下列叙述错误的是()
6.
<0,此时溶液呈酸性,C正确;D项,当溶液呈中性时,由曲线M可知
答案D
7.(2017·课标全国Ⅱ,12)改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=
c(X)]
c(H2A)+c(HA-)+c(A2-)]
列叙述错误的是(
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)解析A项,根据图像,pH=1.2时,H2A和HA-物质的量分数图像相交,则有
c(H2A)=c(HA-),正确;B项,根据pH=4.2点,K2(H2A)=[c(H+)·c(A2-)]/c(HA-)=c(H+)=10-4.2molL·-1,lg[K2(H2A)]=-4.2,正确;C项,根据图像,pH=2.7时,H2A和A2-物质的量分数图像相交,则有c(H2A)=c(A2-),HA-曲线位于上方,则有c(HA-)>c(H2A)=c(A2-),正确;D项,根据pH=4.2时,c(HA-)c(A2-),且物质的量分数约为0.48,而c(H+)=10-4.2mol·L-1,可知c(HA-)=c(A2
-)>c(H+),错误。
答案D
【课堂小结】分析溶液中微粒浓度关系的思维流程