中考化学推断题100题专题训练含答案.docx
《中考化学推断题100题专题训练含答案.docx》由会员分享,可在线阅读,更多相关《中考化学推断题100题专题训练含答案.docx(43页珍藏版)》请在冰豆网上搜索。
中考化学推断题100题专题训练含答案
中考化学推断题100题专题训练(含答案)
一、中考化学推断题
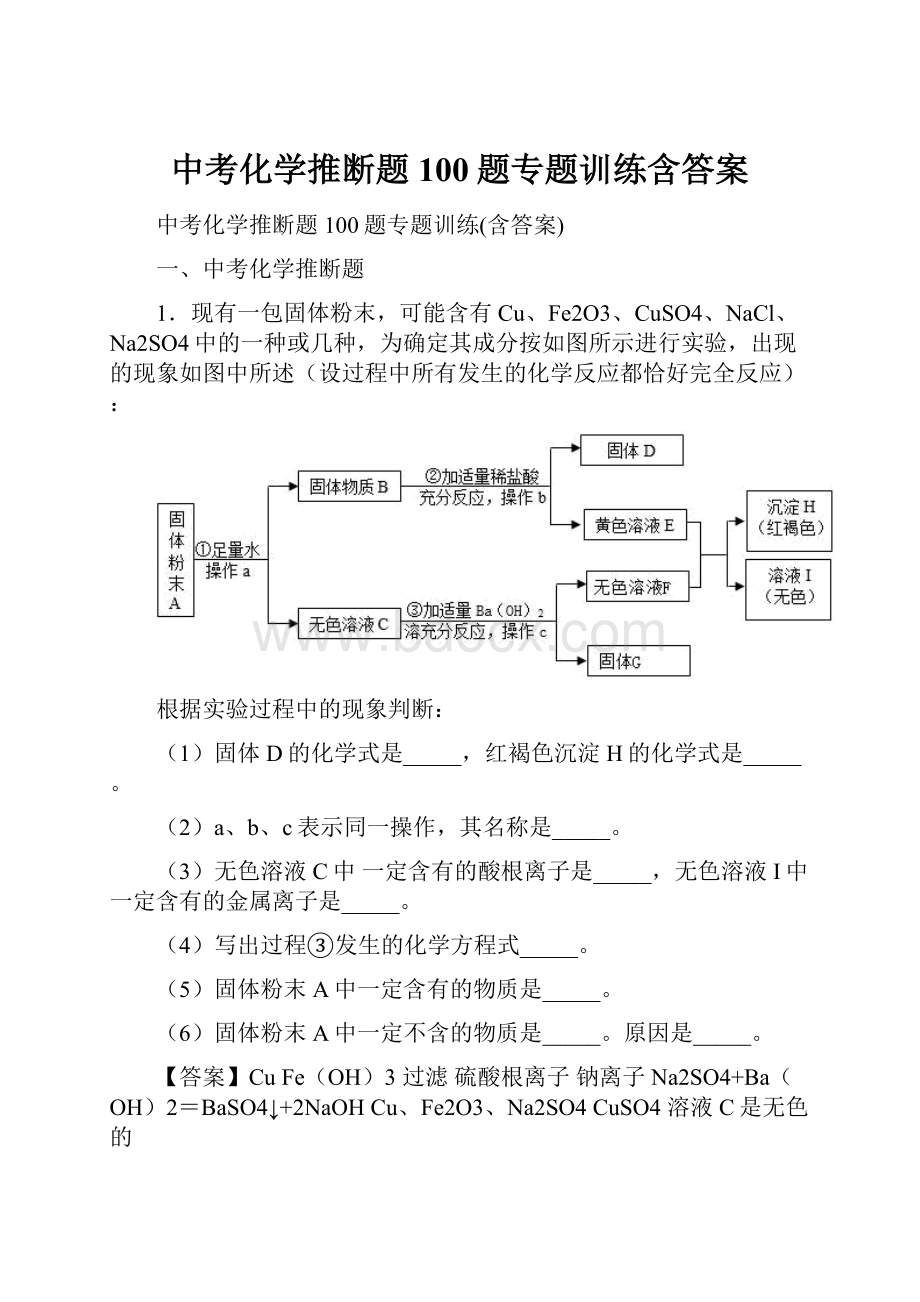
1.现有一包固体粉末,可能含有Cu、Fe2O3、CuSO4、NaCl、Na2SO4中的一种或几种,为确定其成分按如图所示进行实验,出现的现象如图中所述(设过程中所有发生的化学反应都恰好完全反应):
根据实验过程中的现象判断:
(1)固体D的化学式是_____,红褐色沉淀H的化学式是_____。
(2)a、b、c表示同一操作,其名称是_____。
(3)无色溶液C中一定含有的酸根离子是_____,无色溶液I中一定含有的金属离子是_____。
(4)写出过程③发生的化学方程式_____。
(5)固体粉末A中一定含有的物质是_____。
(6)固体粉末A中一定不含的物质是_____。
原因是_____。
【答案】CuFe(OH)3过滤硫酸根离子钠离子Na2SO4+Ba(OH)2=BaSO4↓+2NaOHCu、Fe2O3、Na2SO4CuSO4溶液C是无色的
【解析】
【分析】
固体粉末A加入足量水,过滤,得到固体物质B和无色溶液C,硫酸铜显蓝色,则A中不含硫酸铜,黄色溶液E和无色溶液F会生成红褐色沉淀H,所以H是氢氧化铁沉淀,F中含有氢氧根,E是B中加入盐酸生成的,所以E中含有氯化铁,铜和氧化铁都难溶于水,所以B中含有氧化铁和铜,D是铜,C和氢氧化钡反应会生产白色沉淀,所以C中含有硫酸钠,硫酸钠和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,所以F是氢氧化钠,G是硫酸钡,氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,所以I中一定含有氯化钠,A中含有氧化铁、铜、硫酸钠。
【详解】
(1)E是B中加入盐酸生成的,所以E中含有氯化铁,铜和氧化铁都难溶于水,所以B中含有氧化铁和铜,D是铜,固体D的化学式是
;黄色溶液E和无色溶液F会生成红褐色沉淀H,所以H是氢氧化铁沉淀,红褐色沉淀H的化学式是
。
(2)a、b、c表示同一操作,是将固体和液体分离,其名称是过滤。
(3)C和氢氧化钡反应会生产白色沉淀,所以C中含有硫酸钠,无色溶液C中一定含有的酸根离子是硫酸根离子,氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,所以I是氯化钠,无色溶液I中一定含有的金属离子是钠离子。
(4)C和氢氧化钡反应会生产白色沉淀,所以C中含有硫酸钠,硫酸钠和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,所以F是氢氧化钠,G是硫酸钡,故过程③发生的化学方程式为
。
(5)固体粉末A中一定含有的物质是Cu、Fe2O3、Na2SO4。
(6)固体粉末A中一定不含的物质是CuSO4;原因是硫酸铜溶液呈蓝色,而溶液C是无色的。
【点睛】
无色溶液C,则A中不含硫酸铜,黄色溶液E和无色溶液F会生成红褐色沉淀H,所以H是氢氧化铁沉淀,C和氢氧化钡反应会生产白色沉淀,所以C中含有硫酸钠。
2.某白色固体可能由CuSO4、Na2CO3、Na2SO4、BaCl2、NaCl中的一种或几种组成,为了探究该白色固体的成分,某同学完成探究,探究流程如图:
(1)该白色固体中一定没有___,可能有___。
(2)反应①的化学方程式为___。
(3)反应②的化学方程式为___。
【答案】CuSO4、Na2SO4NaClBaCl2+Na2CO3=BaCO3↓+2NaClBaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑
【解析】
【分析】
硫酸铜在溶液中显蓝色,碳酸钠和氯化钡反应生成能溶于稀硝酸的碳酸钡沉淀,硫酸钠和氯化钡反应生成不溶于稀硝酸的硫酸钡沉淀,氯离子和银离子反应会生成不溶于稀硝酸的氯化银沉淀。
白色固体加入足量的水溶解,得到白色沉淀和无色溶液,所以样品中一定不含硫酸铜,白色沉淀加入足量的稀硝酸全部溶解,白色沉淀为碳酸钡,所以样品中一定不含硫酸钠,一定含有氯化钡和碳酸钠;无色溶液加入足量的硝酸银,会生成白色沉淀,氯化钡会引入氯离子,所以样品中可能含有氯化钠。
【详解】
根据以上分析可知:
(1)该白色固体中一定没有CuSO4、Na2SO4,可能有NaCl;
(2)反应①是氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,化学方程式为:
BaCl2+Na2CO3=BaCO3↓+2NaCl;
(3)反应②是碳酸钡沉淀硝酸反应生成硝酸钡、水和二氧化碳,化学方程式为:
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑。
【点睛】
在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可。
3.如图是初中化学常见六种物质之间的关系图。
(物质是溶液的只考虑溶质)图中用“一”表示两端的物质能发生化学反应,“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。
A与B两溶液可以发生中和反应生成一种厨房中常用的调味剂,C在农业上可用来配制波尔多液,D可用于制玻璃,请回答下列问题:
(1)请分别写出下列物质的化学式(或溶质的化学式):
B___;D___。
(2)写出E转化为C的化学方程式___。
(3)若F为铁锈的主要成分,写出F与足量A反应的实验现象___。
【答案】NaOHNa2CO3CaO+H2O=Ca(OH)2红棕色固体逐渐减少至消失,溶液由无色变成黄色
【解析】
【分析】
如图是初中化学常见六种物质之间的关系图,A与B两溶液可以发生中和反应生成一种厨房中常用的调味剂,即生成氯化钠,D可用于制玻璃,所以D是碳酸钠,C在农业上可用来配制波尔多液,C会与碳酸钠反应,所以C是氢氧化钙,氢氧化钙会与A反应,所以A是盐酸,B是氢氧化钠,E会与氢氧化钙相互转化,氢氧化钠会转化成E,所以E是水,F会转化成水,所以F是可以是金属氧化物或氢气等,经过验证,推导正确。
【详解】
(1)经分析,B是NaOH,D是Na2CO3;
(2)E转化为C的反应是氧化钙和水反应生成氢氧化钙,化学方程式为:
CaO+H2O=Ca(OH)2;
(3)若F为铁锈的主要成分,所以F是氧化铁,F与足量A的反应是氧化铁和盐酸反应生成氯化铁和水,氧化铁为红棕色固体,三价铁离子颜色为黄色,故实验现象为:
红棕色固体逐渐减少至消失,溶液由无色变成黄色。
4.某同学将mgZn加入一定质量的AgNO3和Cu(NO3)2的混合溶液中,充分反应后过滤,将滤渣洗涤、干燥后称量,质量仍为mg。
则:
(1)写出溶液中发生的任意一个反应的化学方程式①_____;滤渣中一定含有②_____。
(2)设计实验方案,探究滤渣成分和与滤渣成分对应的滤液中溶质成分,写出实验操作、预期现象及结论。
_____
【答案】
(或
)硝酸锌
实验操作
现象
结论
取少量滤渣放入洁净的试管中,然后向试管中加入少量稀盐酸
有气泡产生,溶液不变色
滤渣为锌、铜和银
无气泡产生
滤渣为铜和银
取滤液少许,放入盛有铁粉的洁净试管中
无明显现象
滤液中含有硝酸锌
有红色物质生成,滤液由蓝色变为浅绿色
滤液中含有硝酸锌和硝酸铜
【解析】
【分析】
根据锌比铜活泼,铜比银活泼,将Zn加入一定质量的AgNO3和Cu(NO3)2的混合溶液中时,锌先和硝酸银反应生成硝酸锌和银,后和硝酸铜反应生成硝酸锌和铜进行分析。
【详解】
(1)在金属活动性顺序中,Zn>Cu>Ag,向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,与两种溶质依次发生反应
所以析出银的过程是固体质量增加的过程;
所以析出铜的过程是固体质量减少的过程。
而反应前后固体质量都是mg,说明硝酸银被置换完了,硝酸铜也发生了置换反应,因此滤渣一定含有银和铜,可能含有锌;滤液一定含有硝酸锌,可能含有硝酸铜,一定没有硝酸银。
(2)
实验操作
现象
结论
取少量滤渣放入洁净的试管中,然后向试管中加入少量稀盐酸
有气泡产生,溶液不变色
滤渣为锌、铜和银
无气泡产生
滤渣为铜和银
取滤液少许,放入盛有铁粉的洁净试管中
无明显现象
滤液中含有硝酸锌
有红色物质生成,滤液由蓝色变为浅绿色
滤液中含有硝酸锌和硝酸铜
5.甲、乙、丙是仅由碳、氧两种元素组成的单质或化合物,其中丁由钙、氧和碳三种元素组成。
它们之间的转化关系如图所示(图中部分反应物、生成物及反应条件已略去)。
(1)写出下列物质的化学式:
甲______、丙______。
(2)实验室制取甲的化学方程式______。
(3)写出甲与澄清石灰水发生反应的化学方程式______。
(4)由甲转化为丙的化学方程式______。
【答案】CO2COCaCO3+2HCl=CaCl2+H2O+CO2↑CO2+Ca(OH)2=CaCO3↓+H2OCO2+C
2CO
【解析】
【分析】
根据题干提供的信息进行分析解答,甲、乙、丙是仅由碳、氧两种元素组成的单质或化合物,丁由Ca、O和C三种元素组成,故丁是碳酸钙,碳酸钙能高温分解生成氧化钙和二氧化碳,故甲是二氧化碳,由于甲能与丙相互转化,乙能生成二氧化碳和丙,故乙可能是氧气,也可能是炭,丙可能是一氧化碳;若甲中不含碳元素,则甲可能是碳酸钙与酸反应生成的水,根据过氧化氢能分解生成水和氧气,氧气能与水相互转化即可完成解答。
【详解】
由分析可知:
(1)甲的化学式为CO2,丙的化学式为CO;
(2)实验室通过碳酸钙和稀盐酸反应制取二氧化碳,其反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)二氧化碳和澄清石灰水可反应生成碳酸钙和水,反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;
(4)二氧化碳和碳反应可生成一氧化碳,反应的化学方程式为CO2+C
2CO。
6.A−I是初中化学常见的物质,它们之间有如图所示的转化关系,部分反应条件已略去,已知人和动植物的呼吸离不开物质B,反应②是化合反应且G的溶解度随温度升高而降低,F、G、H中滴加酚酞溶液都显红色。
(1)物质B的化学式是_____;
(2)反应④的基本类型应是_____;
(3)写出符合反应③的化学方程式:
_____;
(4)写出物质G的一种应用实例_____。
【答案】O2复分解反应2NaOH+CO2=Na2CO3+H2O配制农药波尔多液(答案合理即可)
【解析】
【分析】
由题干,人和动植物的呼吸离不开物质B,推测物质B为氧气;G的溶解度随温度升高而降低,推测G为氢氧化钙。
F、G、H中滴加酚酞溶液都显红色,说明都显碱性。
A与氧气点燃生成C和D,反应①为有机物反应,生成C、D为水和二氧化碳,且D与F可以生成H和C,可知C为水,D为二氧化碳;F为碱性物质,且可以与D反应,推测F为氢氧化钠,则H为碳酸钠;碳酸钠与G氢氧化钙生成F氢氧化钠和I碳酸钙沉淀;C水与E氧化钙可生成G氢氧化钙。
代入框图,推测成立。
则B、氧气,C、水,D、二氧化碳,E、氧化钙,F、氢氧化钠,G、氢氧化钙,H、碳酸钠,I碳酸钙,
【详解】
(1)物质B为氧气,化学式为O2
(2)反应④为氢氧化钙与碳酸钠反应生成氢氧化钠和碳酸钙沉淀,为复分解反应;
(3)反应③为二氧化碳与氢氧化钠反应生成碳酸钠和水,化学方程式为2NaOH+CO2=Na2CO3+H2O;
(4)物质G为氢氧化钙,可用于配制农药波尔多液、改良酸性土壤等。
【点睛】
在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
7.A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去)。
(1)若A是紫红色金属,D为难溶性碱。
则D的化学式为_____,由C转化为A的化学方程式为_____。
(2)若A属于氧化物,其相对分子质量为56,A与水化合得B,C是白色难溶固体。
则B的一种用途是_____,由D转化为C的化学方程式为_____。
【答案】Cu(OH)2CuSO4+Fe=Cu+FeSO4(或CuCl2+Zn=Cu+ZnCl2等)改良酸性土壤(或作建筑材料等)CaCl2+Na2CO3=CaCO3↓+2NaCl[或CO2+Ca(OH)2=CaCO3↓+H2O等]
【解析】
【详解】
(1)根据“A是紫红色金属”,所以A是铜,根据“A、B、C、D均含有同一种元素”,“D为难溶性碱”,所以D是氢氧化铜,由于C能够和氢氧化铜相互转化,且C能够转化为铜,所以C是铜的盐溶液,如硫酸铜、氯化铜等,依据转化关系可知,B应该为氧化铜,经过验证推出的各种物质均满足题中的转化关系,所以D的化学式为:
Cu(OH)2;由C转化为A的化学方程式为CuSO4+Fe=FeSO4+Cu(或CuCl2+Zn=Cu+ZnCl2等);
(2)根据“A属于氧化物,其相对分子质量为56”,所以A为氧化钙;根据“A与水化合得B”,所以B是氢氧化钙,C是“白色难溶固体”,所以C是碳酸钙,D和碳酸钙能相互转化,D可以是钙盐,也可以是二氧化碳,经过验证推出的各种物质均满足题中的转化关系。
氢氧化钙可以用于改良酸性土壤;由B转化为C的化学方程式为:
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH或Ca(OH)2+CO2═CaCO3↓+H2O。
8.小雪同学发现家里有一瓶无标签的无色液体,她为了探究它是何种物质,做了如下实验:
把此液体编号为A,加热A液体,发现有气体B产生,在A中加入黑色粉末C,稍微振荡,在常温下就能迅速产生气体B,且产生了常温下为液体的纯净物D,而C的质量在反应前后没有改变。
她把B收集起来,用带火星的木炭伸入盛B的集气瓶中,木条剧烈燃烧。
如把黄色粉末E点燃后放入盛B的集气瓶中,能剧烈燃烧,生成一种无色有刺激性气味的气体F。
,
(1)根据小雪的实验,分析A、B、C、D、E、F分别是什么物质。
写出各物质的名称:
A______、B______、C______、D______、E______、F______。
(2)在横线上写出题中所发生反应的文字表达式,并从反应物和生成物种类的角度看各属于什么类型的反应,把反应类型写在括号内。
________(________);
________(________);
________(________)。
【答案】过氧化氢溶液氧气二氧化锰水硫二氧化硫过氧化氢
水+氧气分解反应木炭+氧气
二氧化碳化合反应硫+氧气
二氧化硫化合反应
【解析】
【分析】
在A中加入黑色粉末C,稍微振荡,在常温下就能迅速产生气体B,且产生了常温下为液体的纯净物D,C的质量在反应前后没有改变,所以C是二氧化锰,用带火星的木条伸入盛B的集气瓶中,木条剧烈燃烧,所以B是氧气,A是过氧化氢,D为水,把淡黄色E点燃后放入盛氧气的集气瓶中,能剧烈燃烧,生成一种无色有刺激性气味的气体F,所以E是硫,F是二氧化硫,经过验证,推出的各种物质均满足题中的转化关系,推导正确。
【详解】
(1)A是过氧化氢溶液,B是氧气,C是二氧化锰,D是水,E是硫,F是二氧化硫;
(2)过氧化氢在二氧化锰的催化作用下分解生成水和氧气,文字表达式为:
过氧化氢
水+氧气,该反应属于分解反应;
木炭在氧气中燃烧,生成二氧化碳,文字表达式为:
木炭+氧气
二氧化碳,该反应属于化合反应;
黄色粉E在B中燃烧的反应是硫和氧气在点燃的条件下生成二氧化硫,文字表达式为:
硫+氧气
二氧化硫,该反应属于化合反应.
9.如图所示,A是氧化物,可作干燥剂;D是一种盐,用于制造玻璃,洗涤剂等,它们之间发生如图变化,请你根据所学的化学知识作出推断:
(1)写出化学式:
A,D;
(2)贝壳高温煅烧的化学方程式;
(3)B→F的化学方程式;所属的基本反应类型是;
【答案】
(1)CaO,Na2CO3;
(2)CaCO3高温CaO+CO2↑;(3)CO2+C高温2CO,化合反应
【解析】
试题分析:
贝壳的主要成分为碳酸钙,高温煅烧生成氧化钙、二氧化碳,A是氧化物,可作干燥剂,则A为CaO,B为CO2;A与水作用生成C即C为Ca(OH)2;D是一种盐,用于制造玻璃,洗涤剂等,D为Na2CO3;E为NaOH;B高温生成F,F为CO;G为Cu;H为Cu(NO3)2
考点:
物质的推断。
10.A、B、C、D四种化合物,由以下8种离子构成(每种离子只能选用一次)。
阳离子:
Na+、Ba2+、Cu2+、Mg2+;阴离子;Cl−、NO3-、OH−、SO42-
四种化合物之间的反应有如下现象:
①A
B→白色沉淀,不溶于硝酸;
②B
D→蓝色沉淀:
③C
B→白色沉淀,再加硝酸沉淀则转化为C。
(1)由此可推知:
A为__________,D为__________。
(填化学式)
(2)请写出B
C反应的化学方程式___________________。
【答案】Na2SO4CuCl22HNO3+Mg(OH)2=Mg(NO3)2+2H2O
【解析】
【分析】
题目中的突破口“A+B→白色沉淀,不溶于硝酸”,则为Ba2+和SO42-反应生成硫酸钡沉淀;根据“B+D→蓝色沉淀”,则为Cu2+和OH-作用生成氢氧化铜沉淀;“C+B→白色沉淀,再加硝酸沉淀则转化为C”,则可推测生成的沉淀为不溶性碱氢氧化镁,而C为硝酸镁。
又因为“每种离子只能选用一次”,每个物质只有一种可能,所以推测出各物质,带入验证符合题意即可。
【详解】
根据“A+B→白色沉淀,不溶于硝酸”,则为Ba2+和SO42-反应生成硫酸钡沉淀,则推测A可能为硫酸钠;B为氢氧化钡;化学方程式为:
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH;
根据“B+D→蓝色沉淀”,则为Cu2+和OH-作用生成氢氧化铜沉淀;则推测B为氢氧化钡,而D为氯化铜;化学方程式为:
CuCl2+Ba(OH)2=Cu(OH)2↓+BaCl2;
根据“C+B→白色沉淀,再加硝酸沉淀则转化为C”,则可推测生成的沉淀为不溶性碱氢氧化镁,而C为硝酸镁;化学方程式为:
Mg(NO3)2+Ba(OH)2=Ba(NO3)2+Mg(OH)2↓;2HNO3+Mg(OH)2=Mg(NO3)2+2H2O
故A为硫酸钠,B为氢氧化钡,C为硝酸镁,D为氯化铜。
故答案为:
(1)Na2SO4,CuCl2.
(2)2HNO3+Mg(OH)2=Mg(NO3)2+2H2O。
11.如图中A是人体胃液中含有的成分,B用于改良酸性土壤,G是铁锈的主要成分(Fe2O3·xH2O),E、F、I为无色气体。
根据图示回答下列问题。
(1)写出有关物质的化学式:
B:
,C:
。
(2)写出反应④的化学方程式:
。
(3)反应①属于反应(填反应类型)。
(4)日常生活中为了阻止反应③发生,通常采取的措施是(写一条)。
(5)要使反应⑤能够发生,需要反应物B和M,其中M的化学式为。
【答案】
(1)B:
Ca(OH)2C:
H2O
(2)CaCl2+Na2CO3=CaCO3↓+2NaCl(3)置换反应。
(4)保持铁制品表面的清洁干燥(合理答案也给分)(5)NH4Cl
【解析】
试题分析:
(1)根据题目信息知:
A为HCl,B为氢氧化钙,G为氧化铁,由C在通电的条件下生成E和F,可知,C为水,A和J在一定条件下生成E,则E为氢气,F为氧气;氢氧化钙与盐酸反应生成氯化钙和水,则D为氯化钙,氯化钙与碳酸钠反应生成白色沉淀碳酸钙;氢氧化钙与铵盐反应生成盐,氨气和水。
B为氢氧化钙,C为水;
(2)反应④的化学反应方程式:
CaCl2+Na2CO3=CaCO3↓+2NaCl;
(3)反应⑤是氢氧化钙与硝酸铵或硫酸铵等盐发生反应,生成新盐和新碱,属于复分解反应;
(4)反应③是铁生锈的反应,防治铁生锈的措施有在铁制品表面涂油或喷漆;
(5)M为氯化铵或硫酸铵或硝酸铵。
考点:
框图式推断题。
12.已知A、B、C、D、E是初中化学中常见的不同类别的物质。
它们之间的关系如图所示(“→”表示物质间的转化关系,“—”表示两端的物质能发生反应)。
A和D是配制波尔多液的主要原料,E是应用广泛的金属,请回答下列问题:
(1)写出A的俗称_____________,物质B所属的物质类别是____________,D的化学式_____________。
(2)D与E反应的化学方程式________________,该反应的基本反应类型是_______。
(3)C在生产上的用途有_______(写一种)。
【答案】熟石灰氧化物CuSO4CuSO4+Fe=FeSO4+Cu置换反应除铁锈
【解析】
本题是框图型推断题。
在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
A、B、C、D、E是初中化学中常见的不同类别的物质,A和D是配制波尔多液的主要原料,则A和D是氢氧化钙和硫酸铜中一种,E是应用广泛的金属,E是铁,D与E能相互反应,则D是硫酸铜,A是氢氧化钙;C能与铁反应,C能生成硫酸铜,C是硫酸,B能与硫酸反应,B能转化为氢氧化钙,则B可能是氧化钙,将假设代入框图,假设成立。
因此:
(1)A氢氧化钙,俗称是熟石灰(或消石灰),物质B是氧化钙,所属的物质类别是氧化物,D是硫酸铜,化学式CuSO4;
(2)D与E的反应是铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式CuSO4+Fe=FeSO4+Cu,该反应是一种单质和一种化合物生成另一种单质和另一种化合物,基本反应类型是置换反应;
(3)C是硫酸,在生产上的用途是除铁锈。
13.A-H表示初中化学常见物质,它们之间转化关系如图所示(部分生成物已略去)
其中A为红棕色固体,反应①为冶金工业的重要反应,且B、D组成元素相同,C、F为金属单质,其它物质为化合物,其中F为紫红色,H为白色沉淀。
请按要求填空:
(1)写出下列物质的化学式:
A________D________E________
(2)①~④的反应中属于置换反应的是________(填序号)。
(3)反应①的化学方程式为___________。
【答案】Fe2O3CO2CuSO4②③3CO+Fe2O3
2Fe+3CO2
【解析】
【分析】
A~H表示初中化学常见物质,A为红棕色固体,反应①为冶金工业的重要反应,且B、D组成元素相同,所以A是氧化铁,B是一氧化碳,D是二氧化碳,C是铁,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,H为白色沉淀,所以H是碳酸钙,C、F为金属单质,其它物质为化合物,F为紫红色,所以F是铜,铁和稀硫酸反应生成硫酸亚铁和氢气,所以G是硫酸亚铁,E和铁反应会生成硫酸亚铁和铜,所以E是硫酸铜,经过验证,推导正确,
【详解】
(1)所以A是Fe2O3,D是CO2,E是CuSO4;
(2)①是一氧化碳和氧化铁高温生成铁和二氧化碳,不属于置换反应,②是铁和硫酸铜反应生成硫酸亚铁和铜,属于置换反应,③是铁和稀硫酸反应生成硫酸亚铁和氢气,属于置换反应,④是二氧化碳和氢氧化钙生成碳酸钙沉淀和水,不属于置换反应,所以①~④的反应中属于置换反应的是②③;
(3)反应①是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:
3CO+Fe2O3
2Fe+3CO2。
14.有一包白色固体可能含碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种。
某化学兴趣小组为探究其成分做了以下实验:
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1所示;
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
Ⅲ.继续向烧杯中