第39章 基因工程及蛋白质工程.docx
《第39章 基因工程及蛋白质工程.docx》由会员分享,可在线阅读,更多相关《第39章 基因工程及蛋白质工程.docx(36页珍藏版)》请在冰豆网上搜索。
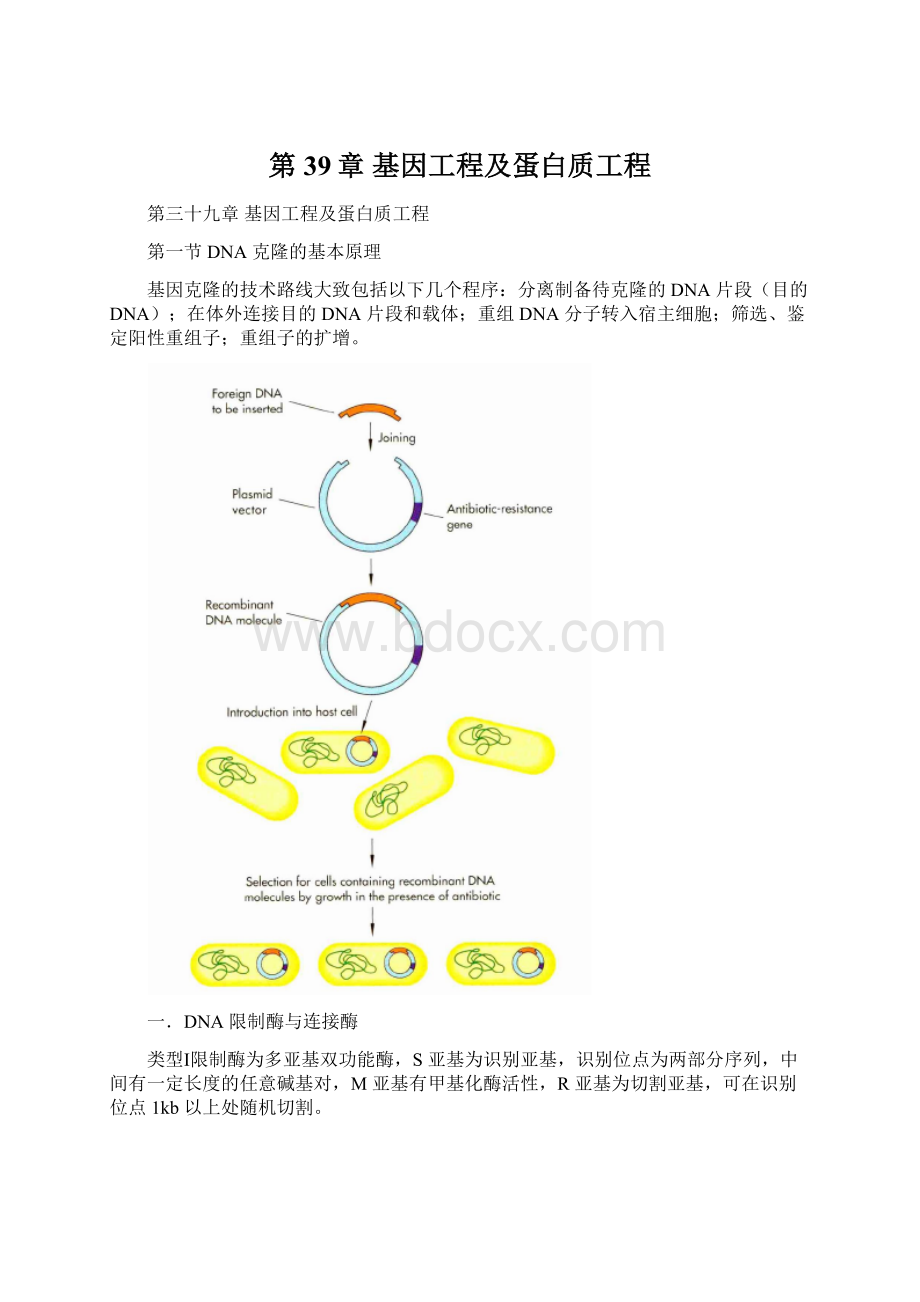
第39章基因工程及蛋白质工程
第三十九章基因工程及蛋白质工程
第一节DNA克隆的基本原理
基因克隆的技术路线大致包括以下几个程序:
分离制备待克隆的DNA片段(目的DNA);在体外连接目的DNA片段和载体;重组DNA分子转入宿主细胞;筛选、鉴定阳性重组子;重组子的扩增。
一.DNA限制酶与连接酶
类型Ⅰ限制酶为多亚基双功能酶,S亚基为识别亚基,识别位点为两部分序列,中间有一定长度的任意碱基对,M亚基有甲基化酶活性,R亚基为切割亚基,可在识别位点1kb以上处随机切割。
类型Ⅱ限制酶有两个相同的亚基组成,识别位点为4~6bp的回文序列,切割位点在识别位点内,或靠近识别位点,经切割可以生成平头末端或粘性末端,可以产生相同粘性末端的不同的限制酶称作同尾酶。
类型Ⅱ限制酶是分子生物学中最重要的工具酶。
类型Ⅲ限制酶为两个亚基的双功能酶,M亚基为识别亚基,R亚基为切割亚基,切割位点在识别位点下游24~26bp处,特异性不强。
EcoRI与DNA的复合体:
外源DNA可以被插入质粒载体:
限制性内切酶切割DNA形成对应的粘性末端:
使用相同的粘性末端进行重组,会有较多的载体自身环化,或目的基因串联,目的基因的定向连接常使用两种限制酶,产生两种不同的粘性末端。
可以在载体和目的基因的两端连接接头(引入限制酶切点),或衔接物(含有粘性末端),再连接载体和目的基因。
接头用于建立克隆片断的末端:
大肠杆菌的连接酶只能连接粘性末端,T4连接酶可以连接平头末端,其条件是:
提高T4连接酶的浓度;提高DNA片段的浓度;降低ATP浓度;加入多胺类如亚精胺;加入浓缩剂如乙二醇。
T4连接酶催化的反应:
二.分子克隆的载体与宿主系统
1.分子克隆的载体的基本条件
能自主复制;具有一种或多种限制性内切酶的单一切割位点,并在位点中插入外源基因后,不影响其复制功能;具有1-2个筛选标记;克隆载体必须是安全的,不应含有对受体细胞有害的基因,并且不会任意转入其他生物细胞;易于操作,转化效率高。
现用的载体都是通过改造构建而成的。
宿主细胞的基本条件是:
易于接受外源DNA;自身无限制酶和重组能力;易于生长和筛选;符合安全标准。
pBR322是由几个质粒DNA通过DNA重组技术构建而成的克隆载体,分子的长度为4363bp。
具有氨苄青霉素和四环素两种抗药性标记。
pBR322共有24种限制性内切酶的单一识别位点,其中7种酶(ecoRV,NheI,BamHI,sphI,salI,XmaⅢ,NruI)的识别位点位于四环素抗性基因内部,2种酶(ClaI,HindⅢ)的识别位点存在于这个基因的启动子内部。
所以在这9个限制性位点上插入外源DNA通常都会导致抗四环素基因(tetr)的失活。
3种酶(scaI,PvuI,PstI)在氨苄青霉素抗性基因(ampr)内具单一的识别位点,在这3个位点插入外源DNA则会导致ampr基因的失活。
若将外源基因插入tetr基因,将构成的重组质粒转入对四环素和氨苄青霉素均敏感的受体菌,则在含氨苄青霉素的平面培养基上生长,而在含四环素的平面培养基上不生长的菌落均含有外源基因。
20世纪70年代早期主要利用天然质粒,1977年Bolivar等构建成功pBR322、1982年Viera和Messsing构建成功pUC系列质粒,随后有不少穿梭质粒,表达质粒等问世。
2.pUC载体系列
是由大肠杆菌pBR322质粒与M13噬菌体改建而成的双链DNA质粒载体,含有来自pBR322质粒的复制起点(ori),氨苄青霉素抗性基因(ampr)以及大肠杆菌â半乳糖苷酶基因(lacZ)的启动子及其编码α肽链的基因,在lacZ基因中有一个多克隆位点(MCS)区段。
当外源的DNA片段插入到这些克隆位点使á互补链破坏时,形成的是无活性的â-半乳糖苷酶,被转化的大肠杆菌细胞,在Xgal-IPTG培养基上形成白色菌落,而没有外源DNA插入的质粒转化大肠杆菌细胞后,在Xgal-IPTG培养基上形成蓝色菌落。
pUC质粒载体比pBR322具有更小的相对分子质量,而且由于rop基因的缺失(其基因产物ROP蛋白,控制质粒复制),使得其拷贝数大增,每个细胞可达500-700个拷贝,因此由pUC质粒重组体转化的大肠杆菌细胞,可获得高产量的克隆DNA分子。
pUC18和pUC19的唯一差别是多克隆位点的方向相反。
Xgal(5溴-4-氯-3-吲哚-â-D-半乳糖苷)可被â-半乳糖苷酶水解生成深兰色的5-溴-4-靛兰,IPTG(异丙基硫代â-D-半乳糖苷)可诱导â-半乳糖苷酶á-链的合成。
适合于蓝白选择。
3.ë噬菌体
ë噬菌体的基因组是长度约为50kb的线性双莲DNA分子。
在其两端,各有一条由12个核苷酸组成的互补粘性末端。
当ë噬菌体DNA进入寄主细胞后,线性DNA分子通过粘性末端的碱基配对而结合,形成环状DNA分子。
这种由粘性末端结合形成的双链区段为cos位点。
现用的ë噬菌体载体都是在野生型基础上改造而成的。
改建之后的常用载体有两类:
插入型载体,具有一个可供外源DNA插入的克隆位点,如ëgt10、ëgt11;替换型载体,具有成对的克隆位点,在两个位点之间的ëDNA区段可被外源插入的DNA片段取代,如charon4、charon10、charon35。
插入型载体只能插入较小的外源DNA片段,而替换型载体能插入较大的外源DNA片段(20-24kb左右)。
当重组体DNA分子大于ë噬菌体基因组105%或小于75%时,重组噬菌体的活力会大大下降,不能形成正常大小的噬菌斑,所以重组体DNA分子长度应控制在包装限度范围内。
ë噬菌体重组体分子不具有抗生素抗性选择标记,主要是依据噬菌斑的形态学特征和Xgal-IPTG显色反应来筛选重组子。
cI基因的存在将使λ噬菌体进入溶源状态,因此在培养基上形成的是混浊型的噬菌斑。
cI基因失活或缺失的λ噬菌体在培养基上形成清亮型噬菌斑。
根据这个形态学特征可筛选λ重组体分子。
许多ë载体,如charon2、ëgt11含有编码â半乳糖苷酶基因lacZ(其中引入多克隆位点)。
由这种载体感染的大肠杆菌lac-菌,涂布在含有IPTG和Xgal的培养基平板上,会形成蓝色噬菌斑。
当外源DNA片段插入到这些克隆位点时,寄主细胞就会在Xgal-IPTG培养基上形成无色噬菌斑,如果在替换型载体的可替换区段含有lacZ基因序列,也会出现同样结果。
4.Cosmid质粒
黏粒载体本身长4-6kb,具有质粒和ë噬菌体两种载体的性质,能像质粒一样复制及转化细菌,在细菌中其增殖与质粒复制一样,产生的重组子是菌落而不是噬菌斑,同时也具有ë噬菌体的cos位点,能与ë噬菌体一样在体外被包装成病毒颗粒并感染宿主菌,但是由于在黏粒中克隆基因组文库要比在ë噬菌体中困难得多,只有在靶基因过大,不能作为单个DNA区段在ë噬菌体载体中克隆增殖,或者要分离一系列跨过染色体DNA特大区段的重叠克隆时,才使用黏粒载体。
用于克隆大片段DNA的Cosmid质粒:
5.酵母人工染色体
定向克隆:
两个粘性末端的序列不同,仅按照一个方向插入质粒。
三.外源基因导入宿主细胞
外源基因导入原核细胞的常用方法有:
转染,即用冰冷的CaCl2处理后瞬间加热,将含有外源DNA的质粒导入感受态的宿主细胞;转化,即用噬菌体将外源DNA导入感受态的宿主细胞;电穿孔法,即用脉冲高压电瞬间击穿细胞膜,将含有外源DNA的质粒导入宿主细胞;ë噬菌体的体外包装,将含有外源DNA的ë噬菌体DNA与外壳蛋白在体外包装成噬菌体,可以大幅度提高转化率,包装蛋白有商品出售。
外源基因导入酵母细胞的常用方法有:
用蜗牛消化酶消化细胞壁,制成原生质体,再用CaCl2和聚乙二醇处理,促进重组DNA的吸收。
外源基因导入动物细胞的常用方法有:
磷酸钙共沉淀法;DEAE-葡聚糖或聚阳离子促进吸收法;脂质体转染法;电穿孔法;病毒转染法;显微注射法。
外源基因导入植物细胞的常用方法有:
用纤维素酶消化细胞壁,制成原生质体,再用CaCl2和聚乙二醇处理,促进重组DNA的吸收,也可使用电穿孔法和脂质体转染法;将外源DNA插入Ti质粒的T-DNA,借助土壤农杆菌将外源DNA导入植物细胞;基因枪微弹射击法;显微注射法。
四.阳性克隆的筛选
1.快速裂解菌落鉴定分子大小
从平板中直接挑取菌落裂解后,不需要内切酶消化,直接进行凝胶电泳,与载体DNA比较迁移率,
初步判断是否有插入片段存在,本方法适用于插入片段较大的重组子初步筛选。
2.内切酶图谱鉴定
对于初步筛选鉴定具有重组子的菌落,应小量培养后,再分离出重组质粒或重组噬菌体DNA,用相应的内切酶(1种或2种)切割重组子释放出插入片段,对于可能存在双向插入的重组子,还要用内切酶消化鉴定插入方向,然后凝胶电泳检测插入片段和载体的大小。
3.Southern印迹杂交
为了进一步确定DNA插入片段的正确性,在内切酶消化重组子,凝胶电泳分离后,通过Southern印迹转移将DNA移至硝酸纤维膜上,再用放射性核素或非放射性标记的相应外源DNA片段作为探针,进行分子杂交,鉴定重组子中的插入片段是否是所需的靶基因片段。
4.PCR筛选重组子
一些载体的外源DNA插入位点两侧,存在恒定的序列,用相应的引物对小量抽提的质粒DNA进行PCR分析,不但可迅速扩增插入片段,而且可以直接进行DNA顺序分析。
对于原核或真核系统表达型重组子,其插入片段的序列正确性是非常关键的,故有必要对重组子进行序列测定,DNA序列分析现多采用自动测序仪完成。
5.菌落(或噬菌斑)原位杂交
菌落或噬菌斑原位杂交技术是先将转化菌直接铺在硝酸纤维素薄膜或琼脂平板上,再转移到另一硝酸纤维素薄膜上,用核素标记的特异DNA或RNA探针进行分子杂交,然后挑选阳性克隆菌落。
本方法能进行大规模操作,一次可筛选5×105-5×106个菌落或噬菌斑,对于从基因文库中挑选目的重组子,是一项首选的方法。
典型的细菌转化实验:
第二节基因的分离、合成和测序
一.目的基因的来源
1.基因组DNA的非特异性断裂
超声波处理基因组DNA可得到300bp左右的随机片段,高速组织捣碎器,控制一定的条件也能得到不同大小的DNA片段,如将高分子量DNA1500r/m捣碎30分钟,可得到大约8kb的DNA片段。
由机械处理产生的DNA片段末端不一,断点随机,条件难以掌握,所以目前较少使用这种方法。
2.染色体DNA的限制性内切酶解
Ⅱ型限制性内切酶可专一识别并切割特定的DNA顺序,产生不同类型的DNA末端。
若载体DNA与插入片段用同一种内切酶消化,可以直接进行连接。
内切酶识别的DNA顺序长短与降解后DNA产生的片段大小有直接关系。
若识别顺序为4个碱性对,则该顺序在DNA链上出现的机率为44,即在碱基随机排列的前提下,每256个碱基对就有一个切点。
对于识别6个核苷酸的限制性内切酶,其顺序出现的频率为46(4096),可获得较大的DNA片段,也可用于DNA文库的建立。
3.通过mRNA合成cDNA
基因组DNA中重复顺序和假基因占有很大比重,克隆完整的基因比较困难。
用mRNA反转录成cDNA,得到相应的双链cDNA,再进行克隆,获得较完整的连续编码顺序,容易在宿主细胞中表达。
除建立cDNA文库以外,对于一些高丰度表达、容易纯化的蛋白质,可以直接通过该蛋白质的单克隆抗体纯化该基因的核糖体,再分离该蛋白质的特异mRNA,直接反转录成cDNA,进行基因克隆,从而直接获得该特定基因的克隆,这是用染色体DNA难以达到的克隆效果。
4.人工体外合成DNA片段
随着体外合成DNA的技术日渐完善,合成DNA的长度不断加长。
一些小分子生物活性多肽,可以通过人工合成编码顺序插入载体后,转化细菌进行表达。
分子较大的基因,可以通过分段合成,然后连接组装成完整的基因。
目前已经合成了人胰岛素A、B链基因和干扰素基因,并成功表达,制备成商业产品。
5.聚合酶链反应(PCR)扩增特定基因片段
对于有部分了解或完全清楚的基因,可以通过PCR反应,直接从染色体DNA或cDNA上高效快速地扩增出目的基因片段,然后进行克隆操作。
唯一的要求是,对基因片段两侧的序列了解清楚。
二.基因文库的构建
克隆数目的估算公式为:
N=ln(1-p)/ln(1-f)。
P:
任意基因存在于文库中的概率;f:
克隆DNA(bp)占基因组(bp)的分数。
三.cDNA文库的构建
真核mRNA的分离:
逆转录合成cDNA:
四.克隆基因的分离与鉴定
用克隆杂交对基因组文库进行筛选:
用已知氨基酸序列设计的寡核苷酸探针筛选文库克隆基因:
差别杂交:
若A组细胞用生长因子处理,B组细胞不作处理,将其中的一组mRNA逆转录成cDNA文库,与另一组的mRNA杂交,或将两组的mRNA均逆转录成cDNA再进行分子杂交,不能形成杂交双链的是二者差异表达的基因。
扣除杂交:
比差别杂交省时、省力、灵敏度高,基本原理如图所示。
用Southern杂交法鉴定克隆基因:
五.聚合酶链式反应扩增基因
六.筛选目的基因的其他方法
蛋白质组学:
通过双向电泳,聚焦层析-电泳等方法对比相关样本,确定目标蛋白,经测序用遗传密码推测基因的部分序列,用PCR等方法获取目的基因;
基因芯片:
分析相关样本的mRNA,确定目标基因;
mRNA差异显示:
提取欲对比的两个样本的mRNA,分别用5′T11-MN或5′-T12MN(M代表除T以外的任意核苷酸,N代表任意核苷酸)共12种不同的下游引物合成cDNA的第一链,所得24种cDNA的第一链均用通用引物合成第二链,并引入放射性同位素标记,将相对应的12对cDNA分别用测序胶电泳分离,放射自显影,对比二者的条带,找出差异,回收特异性差别条带,扩增,测序,或合成探针筛选基因。
表达序列库:
将基因克隆到表达载体,表达后用免疫学方法、产物功能测定、产物的结构研究等方法鉴定特定的基因。
七.基因定位诱变
八.DNA序列的测定
第三节克隆基因的表达
一.基因表达的控制元件
在典型的表达载体中,真核编码序列被插入启动子和转录起始点的下游,插入位点的下游应当有转录终止信号,转录产生的mRNA应包含核糖体结合位点。
二.RNA的表达
表达载体携带能够被噬菌体SP6的RNA聚合酶辨认的启动子.SP6RNA聚合酶可以在体外高效率地转录,将任何目的DNA插入SP6启动子下游的多接头克隆位点,可以连续的转录产生RNA,转录起始前,环状的表达载体会在插入位点或其附近被单一位点裂解而线性化,因此,转录会在固定的位点终止。
三.蛋白质的表达
1.表达非融合蛋白
用原核生物对真核基因进行非融合表达,容易得到较大的表达量,但表达产物不易形成正确的折叠,不能被糖基化,容易被分解,或形成包含体,裂解包含体时,蛋白质会变性,需要复性,才能得到有活性的蛋白质。
融合lac和trp的启动子,可被IPTG诱导,是最常用的原核启动子。
2.表达融合蛋白
融合蛋白的N末端由原核DNA序列编码,C端由真核DNA的完整序列编码,含原核细胞多肽的融合蛋白可避免细菌蛋白酶的破坏。
表达融合型蛋白时,为了得到正确的真核蛋白,在插入真核基因时,其阅读框架与融合的DNA片段的阅读框架要一致,翻译时,才不至于产生移码突变。
工程菌必须在有足够量的繁殖以后,再表达目的基因,否则,没有足够的菌量,就得不到足够的表达产物。
通常在细菌达到对数生长期后,再加入诱导物,诱导目的基因的表达,X-gal是常有的诱导物。
5-溴-4-氯-3-吲哚-β-D-半乳糖苷:
3.表达分泌蛋白
表达分泌蛋白是防止宿主菌对表达产物的降解,减轻宿主细胞代谢负荷及恢复表达产物天然构象的最有力措施。
在原核表达系统中,人们研究比较多的主要是大肠杆菌。
大肠杆菌主要由四部分组成:
胞质、内膜、外膜及内外膜之间的周间质。
一般情况下,所谓“分泌”是指蛋白质从胞质跨过内膜进入周间质这一过程。
而蛋白质从胞质跨过内、外膜进入培养液的情况较为少见,被称为“外排”以区别于“分泌”。
4.外源基因在酵母中的克隆和表达
在酵母中表达真核基因,表达产物容易形成正确的折叠和糖基化,但不容易形成较大的表达量。
通常将目的基因插入穿梭载体,在大肠杆菌中扩增后,再转入酵母菌进行表达。
用酵母菌表达的不少蛋白质已经作为基因工程产品,产生了很好的经济效益和社会效益。
典型的穿梭质粒,分别含有酵母和细菌的起始位点。
整合载体(yeastintegratingplasmid)无酵母的复制起点,必须整合到染色体中才能稳定存在。
附加体质粒(yeastintegratingplasmid)有酵母的复制起点,在酵母细胞中以高拷贝存在。
复制质粒(yeastintegratingplasmid)有酵母的自主复制序列(autonomousreplicatingsequence,ARS),在酵母细胞中以中等拷贝存在。
含着丝粒(CEN)的质粒(yeastcentromere-containingplasmid)含有ARS和CEN,在酵母细胞中以单拷贝稳定存在。
酵母的表达载体必须含有可以被RNA聚合酶Ⅱ识别的强启动子,如可诱导型的GAL(半乳糖激酶)、PHO5(碱性磷酸酯酶),组成型的ADH1(醇脱氢酶)、PGK(磷酸甘油激酶)、GPD(葡萄糖-6-磷酸脱氢酶)等的启动子。
酵母人工染色体(yeastartificialchromosome)含有ARS和CEN和TEL端粒(telomere),能以微型染色体存在,可以克隆超过100kb的DNA片断。
外源基因在植物细胞中的克隆和表达:
植物细胞有全能性,转基因的细胞或组织容易培养成植株,但将基因转入植物细胞较困难,被转入的基因有时不能表达,或表达量不足以引起性状变化,有时会抑制内源基因的表达。
转基因作物已有大规模种植,以抗性基因为主,也有耐贮藏和改善品质的成功范例。
使用共整合载体时,常用三个菌株配合:
具有辅助转移质粒的大肠杆菌;具有携带目的基因质粒的大肠杆菌;具有onc-Ti质粒衍生的受体载体的根瘤土壤杆菌菌株。
胭脂碱合成酶-新霉素抗性基因:
T-DNA右端边缘;T-DNA左端边缘。
编码多种转移和整合作用相关的酶和蛋白质。
外源基因在动物细胞中的克隆和表达:
猿猴细胞为SV40的受纳细胞,啮齿类细胞为非受纳细胞,人体细胞为半受纳细胞。
T抗原基因、外壳蛋白基因。
构建逆转录病毒载体时,将原病毒DNA插入大肠杆菌的质粒pBR322,然后用抗性基因如新霉素抗性基因(neo)、黄嘌呤-鸟嘌呤磷酸核糖转移酶基因(gpt)、二氢叶酸还原酶基因(dhfr)等取代病毒的gag(groupspecificantigen,种群特异性抗原)、pol(polymerase,聚合酶)和env(envelope,被膜)基因的全部或大部。
包装位点:
负链引物结合位点(negativestrandprimerbindingsite)。
绿色荧光蛋白(greenflourescentpyotein,GFP)为报告基因。
Per基因被置于GFP的上游,Per基因编码的蛋白质与果蝇的昼夜节律调节有关,图中所示果蝇头部的绿色荧光分散存在,并随昼夜节律变化,说明单个细胞有自己独立的生物钟。
双杂交系统确定蛋白质-蛋白质相互作用,将目标蛋白Y与TA融合表达,若Y与X可以相互作用,则DB和TA靠近,可以启动报告基因的表达。
第四节蛋白质工程
蛋白质工程可用于按事先的设计改造蛋白质,首先要充分研究蛋白质的一级结构和高级结构,提出改造方案,再用定点突变的方法改造该蛋白质的基因,用改造后的基因表达蛋白质,研究其性能,必要时提出进一步的改造方案,对蛋白质进行进一步的改造。
蛋白质工程已有一些成功的范例,如改造水蛭素的47位(AsntoLys)提高了抗凝血效率;改造生长激素提高了其特异性;融合t-PA的识别控制序列和u-PA(尿激酶型纤溶酶原激活剂)的蛋白酶序列,可以提高其溶血栓能力和导向性。
但由于问题的复杂性,蛋白质工程的研究大多数属于方法学研究。
增加dNTP浓度等方法可以提高PCR的差错率。
DNaseⅠ部分水解,得到平末端或接近平末端的双链片段。
图中未能表示。
扩增重组合基因,进行表达和选择。
人类疾病的基因治疗:
基因治疗的基本条件:
病因明确的单基因病;仅限于体细胞治疗;可提取病人的靶细胞,基因操作后再回输病人体内;治疗效果要大于对病人的危害;要用动物实验充分证明其疗效和安全性。
基因治疗的策略:
基因矫正;基因置换;基因增补;基因失活。
基因治疗的途径:
间接体内疗法(多用逆转录病毒);直接体内疗法(多用腺病毒)。
基因治疗面临的困难:
多数疾病的分子机制不明;基因表达调控的机制不明;治疗方案多采用间接体内疗法,细胞体外培养过程中的变化,回输体内的去向不够明确;外源基因随机整合的潜在危险值得关注。
逆转录病毒介导的基因治疗:
腺病毒介导的基因治疗:
转基因动物:
转基因动物多用于基础研究,基因治疗已取得一些成就,担仍有不少问题需要解决。
动物生物反应器的研究已有一定成就,但在生产上应用也不少问题需要解决。