届高考化学二轮复习专练十九电解池新人教版.docx
《届高考化学二轮复习专练十九电解池新人教版.docx》由会员分享,可在线阅读,更多相关《届高考化学二轮复习专练十九电解池新人教版.docx(12页珍藏版)》请在冰豆网上搜索。
届高考化学二轮复习专练十九电解池新人教版
电解池
主要考查电解池的工作原理、电解产物的判断及相关电极反应的书写、电解的规律及有关计算、电解原理的应用。
1.【2017课标Ⅱ卷】用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4—H2C2O4混合溶液。
下列叙述错误的是
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为:
A3++3e-=Al
D.硫酸根离子在电解过程中向阳极移动
【答案】C
【解析】A、根据原理可知,Al要形成氧化膜,化合价升高失电子,因此铝为阳极,故A说法正确;B、不锈钢网接触面积大,能增加电解效率,故B说法正确;C、阴极应为阳离子得电子,根据离子放电顺序应是H+放电,即2H++2e-=H2↑,故C说法错误;D、根据电解原理,电解时,阴离子移向阳极,故D说法正确。
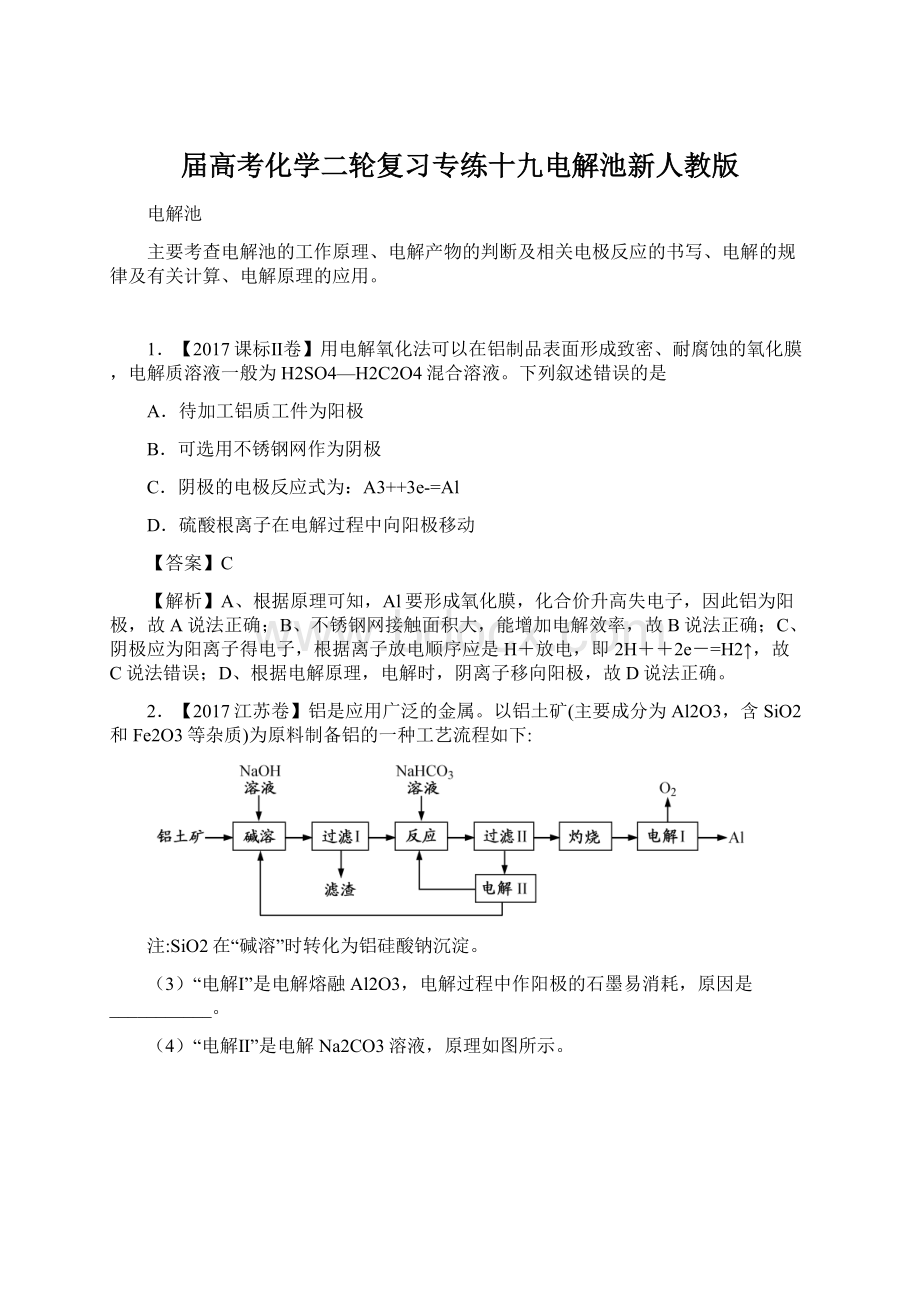
2.【2017江苏卷】铝是应用广泛的金属。
以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:
SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
【答案】(3)石墨电极被阳极上产生的氧气氧化
(4)4CO32-+2H2O-4e-=4HCO3-+O2↑H2
【解析】结合流程及题中信息可知,铝土矿在碱溶时,其中的氧化铝和二氧化硅可溶于强碱溶液,过滤后,滤液中偏铝酸钠与碳酸氢钠反应生成氢氧化铝沉淀和碳酸钠,氢氧化铝经灼烧后分解为氧化铝,最后电解熔融的氧化铝得到铝。
碳酸钠溶液经电解后可以再生成碳酸氢钠和氢氧化钠进行循环利用。
(3)电解I过程中,石墨阳极上氧离子被氧化为氧气,在高温下,氧气与石墨发生反应生成气体,所以,石墨电极易消耗的原因是被阳极上产生的氧气氧化。
(4)由图中信息可知,生成氧气的为阳极室,溶液中水电离的OH-放电生成氧气,破坏了水的电离平衡,碳酸根结合H+转化为HCO3-,所以电极反应式为4CO32-+2H2O-4e-=4HCO3-+O2↑,阴极室氢氧化钠溶液浓度变大,说明水电离的H+放电生成氢气而破坏水的电离平衡生成大,所以阴极产生的物质A为H2。
3.【2017天津卷】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。
考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。
回答Ⅰ和Ⅱ中的问题。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
【答案】(4)在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液
CrO42-和Cr2O72-NaOH和H2
4.【2016新课标全国Ⅰ卷】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
【答案】B
【解析】在负极区发生的电极反应为4H2O+4e-===2H2↑+4OH-,在正极区发生的电极反应为2H2O-4e-===O2↑+4H+,故正极区pH减小,A选项错误;Na+移向负极区,生成NaOH,SO
移向正极区,生成H2SO4,B选项正确;根据负极区电极反应可知C选项错误;每通过1mol电子,有0.25molO2生成,D选项错误。
5.【2016新课标1卷】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是______。
【答案】(3)NaOH溶液;Na2CO3溶液;ClO2−(或NaClO2);
【解析】(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;
6.【2015四川卷】用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式:
Cl-+2OH--2e-===ClO-+H2O
C.阴极的电极反应式:
2H2O+2e-===H2↑+2OH-
D.除去CN-的反应:
2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O
【答案】D
【解析】A.若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极,正确;B.阳极Cl-放电生成ClO-,Cl的化合价升高,故在阳极发生氧化反应,又已知该溶液呈碱性,正确;C.阳离子在电解池的阴极得电子发生还原反应,在碱性条件下,H2O提供阳离子(H+),正确;D.由于溶液是碱性条件,故除去CN-发生的反应为2CN-+5ClO-+H2O===N2↑+2CO2↑+5Cl-+2OH-,错误。
7.【2015福建高考】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。
下列说法正确的是
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1molO2,有44gCO2被还原
D.a电极的反应为:
3CO2+18H+-18e-===C3H8O+5H2O
【答案】B
解析:
结合装置图为电解装置,模拟“人工树叶”,故为电能转化为化学能,A项错误;b极连接电源的正极,为阳极,在电解池中H+为阳离子,向a极(阴极)区移动,B项正确;右侧H2O→O2发生的是氧化反应,每生成1molO2,转移4mol电子,C3H8O中碳元素的化合价是-2,3CO2→C3H8O,转移18mol电子,故生成1molO2消耗2/3molCO2,C项错误;a电极发生的是还原反应:
3CO2+18H++18e-===C3H8O+5H2O,D项错误。
1.【2016·潍坊市统考】一定条件下,利用如图所示装置可实现有机物苯(C6H6)到环己烷(C6H12)的转化。
下列叙述错误的是
A.导线中电子移动方向为D→A
B.生成目标产物的电极反应式为C6H6+6H++6e-===C6H12
C.装置图右侧导出的气体是氧气
D.上述过程中电能转化为化学能
【答案】A
【解析】根据题图可知,左侧发生苯转化为环己烷的反应,电极反应式为C6H6+6H++6e-===C6H12,B项正确;左侧电极D上发生还原反应,电极D为阴极,则A为电源负极,导线中电子移动方向为电源负极A→电解池阴极D,A项错误;右侧电极E上发生氧化反应:
2H2O-4e-===O2↑+4H+,导出的气体为氧气,C项正确;题中装置为电解池,电能转化为化学能,D项正确。
2.【2017·保定模拟】用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。
其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法中不正确的是
A.X为直流电源的负极,Y为直流电源的正极
B.阳极反应为4OH--4e-===2H2O+O2↑
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
【答案】B
【解析】根据Na+和SO
的移向可知Pt(Ⅰ)为阴极,反应为2H++2e-===H2,Pt(Ⅱ)为阳极,反应为SO
-2e-+H2O===SO
+2H+。
3.【2017届宁夏银川市高三下学期第三次模拟考试】某化学兴趣小组设计了如图所示的电化学装置:
下列说法不正确的是
A.乙池工作时,CO32-不断移向负极
B.乙池负极反应为CH30H-6e-+3CO32-=4CO2+2H2O
C.甲池中Fe电极发生的反应为2Cl--2e-=Cl2
D.为了使电池持续供电,工作时必须有CO2参与循环
【答案】C
【解析】A、乙池工作时作为原电池,甲醇是负极,CO32-不断移向负极,故A正确;B、乙池甲醇作还原剂,失电子,负极反应为CH30H-6e-+3CO32-=4CO2+2H2O,故B正确;C、甲池中Fe电极是阳极,发生的反应为Fe-2e-=Fe2+,故C错误;D、O2在正极反应为:
O2+2CO2+4e―=2CO32―,消耗CO2,为了使电池持续供电,工作时必须有CO2参与循环,故D正确;故选C。
4.【2017届云南省昆明市第一中学高三第八次月考】工业上可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得NaHSO3溶液以实现吸收液的回收再利用,装置如图所示,则工作一段时间后,下列说法正确的是
A.电源a端是正极
B.阴极区的pH减小
C.阳极的电极反应式为HSO3--2e-+H2O=SO42-+3H+
D.电路中每通过0.2mol电子,能产生2.24LH2
【答案】C
【解析】A.根据阴阳离子的移动方向知,左边电极为阴极,所以a为直流电源的负极,A错误;B.阴极区消耗H+生成氢气,氢离子浓度减小,溶液的pH增大,B错误;C.阳极上HSO3-反应生成SO42-,电极反应式为HSO3--2e-+H2O=SO42-+3H+,C正确;D.电路中每通过0.2mol电子,能产生标准状况下2.24LH2,D错误。
故选C。
5.【2017届甘肃省西北师范大学附属中学高三下学期第四次校内诊断】构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”。
当电解质中某离子的浓度越大时其氧化性或还原性越强。
如图,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液,A、B均为Ag电极。
实验开始先闭合K2,断开K1,发现电流计指针发生偏转。
下列说法不正确的是
A.一段时间后电流计指针将归零,此时可视为反应不再进行
B.当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升
C.当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加
D.实验开始先闭合K2,断开K1,此时NO3-向B电极移动
【答案】C
【解析】A.闭合K2,构成浓差电池,由于甲池中银离子浓度大,氧化性强,发生还原反应,甲池为正极,乙池为负极,甲池中硝酸银的浓度逐渐减小,乙池中硝酸银的浓度逐渐增大,一段时间后,浓度相等,不再构成浓差电池,电流计指针将归零,反应不再进行,故A正确;B.当电流计指针归零后,闭合K1,断开K2后,构成电解池,乙池中银为阳极,硝酸银浓度逐渐增大,故B正确;C.当电流计指针归零后,闭合K1,断开K2后,构成电解池,乙池中银为阳极,银电极逐渐溶解,质量减小,故C错误;D.实验开始先闭合K2,断开K1,构成浓差电池,由于甲池中银离子浓度大,氧化性强,发生还原反应,甲池为正极,乙池为负极,甲池中硝酸银的浓度逐渐减小,乙池中硝酸银的浓度逐渐增大,此时NO3-向B电极移动,故D正确;故选C。
6.【2017届宁夏石嘴山市第三中学高三下学期第四次模拟】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是
A.M室发生的电极反应式为:
2H2O-4e-=O2↑+4H+
B.N室中:
a%C.b膜为阴离子交换膜
D.理论上每生成1mol产品,阴极室可生成5.6L气体
【答案】D
【解析】A.M室为阳极室,发生氧化反应,其电极反应式为2H2O-4e-=O2↑+4H+,故A正确;B.N室为阴极室,发生的电极反应式为2H2O+2e-=H2↑+2OH-,原料室的Na+透过阳离子交换膜进入阴极室,则NaOH的质量百分数为a%7.【2017课标Ⅰ卷】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。
下列有关表述不正确的是
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
【答案】C
【解析】本题使用的是外加电流的阴极保护法,钢管柱与电源的负极相连,被保护。
A.外加强大的电流可以抑制金属电化学腐蚀产生的电流,从而保护钢管柱,A正确;B.通电后,被保护的钢管柱作阴极,高硅铸铁作阳极,因此电路电子被强制从高硅铸铁流向钢管桩,B正确;C.高硅铸铁为惰性辅助阳极,所以高硅铸铁不损耗,C错误;D.通过外加电流抑制金属电化学腐蚀产生的电流,因此通入的保护电流应该根据环境条件变化进行调整,D正确。
答案选C。
8.【2017届四川省成都市第七中学高三周测】在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图。
下列说法不正确的是
A.a电极为电解池的阳极
B.阳极的电极反应式:
NH4++3F--6e—===NF3+4H+
C.H+由b极移向a极,并参与电极反应
D.电解过程中可能还会生成少量氧化性极强的气体单质,该气体的分子式为F2
【答案】C
【解析】A、根据图中信息可知,氢离子在b极得电子产生氢气,故b极为阴极,a极为阳极,选项A正确;B、阳极铵根离子得电子产生NF3,其电极反应式为NH4++3F--6e—=NF3+4H+,选项B正确;C、电解池中阳离子定向移动到阴极,故H+由a极移向b极,并参与电极反应H++2e—=H2↑,选项C不正确;D、当氟离子浓度较大时,氟离子失电子产生氟气,选项D正确。
答案选D。
9.【2017届山东省聊城市高三第三次模拟考试】用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是
A.ab段H+被还原,溶液的pH增大
B.cd段相当于电解水
C.c点时加人适量CuCl2固体,电解液可恢复原来浓度
D.原溶液中KCl和CuSO4的物质的量浓度之比为2:
1
【答案】B
【解析】用惰性电极电解等体积的KCl和CuSO4混合溶液,阴极离子放电顺序是Cu2+>H+,阳极上离子放电顺序是Cl->OH-,电解过程中分三段:
第一阶段:
阳极上电极反应式为2Cl--2e-=Cl2↑、阴极电极反应式为Cu2++2e-=Cu,铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升;第二阶段:
阳极上电极反应式为4OH--4e-=2H2O+O2↑,阴极反应先发生Cu2++2e-=Cu,反应中生成硫酸,溶液pH降低;第三阶段:
阳极电极反应式为4OH--4e-=2H2O+O2↑、阴极电极反应式为2H++2e-=H2↑,实质是电解水,溶液中硫酸浓度增大,pH继续降低。
A.ab段由于铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升,铜离子为被还原,A错误;B.由上述分析可知,cd段相当于电解水,B正确;C.电解至c点时,溶液中溶质为硫酸、硫酸钾,往电解液中加入适量CuCl2固体,不能使电解液恢复至原来的浓度,C错误;D.图象中具体数量关系未知,不能计算原混合溶液中KCl和CuSO4的浓度之比,D错误,答案选B。
10.【辽宁省葫芦岛市2017届高三第二次模拟考试】据报导,我国已研制出“可充室温钠-二氧化碳电池”,电极材料为钠金属片和碳钠蜜管,电解液为高氯酸钠-四甘醇二甲醚,电池总反应为:
4Na+3CO2
2Na2CO3+C,生成固体Na2CO3沉积在碳钠米管上。
下列叙述不正确的是
A.放电时钠金属片发生氧化反应
B.充电时碳钠米管接直流电源的正极
C.充电时的阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+
D.放电时每消耗3molCO2,转移12mol电子
【答案】D
发生氧化反应,则阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+,故C正确;D.放电时每消耗3molCO2,4molNa失去电子,转移4 mol电子,故D错误;故选D。
11.【2017届全国名校联盟高三联考试卷六】载人空间站的生态系统中.要求分离人呼出的二氧化碳,同时需要提供氧气。
某电化学装置利用太阳能转化的电能可以实现上述要求,同时还有燃料一氧化碳生成,该电化学装置的总反应为2CO2
2CO+O2。
下列判断错误的是
A.该装置的阴极反应式是2CO2+4e-+2H2O=2CO+4OH–
B.该装置的阳极反应式是4OH-一4e-=2H2O+O2↑
C.每处理44gCO2,可得到22.4LCO和11.2LO2
D.反应结束后电解池溶液的pH保待不变
【答案】C
【解析】A、根据总反应,阴极上得到电子,化合价降低,即电极反应式为2CO2+2H2O+4e-=2CO+4OH-,故A说法正确;B、阳极上失去电子,化合价升高,电极反应式4OH--4e-=2H2O+O2↑,故B说法正确;C、因为题目中没有说明反应条件,因此无法计算气体体积,故C说法错误;D、根据总反应式,反应结束后,电解池溶液中pH几乎不变,故D说法正确。
12.【2017届内蒙古鄂尔多斯市高三模拟考试】现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法错误的是
A.石墨I是原电池的负极,发生氧化反应
B.甲池中的CO32-向石墨I极移动
C.乙池中左端Pt极电极反应式:
N2O4-2e-+2HNO3=2N2O5+2H+
D.若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.05mol
【答案】D
【解析】A、甲池为电池,乙池为电解池,甲池中通CO一极为负极,负极上失去电子,化合价升高,发生氧化反应,故A说法正确;B、根据原电池的工作原理,阴离子向负极移动,即CO32-向石墨I极移动,故B说法正确;C、乙池左端连接电源的正极,乙池左端电极为阳极,因此阳极电极反应式为N2O4-2e-+2HNO3=2N2O5+2H+,故C说法正确;D、消耗2.24LO2,转移电子物质的量为2.24×2×2/22.4mol=0.4mol,乙池的右端电极为阴极,电极反应式NO3-+3e-+4H+=NO↑+2H2O,因此没有氢气产生,故D说法错误。