免疫球蛋白结构.docx
《免疫球蛋白结构.docx》由会员分享,可在线阅读,更多相关《免疫球蛋白结构.docx(13页珍藏版)》请在冰豆网上搜索。
免疫球蛋白结构
抗体的结构
一、单体
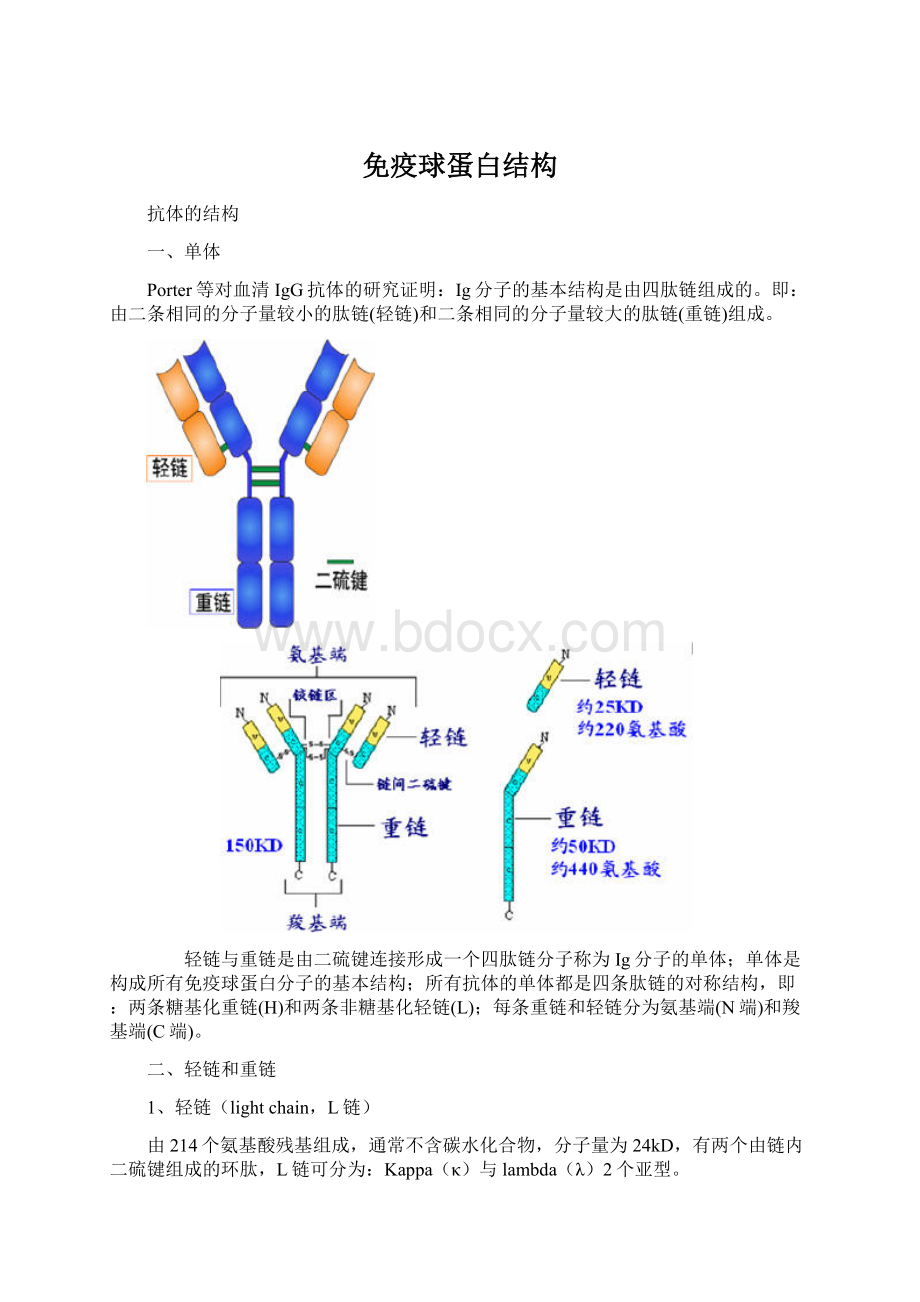
Porter等对血清IgG抗体的研究证明:
Ig分子的基本结构是由四肽链组成的。
即:
由二条相同的分子量较小的肽链(轻链)和二条相同的分子量较大的肽链(重链)组成。
轻链与重链是由二硫键连接形成一个四肽链分子称为Ig分子的单体;单体是构成所有免疫球蛋白分子的基本结构;所有抗体的单体都是四条肽链的对称结构,即:
两条糖基化重链(H)和两条非糖基化轻链(L);每条重链和轻链分为氨基端(N端)和羧基端(C端)。
二、轻链和重链
1、轻链(lightchain,L链)
由214个氨基酸残基组成,通常不含碳水化合物,分子量为24kD,有两个由链内二硫键组成的环肽,L链可分为:
Kappa(κ)与lambda(λ)2个亚型。
2、重链(heavychain,H链)
由450-550个氨基酸残基组成,分子量55-75kD,含糖数量不同,4-5个链内二硫键,可分为5类,μ、γ、α、δ、ε链,不同的H链与L链(κ或λ)组成完整的Ig分子。
分别称为:
IgM,IgG,IgA,IgD和IgE。
三、可变区和恒定区
通过对H链或L链的氨基酸序列比较分析,发现:
其N-末端序列变化很大,称此区为可变区(V区);
C-末端氨基酸则相对稳定,变化很小,称此区为恒定区(C区)。
1、可变区(Variableregion,V区)
L链N端1/2处(VL)108-111个氨基酸残基,H链N端1/5-1/4处(VH)118个氨基酸残基,V区有一个肽环65-75个氨基酸残基。
可变区可分为高变区(hypervariableregion,HVR)和骨架区(frameworkregion,FR),VL的HVR在24-34,50-56,89-97氨基酸位置。
VH的HVR在31-35,50-56,95-102氨基酸位置。
分别称为VL和VH的HVR1,HVR2,HVR3。
高变区为抗体与抗原的结合位置,称为决定簇互补区(complementarity-determiningregion,CDR),VL和VH的HVR1,HVR2,HVR3又分别称为CDR1,CDR2,CDR3,其中CDR3具有更高的高变程度,H链在与抗原结合中起重要的作用。
2、恒定区(constantregion,C区)
L链C端1/2处,105个氨基酸残基,H链C端3/4-4/5处,331-431个氨基酸残基。
在同一种属动物中是比较恒定的,是制备第二抗体进行标记的重要基础。
四、功能区
链内二硫键折叠成球形区称为功能区(domain)约由110个氨基酸组成。
氨基酸的顺序具有高度的同源性。
1、L链功能区:
2个,(VL,CL各一个)
2、H链功能区:
IgG,IgA,IgD,4个(V区1个,C区3个),IgM,IgE,5个(V区1个,C区4个)
3、功能区的β片层结构:
抗体的L链和H链中V区或C区每个功能区的二级结构是反向平行的β片层结构。
4、功能区的作用:
(1)VL和VH是抗原结合的部位。
(2)CL和CH1上具有同种异型的遗传标记。
(3)IgG的CH2和IgM的CH3具有补体C1q结合位点;IgG借助CH2部分可通过胎盘
(4)CH3或CH4具有结合单核细胞、巨噬细胞、粒细胞、B细胞、NK细胞Fc段受体的功能,不同的抗体可与不同的细胞结合,产生不同的免疫效应。
5、铰链区
(1)铰链区不是一个独立的功能区,位于CH1与CH2之间;包括H链间二硫键,该区富含脯氨酸,不形成α-螺旋。
(2)当Ab与Ag结合时,铰链区发生扭曲,使Ab的2个抗原结合点更好地与2个抗原决定簇互补。
(3)由于CH2和CH3构型变化,显示出活化补体、结合组织细胞等生物学活性。
(4)含有木瓜蛋白酶、胃蛋白酶的水解位点。
五、酶解片段
1.木瓜蛋白酶的水解片段
1959年Porter用木瓜蛋白酶(papain)水解兔IgG分子,将IgG从绞链区二硫键的近N端侧切断,从而将免疫球蛋白裂解为三个片段,即2个相同的Fab段和1个Fc段。
每一个Fab段即抗原结合片段(fragmentantigenbinding,Fab),含有一条完整的L链和H链近N端侧的1/2。
每个Fab段结合抗原是单价的,即只能结合一个抗原决定簇。
因此不能连结成较大的抗原抗体复合物,不出现凝集或沉淀现象。
Fab中的约1/2H链部分称为Fd段,约含225个氨基酸残基,包括VH、CH1和部分绞链区。
Fc段在低温或低离子强度下可形成结晶,故称为可结晶片段(fragmentcrystallizable,Fc),Fc段含有两条H链羧基端(C端)的一半,包含CH2和CH3两个功能区,它无抗体活性。
Ig在异种间免疫所具有的抗原性主要存在于Fc段,同时Fc段还具有活化补体、亲细胞、通过胎盘和介导与细菌蛋白结合等生物学活性。
2、胃蛋白酶水解片段
1960年Nisonoff等最早用胃蛋白酶水解兔IgG分子,可将IgG从绞链区重链间二硫键近C端切断,将其裂解为大小不等的两个片段。
大片段为1个Fab双体,以F(ab')2表示。
F(ab')2由一对L链和一对略大于Fd的H链(称为Fd')组成。
Fd'约含有235个氨基酸残基,包括VH、CH1和绞链区。
F(ab')2结合抗原为双价,可结合两个抗原决定簇,其结合抗原的亲合力要大于单价的Fab,与抗原结合后可出现凝集或沉淀现象。
由于F(ab')2保持了结合相应抗原的生物学活性,又减少或避免了Fc段抗原性可能引起的副作用,因而在生物制品中有实际应用价值。
虽然F(ab')2在与抗原结合特性方面同完整的Ig分子一样,但由于缺乏Ig中的Fc部分,故不具备固定补体及与细胞膜表面Fc受体结合的功能。
小片段Fc可被胃蛋白酶继续水解为小分子多肽,以Fc'表示,不再具有任何生物学活性。
六、J链和分泌成分
1、J链(joiningchain)
(1)存在于二聚体IgA和五聚体IgM中;化学本质为酸性糖蛋白,分子量约15ku,含有8个半胱氨酸残基。
(2)以二硫键连接到μ链或α链的羧基端的半胱氨酸,对抗体二聚体、五聚体的组成及在体内转运具有一定的作用。
2、分泌成分(secretorycomponent,SC)
(1)是二聚体IgA上的一个辅助成分;
(2)由上皮细胞合成,化学本质为糖蛋白,分子量约为75ku;
(3)以共价形式结合到IgA分子,并一起被分泌到粘膜表面,又称分泌片(secretorypiece,SP);
(4)可抵抗外分泌液中的蛋白水解酶对二聚体IgA的降解。