高考化学一轮考点集锦《常见阳离子的检验》doc.docx
《高考化学一轮考点集锦《常见阳离子的检验》doc.docx》由会员分享,可在线阅读,更多相关《高考化学一轮考点集锦《常见阳离子的检验》doc.docx(36页珍藏版)》请在冰豆网上搜索。
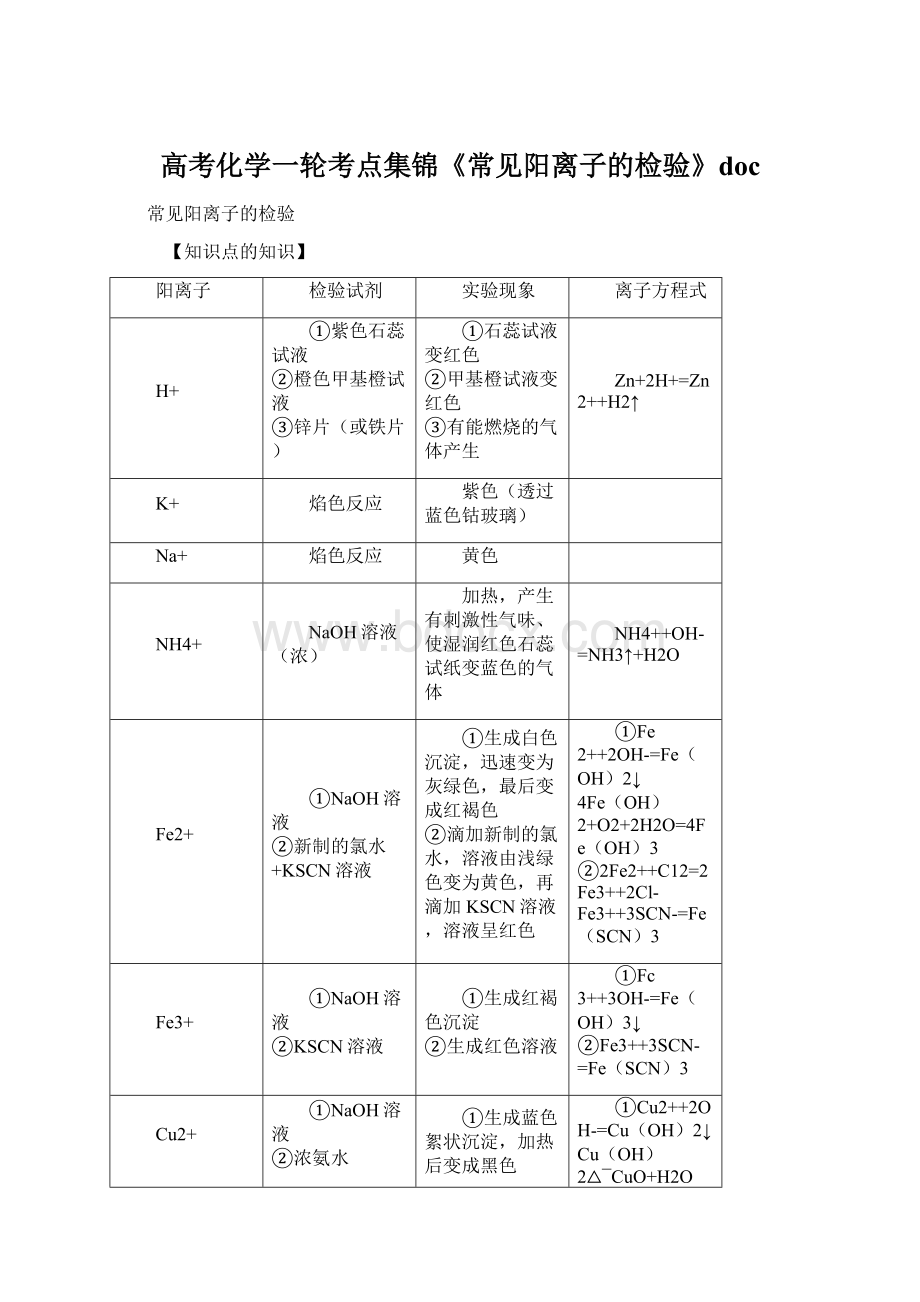
高考化学一轮考点集锦《常见阳离子的检验》doc
常见阳离子的检验
【知识点的知识】
阳离子
检验试剂
实验现象
离子方程式
H+
①紫色石蕊试液
②橙色甲基橙试液
③锌片(或铁片)
①石蕊试液变红色
②甲基橙试液变红色
③有能燃烧的气体产生
Zn+2H+=Zn2++H2↑
K+
焰色反应
紫色(透过蓝色钴玻璃)
Na+
焰色反应
黄色
NH4+
NaOH溶液(浓)
加热,产生有刺激性气味、使湿润红色石蕊试纸变蓝色的气体
NH4++OH-=NH3↑+H2O
Fe2+
①NaOH溶液
②新制的氯水+KSCN溶液
①生成白色沉淀,迅速变为灰绿色,最后变成红褐色
②滴加新制的氯水,溶液由浅绿色变为黄色,再滴加KSCN溶液,溶液呈红色
①Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
②2Fe2++C12=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
Fe3+
①NaOH溶液
②KSCN溶液
①生成红褐色沉淀
②生成红色溶液
①Fc3++3OH-=Fe(OH)3↓
②Fe3++3SCN-=Fe(SCN)3
Cu2+
①NaOH溶液
②浓氨水
①生成蓝色絮状沉淀,加热后变成黑色
②生成的蓝色沉淀,溶于过量浓氨水中,呈深蓝色溶液
①Cu2++2OH-=Cu(OH)2↓
Cu(OH)2△¯CuO+H2O
②Cu2++2NH3•H2O=
Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3•H2O=
[Cu(NH3)4]2++2OH-
+4H2O
Ag+
①盐酸或氯化物+稀HNO3
②NaOH溶液
③氨水
①生成白色沉淀,白色沉淀不溶于稀HNO3
②生成白色沉淀,并迅速变为棕黑色
③生成白色沉淀,过量的氨水使沉淀溶解
①Ag++C1-=AgCl↓
②Ag++OH-=AgOH↓
2AgOH=Ag2O+H2O
③Ag++2NH3•H2O=
AgOH↓+2NH4+
AgOH+2NH3•H2O=
[Ag(NH3)2]++2H2O
Al3+
①氨水
②NaOH溶液
①产生白色沉淀
②产生白色胶状沉淀,过量的NaOH溶液使沉淀溶解
①A13++3NH3•H2O=
Al(OH)3↓+3NH4+
②A13++3OH-=Al(OH)3↓
A1(OH)3+OH-=A1O2-+2H2O
Mg2+
NaOH溶液
产生白色絮状沉淀,过量的NaOH溶液不能使沉淀溶解
Mg2++2OH-=Mg(OH)2↓
Ca2+
Na2CO3溶液+稀盐酸
产生白色沉淀,沉淀溶于稀盐酸中
Ca2++CO32-=CaCO3↓
CaCO3+2H+=
常见阳离子的检验参考答案与试题解析
一.选择题(共18小题)
1.甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH﹣、Cl﹣、HCO3﹣离子中的两种组成,可以发生如图转化,下列说法正确的是( )
A.甲为AlCl3,乙为NaHCO3
B.溶液丙中还可以大量共存的离子有:
Fe2+、NO3﹣、SO42﹣
C.在甲中滴加丁开始反应的离子方程式:
HCO3﹣+Ba2++OH﹣=BaCO3↓+H2O
D.白色沉淀A可能溶解在溶液D中
考点:
常见阳离子的检验;常见阴离子的检验.
专题:
物质检验鉴别题.
分析:
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH﹣、Cl﹣、HCO3﹣离子中的两种组成,依据离子共存原则,H+只能与Cl﹣生成HCl,Al3+只能与Cl﹣生成AlCl3,依据甲溶液能和乙溶液生成沉淀,气体和氯化钠,甲和丙生成气体和氯化钠,故甲和乙中含有能双水解的离子,且甲中含有Na+,据此解答即可.
解答:
解:
溶液中存在H+、Na+、Al3+、Ba2+、OH﹣、Cl﹣、HCO3﹣,故依据离子能大量共存的原则得出甲乙丙丁中含有两种物质,即:
HCl和AlCl3,因为甲溶液能和乙溶液生成沉淀,气体和氯化钠,故甲和乙中含有能双水解的离子,即Al3+和HCO3﹣生成的气体B为二氧化碳,沉淀A为氢氧化铝,然后依据甲与丙生成气体,则甲为NaHCO3,那么乙为AlCl3,甲与丁生成白色沉淀,则丁含有钡离子且与甲生成沉淀,则丁为氢氧化钡,丙为HCl,
A、依据以上分析得出甲应为碳酸氢钠,故A错误;
B、据分析可知,丙为HCl,含有H+,故Fe2+、NO3﹣不能与其共存,故B错误;
C、甲中滴加丁,甲是过量的,那么Ba(OH)2应满足阳离子:
阴离子=1:
2的关系,故C错误;
D、白色沉淀A为氢氧化铝能溶于强碱氢氧化钡,故D正确,故选D.
点评:
本题主要考查的是常见离子之间的反应以及物质的推断,有一定难度,需要认真整理.
2.水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]﹣、SiO32﹣、CO32﹣、SO32﹣、SO42﹣中的若干种离子.某同学对该溶液进行了如下实验:
下列判断正确的是( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、[Al(OH)4]﹣和SiO32﹣一定存在于溶液X中
D.CO32﹣和SO42﹣一定不存在于溶液X中
考点:
常见阳离子的检验;常见阴离子的检验.
专题:
物质检验鉴别题.
分析:
能和盐酸反应获得气体的是碳酸根或是亚硫酸根离子,会生成沉淀的是硅酸根离子,碳酸根离子和镁离子以及铝离子不能共存于溶液中,能和过量的氨水反应生成的白色沉淀只能是氢氧化铝,偏铝酸根离子和过量的盐酸反应会生成铝离子,根据离子之间的反应以及实验现象确定存在的离子.
解答:
解:
加HCl有气体说明有CO32﹣、SO32﹣中的至少一种离子,生成的气体可以是二氧化碳、或是二氧化硫或是二者的混合物,一定不存在和碳酸根或是亚硫酸根不共存的离子,所以不存在镁离子、铝离子,加盐酸有沉淀,说明一定有硅酸根离子,硅酸是沉淀,加入过量氨水(提供OH﹣)有沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在铝离子,但是原来溶液中的铝离子一定不能存在,所以该铝离子是偏铝酸根离子和盐酸反应生成的,所以,一定存在偏铝酸根离子,要保证溶液电中性,只有K+这一个阳离子,所以一定存在钾离子.
A、加HCl有气体说明有CO32﹣、CO32﹣中的至少一种离子,生成的气体可以是二氧化碳、或是二氧化硫或是二者的混合物,故A错误;
B、溶液中一定含有CO32﹣、SO32﹣中的至少一种离子,则一定不含有镁离子,它们和镁离子不共存,所以沉淀甲是硅酸,不可能是硅酸镁,故B错误;
C、根据上述推断,溶液中一定含有K+、AlO2﹣和SiO32﹣,故C正确;
D、碳酸根和硫酸根离子是否存在不能确定,故D错误.
故选C.
点评:
本题涉及离子的检验和离子共存等方面的知识,注意离子的特征离子反应是解决该问题的关键所在,综合性强,难度大.
3.某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl﹣、CO32﹣、NO3﹣、SO42﹣,测得各种离子的物质的量浓度相等.为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
A.溶液中无法确定Al3+的存在与否
B.原溶液中不含的离子为:
K+、Al3+、CO32﹣
C.步骤②中可以确定Fe2+、NO3﹣的存在
D.步骤③中共有2种钡盐沉淀
考点:
常见阳离子的检验;常见阴离子的检验.
专题:
物质检验鉴别题.
分析:
用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰,则说明没有K+;
另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3﹣和还原性的Fe2+;
若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32﹣或SO42﹣,因为有Fe2+,Fe2+与CO32﹣不能共存,所以没有CO32﹣;
则溶液中的离子有Fe2+、NO3﹣、SO42﹣,
已知各种离子的物质的量浓度相等,阴离子电荷比阳离子电荷多,所以还有另外的阳离子Cu2+或Al3+,若有Cu2+,阳离子的电荷多还须有Cl﹣,若有Al3+,阴离子加上Cl﹣,电荷仍不守恒;
所以根据电荷守恒可知还有Cu2+、Cl﹣,
所以原溶液中所含的离子为:
Cu2+、Fe2+、Cl﹣、NO3﹣、SO42﹣,一定不含:
K+、Al3+、CO32﹣离子.据此分析选项.
解答:
解:
用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰,则说明没有K+;
另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3﹣和还原性的Fe2+;
若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32﹣或SO42﹣,因为有Fe2+,Fe2+与CO32﹣不能共存,所以没有CO32﹣;
则溶液中的离子有Fe2+、NO3﹣、SO42﹣,
已知各种离子的物质的量浓度相等,阴离子电荷比阳离子电荷多,所以还有另外的阳离子Cu2+或Al3+,若有Cu2+,阳离子的电荷多还须有Cl﹣,若有Al3+,阴离子加上Cl﹣,电荷仍不守恒;
所以根据电荷守恒可知还有Cu2+、Cl﹣,
所以原溶液中所含的离子为:
Cu2+、Fe2+、Cl﹣、NO3﹣、SO42﹣,一定不含:
K+、Al3+、CO32﹣离子;
A.根据以上分析可确定一定无Al3+的存在,故A错误;
B.根据以上分析,原溶液中不含的离子为:
K+、Al3+、CO32﹣,故B正确;
C.另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3﹣和还原性的Fe2+,故C正确;
D.另取溶液加入BaCl2溶液,生成硫酸钡沉淀,故D错误;
故选BC.
点评:
本题考查了离子检验的实验方法和反应现象分析,掌握离子性质和溶液中电荷守恒计算判断存在的离子是解题关键,题目难度较大.
4.已知某溶液中含有下列8种离子中的5种(忽略水的电离及离子的水解):
K+、Cu2+、Al3+、Fe2+、Cl﹣、
CO32﹣、NO3﹣、SO42﹣,且5种离子的物质的量浓度相等.为了进一步探究该水溶液的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
③另取溶液加入BaCU溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
A.无法确定溶液中是否存在Cu2+离子
B.原溶液中不含K+、Al3+、CO3I等离子
C.根据步骤②只能确定溶液中一定存在NO3﹣离子
D.步骤③所得到的白色沉淀共有2种钡盐
考点:
常见阳离子的检验;常见阴离子的检验.
专题:
物质检验鉴别题.
分析:
用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰,则说明没有K+;
另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3﹣和还原性的Fe2+;
若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32﹣或SO42﹣,因为有Fe2+,Fe2+与CO32﹣不能共存,所以没有CO32﹣;
则溶液中的离子有Fe2+、NO3﹣、SO42﹣,
已知各种离子的物质的量浓度相等,阴离子电荷比阳离子电荷多,所以还有另外的阳离子Cu2+或Al3+,若有Cu2+,阳离子的电荷多还须有Cl﹣,若有Al3+,阴离子加上Cl﹣,电荷仍不守恒;
所以根据电荷守恒可知还有Cu2+、Cl﹣,
所以原溶液中所含的离子为:
Cu2+、Fe2+、Cl﹣、NO3﹣、SO42﹣,一定不含:
K+、Al3+、CO32﹣离子,据此分析选项.
解答:
解:
用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰,则说明没有K+;
另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3﹣和还原性的Fe2+;
若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32﹣或SO42﹣,因为有Fe2+,Fe2+与CO32﹣不能共存,所以没有CO32﹣;
则溶液中的离子有Fe2+、NO3﹣、SO42﹣,
已知各种离子的物质的量浓度相等,阴离子电荷比阳离子电荷多,所以还有另外的阳离子Cu2+或Al3+,若有Cu2+,阳离子的电荷多还须有Cl﹣,若有Al3+,阴离子加上Cl﹣,电荷仍不守恒;
所以根据电荷守恒可知还有Cu2+、Cl﹣,
所以原溶液中所含的离子为:
Cu2+、Fe2+、Cl﹣、NO3﹣、SO42﹣,一定不含:
K+、Al3+、CO32﹣离子;
A.Cu2+一定存在,故A错误;
B.根据以上分析,原溶液中不含的离子为:
K+、Al3+、CO32﹣,故B正确;
C.步骤②是另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3﹣和还原性的Fe2+,无CO32﹣,故C错误;
D.另取溶液加入BaCl2溶液,只生成硫酸钡沉淀,故D错误;
故选B.
点评:
本题考查了离子检验的实验方法和反应现象分析,掌握离子性质和溶液中电荷守恒计算判断存在的离子是解题关键,题目难度较大.
5.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣中的若干种离子,离子浓度均为0.1mol•L﹣1,某同学进行了如下实验:
下列说法不正确的是( )
A.沉淀A是BaSO4,说明原试液中一定含有SO42﹣
B.滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+
C.沉淀C只有一种成分
D.原溶液中一定大量存在的离子只有:
NH4+、Fe2+、Cl﹣、SO42﹣
考点:
常见阳离子的检验;常见阴离子的检验.
分析:
加入过量稀硫酸无明显变化,说明无CO32﹣、Ba2+和AlO2﹣;
加入硝酸钡有气体,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;
加入NaOH有气体,说明存在铵根离子,气体氨气,沉淀B为红褐色氢氧化铁沉淀;
通入少量CO2产生沉淀,先与OH﹣、Ba2+反应,沉淀C为碳酸钡,不能说明存在Al3+.
因为存在的离子浓度均为0.1mol•L﹣1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl﹣、SO42﹣才能保证电荷守恒,K+必然不能存在.
解答:
解:
加入过量稀硫酸无明显变化,说明无碳酸根离子,无Ba2+,无AlO2﹣;
加入硝酸钡有气体,因为前面已经加入了硫酸,硝酸根离子在酸性条件下具有强氧化性,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;
加入NaOH有气体,说明存在铵根离子,气体氨气,沉淀B为红褐色氢氧化铁沉淀;
通入少量CO2产生沉淀,先与OH﹣、Ba2+反应,沉淀C为碳酸钡,不能说明存在Al3+.
因为存在的离子浓度均为0.1mol•L﹣1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl﹣、SO42﹣才能保证电荷守恒,K+必然不能存在.
A、依据分析可知,原溶液中一定不存在SO42﹣,生成硫酸钡沉淀是由于引入硫酸,故A错误;
B、依据分析可知:
滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+,故B正确;
C、沉淀C为碳酸钡,只有一种成分,故C正确;
D、原溶液中一定不存在SO42﹣,故D错误.故选:
AD.
点评:
本题考查了常见离子的性质检验,注意硝酸根离子在酸性条件下具有强氧化性,另外本题需要根据电荷守恒判断氯离子是否存在,难度较大.
6.某试液中只可能含有K+、NH4+、Fe2+、Fe3+、Cl﹣、SO42﹣、NO3﹣、AlO2﹣中的若干种离子,离子浓度均为0.1mol•L﹣1,某同学进行了如图实验:
下列说法正确的是( )
A.无法确定原试液中是否含有Fe3+、K+
B.滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+
C.无法确定沉淀B的成分
D.原溶液中一定存在的离子为NH4+、Fe2+、NO3﹣、SO42﹣
考点:
常见阳离子的检验;常见阴离子的检验.
分析:
试液中加入盐酸产生气体,说明一定含有硝酸根离子和二价铁离子;滤液中加入氢氧化钡生成沉淀,说明一定含有氨根离子,因为加入盐酸,在酸性环境下二价铁离子被氧化生成三价铁,产生氢氧化铁沉淀,所以不能确定是否含有硫酸根离子、三价铁离子、钾离子,滤液中加入少量二氧化碳,产生沉淀,说明含有偏铝酸根离子,据此解答.
解答:
解:
试液中加入盐酸产生气体,硝酸根离子、二价铁离子在酸性环境下发生氧化还原反应生成三价铁离子和一氧化氮,说明一定含有硝酸根离子、二价铁离子;
向滤液中加入足量氢氧化钡,产生气体,氢氧根离子与氨根离子反应生成氨气,一定含有氨根离子,因为第一步反应中生成三价铁离子,所以加入氢氧化钡会产生氢氧化铁沉淀,所以无法确定原溶液中是否含有硫酸根离子和三价铁离子,滤液中加入少量二氧化碳,产生沉淀,该沉淀为氢氧化铝沉淀,说明溶液中含有偏铝酸根离子,无法确定是否含有钾离子、氯离子.
所以一定含有的离子有:
NH4+、Fe2+、NO3﹣、AlO2﹣;
无法确定的是:
Fe3+、Cl﹣、K+,
A.通过实验现象无法确定是否含有Fe3+、K+,故A正确;
B.滤液X中大量存在的阳离子有NH4+、Fe2+,不含有氢离子和铝离子,故B错误;
C.沉淀B的成分为氢氧化铝,故C错误;
D.原溶液中一定存在的离子为NH4+、Fe2+、NO3﹣,硫酸根离子无法确定,故D错误.
故选:
A.
点评:
本题考查了常见离子的性质检验,熟悉离子的性质及检验方式是解题关键,题目难度中等.
7.有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl﹣、SO42﹣、HCO3﹣、Ba2+、MnO4﹣中的几种.为确定其成分,进行如下实验:
①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀,且白色沉淀逐渐增多后又部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;
③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰,
下列推断正确的( )
A.由①只能确定溶液中有Al3+、Mg2+,没有HCO3﹣
B.由②知溶液中有SO42﹣,没有Ba2+
C.由③确定溶液中有Na+,没有K+
D.若检验溶液中是否有存在Cl﹣,可取少许原溶液,直接向其中加入AgNO3溶液
考点:
常见阳离子的检验;常见阴离子的检验.
分析:
过氧化钠和水反应生成氢氧化钠和氧气,根据氢氧化镁沉淀不溶于氢氧化钠溶液中,氢氧化铝能溶于氢氧化钠中,硫酸钡为白色不溶于硝酸的白色沉淀.
①取部分溶液,加入过量Na2O2固体,产生无色无味的气体和白色沉淀,白色沉淀逐渐增多后又部分溶解,则沉淀的成分是氢氧化镁和氢氧化铝;
②取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生,白色不溶于硝酸的白色沉淀是硫酸钡沉淀;
③焰色反应为黄色说明含有钠元素;
据此来回答问题.
解答:
解:
该溶液是无色溶液,则一定不会含有高锰酸跟离子.
①取部分溶液,加入过量Na2O2固体,过氧化钠先是和水反应生成氢氧化钠和氧气,产生无色无味的气体是氧气,一定不是氨气,说明不含铵根离子;白色沉淀逐渐增多后又部分溶解,则沉淀的成分是氢氧化镁和氢氧化铝,则证明其中一定含有镁离子和铝离子,一定不含有铵根离子、碳酸氢根离子(和铝离子不共存);
②取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生,和硫酸根离子反应生成白色不溶于硝酸的白色沉淀是硫酸钡沉淀,证明一定含有硫酸根离子,一定无钡离子;
③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰,说明是钠元素的性质,原溶液中含有钠离子;
综上所述:
原溶液中一定不含:
NH4+、HCO3﹣、MnO4﹣、Ba2+;一定含有:
Na+、Al3+、Mg2+、SO42﹣;不能确定的是K+、Cl﹣;
A、由①能确定溶液中有Al3+、Mg2+,没有HCO3﹣和NH4+,故A错误;
B、由②知溶液中有SO42﹣,由于有SO42﹣则没有Ba2+,故B正确;
C、K+的存在不能确定,故C错误;
D、由于溶液中有SO42﹣,能干扰氯离子的检验,故D错误.
故选B.
点评:
本题考查学生常见离子的检验方法,可以根据所学的知识来回答,难度不大.
8.有一无色溶液,含有K+、Al3+、Mg2+、NH4+、Cl﹣、NO3﹣、HCO
、MnO4﹣中的几种.为确定其成分,做如下实验:
①取部分溶液,加入7.8gNa2O2固体,产生无色的气体3.36L(STP)和白色沉淀,再加入1mol•L﹣1NaOH溶液300mL后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的AgNO3溶液,产生28.7g白色沉淀.下列推断正确的是( )
A.肯定有Al3+、Mg2+、NO3﹣,可能有NH4+、K+
B.肯定有Al3+、K+、Cl﹣,肯定没有MnO4﹣、Mg2+
C.肯定有Al3+、NH4+、Cl﹣、NO3﹣,一定没有HCO3﹣、Mg2+、MnO4﹣
D.该溶液可能显弱酸性,也可能显中性
考点:
常见阳离子的检验;常见阴离子的检验.
专题:
物质检验鉴别题.
分析:
无色溶液,一定不含高锰酸根离子;
①取部分溶液,加入7.8gNa2O2固体即0.1molNa2O2固体,产生无色无味的3.36L即0.15mol无色气体和白色沉淀,再加入0.3molNaOH溶液后白色沉淀完全溶解,则沉淀是氢氧化铝;
②取部分溶液,加入HNO3酸化的AgNO3溶液,产生28.7g白色沉淀,则沉淀为AgCl,物质的量为0.2mol,以此来解答.
解答:
解:
无色溶液,一定不含MnO4﹣;
①取部分溶液,加入7.8gNa2O2固体,物质的量为0.1mol,0.1mol过氧化钠先是和水反应生成0.2mol氢氧化钠和0.05mol氧气,故产生的0.15mol无色气体中只有0.05mol是氧气,则0.1mol为NH3,溶液中一定含NH4+,且物质的量为0.1mol;此时白色沉淀出现,再加入0.3molNaOH溶液后白色沉淀全部溶解,则沉淀是氢氧化铝,即溶液中有Al3+,则一定无Mg2+、HCO
,由于将Al3+转化为AlO2﹣共消耗NaOH的物质的量为0.2mol+0.3mol=0.5mol,根据Al3+~4OH﹣~AlO2﹣可知,Al3+的物质的量为
=0.125mol,即溶液中一定含有0.1molNH4+、0.125molAl3+;一定不含有Mg2+、HCO3﹣(和Al3+不共存);
②取部分溶液,加入HNO3酸化的AgNO3溶液,产生28.7gAgCl沉淀即0.2mol,故溶液中一定含0.2molCl﹣,根据电中性原理,一定含有NO3﹣.
所以溶液中一定含有NH4+、Al3+、Cl﹣、NO3﹣,一定不含HCO3﹣、Mg2+、MnO4﹣,可能含有钾离子.
A、溶液中一定无Mg2+,故A错误;
B、溶液中K+的存在不能确定,故B错误;
C、溶液中一定含有NH4+、Al3+、Cl﹣、NO3﹣,一定不含HCO3﹣、Mg2+、MnO4﹣,可能含有钾离子,故C正确;
D、由于溶液中含NH4+、