高中无机化学方程式.docx
《高中无机化学方程式.docx》由会员分享,可在线阅读,更多相关《高中无机化学方程式.docx(25页珍藏版)》请在冰豆网上搜索。
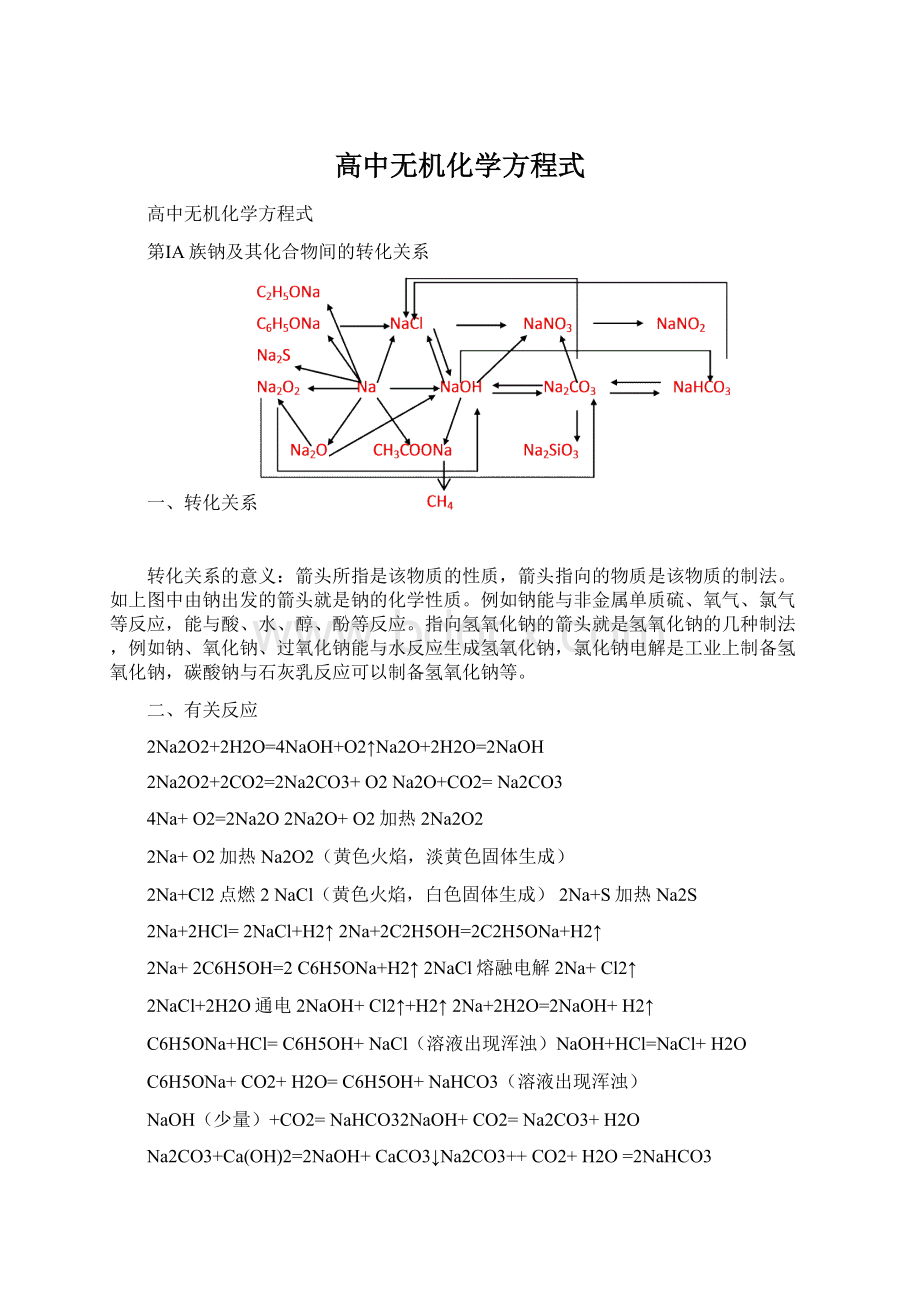
高中无机化学方程式
高中无机化学方程式
第ⅠA族钠及其化合物间的转化关系
一、转化关系
转化关系的意义:
箭头所指是该物质的性质,箭头指向的物质是该物质的制法。
如上图中由钠出发的箭头就是钠的化学性质。
例如钠能与非金属单质硫、氧气、氯气等反应,能与酸、水、醇、酚等反应。
指向氢氧化钠的箭头就是氢氧化钠的几种制法,例如钠、氧化钠、过氧化钠能与水反应生成氢氧化钠,氯化钠电解是工业上制备氢氧化钠,碳酸钠与石灰乳反应可以制备氢氧化钠等。
二、有关反应
2Na2O2+2H2O=4NaOH+O2↑Na2O+2H2O=2NaOH
2Na2O2+2CO2=2Na2CO3+O2Na2O+CO2=Na2CO3
4Na+O2=2Na2O2Na2O+O2加热2Na2O2
2Na+O2加热Na2O2(黄色火焰,淡黄色固体生成)
2Na+Cl2点燃2NaCl(黄色火焰,白色固体生成)2Na+S加热Na2S
2Na+2HCl=2NaCl+H2↑2Na+2C2H5OH=2C2H5ONa+H2↑
2Na+2C6H5OH=2C6H5ONa+H2↑2NaCl熔融电解2Na+Cl2↑
2NaCl+2H2O通电2NaOH+Cl2↑+H2↑2Na+2H2O=2NaOH+H2↑
C6H5ONa+HCl=C6H5OH+NaCl(溶液出现浑浊)NaOH+HCl=NaCl+H2O
C6H5ONa+CO2+H2O=C6H5OH+NaHCO3(溶液出现浑浊)
NaOH(少量)+CO2=NaHCO32NaOH+CO2=Na2CO3+H2O
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓Na2CO3++CO2+H2O=2NaHCO3
Na2CO3+SiO2高温Na2SiO3+CO2↑NaHCO3+NaOH=Na2CO3+H2O
2NaHCO3加热Na2CO3+CO2↑+H2O(碳酸酸式盐的不稳定性)
NaHCO3+HCl=NaCl+CO2↑+H2ONa2CO3+2HCl=2NaCl+CO2↑+H2O
Na2CO3+HCl(少量)=NaHCO3+NaCl2Na+2CH3COOH=2CH3COONa+H2↑
NaOH+CH3COOH=CH3COONa+H2O
NaOH+CH3COONa加热Na2CO3+CH4↑(脱羧反应)
NaCl+AgNO3=AgCl↓+NaNO32NaNO3加热2NaNO2+O2↑
Na2CO3·10H2O=Na2CO3+10H2O(风化)4Li+O2点燃2Li2O
NaCl(饱和)+NH3+CO2=NaHCO3↓+NH4Cl
第ⅡA族镁及其化合物间的转化
一、镁及其化合物间的转化关系图
二、有关反应
2Mg+O2点燃2MgO3Mg+N2点燃Mg3N2
Mg+S加热MgS2Mg+CO2点燃2MgO+C
Mg+Cl2点燃MgCl2Mg+2H2O加热Mg(OH)2+H2↑
Mg+2HCl=MgCl2+H2↑MgO+2HCl=MgCl2+H2O
MgO+H2O=Mg(OH)2MgO+2HNO3=Mg(NO3)2+H2O
Mg(OH)2+2HCl=MgCl2+2H2OMg(OH)2+2HNO3=Mg(NO3)2+2H2O
Mg(OH)2+H2SO4=MgSO4+2H2OMg(OH)2加热MgO+H2O
MgSO4+Ba(NO3)2=Mg(NO3)2+BaSO4↓MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
MgSO4+2NH3••H2O=Mg(OH)2↓+(NH4)2SO4
Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑Mg3N2+8HCl=2NH4Cl+3MgCl2
Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3MgCl2+2NaOH=Mg(OH)2↓+2NaCl
MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2MgCl2+Na2CO3=MgCO3↓+2NaCl
MgCl2+2H2O加热Mg(OH)2↓+2HCl↑MgCl2•6H2O加热Mg(OH)2+2HCl↑+4H2O
MgCl2•6H2O加热Mg(OH)Cl+HCl↑+5H2O
MgCl2•6H2O高温MgO+5H2O+2HCl↑MgCl2通电Mg+Cl2↑
MgCO3+H2O加热Mg(OH)2↓+CO2↑(持续加热)(水垢的形成)
MgCO3+H2SO4=MgSO4+CO2↑+H2OMgCO3+H2O+CO2=Mg(HCO3)2
Mg(HCO3)2+H2SO4=MgSO4+2CO2↑+2H2O
Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O
Mg(HCO3)2加热MgCO3↓+CO2↑+H2O(水垢的形成)
三、钙、钡
2CaO2+2H2O=2Ca(OH)2+O2↑CaO+H2O=Ca(OH)2
Ca(OH)2+CO2(不足)=CaCO3↓+H2OCa(OH)2+2CO2(过量)=Ca(HCO3)2
CaCO3+CO2+H2O=Ca(HCO3)2Ba2++SO42-=BaSO4↓
BaCO3+2H+=Ba2++CO2↑+H2O
3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O
第ⅢA族铝及其化合物间的转化关系
一、铝及其化合物间的转化关系图
二、有关反应
1.2Al+2NaOH+2H2O=2NaAlO2+3H2↑(水是氧化剂)
2.2Al+6HCl=2AlCl3+3H2↑
3.4Al+3O2=2Al2O3
4.2Al+3S加热Al2S3
5.2Al2O3通电4Al+3O2↑(铝的工业制法)
6.Al2O3+2NaOH=2NaAlO2+H2O
7.2Al(OH)3加热Al2O3+3H2O
8.Al2S3+6H2O=2Al(OH)3↓+3H2S↑
9.2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
10.NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3(氢氧化铝的工业制法)
11.NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
12.NaAlO2+NaHCO3+H2O=Al(OH)3↓+Na2CO3
13.Al(OH)3+NaOH=NaAlO2+2H2O(氢氧化铝的酸性——一元酸)
14.Al(OH)3+3HCl=AlCl3+3H2O(氢氧化铝的碱性——三元碱)
15.AlCl3+3NH3••H2O=Al(OH)3↓+3NH4Cl(氢氧化铝的实验室制法)
16.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl(用废铝制备氢氧化铝的最佳方法)
17.Al2O3+6HCl=2AlCl3+3H2O
18.AlCl3+4NaOH=NaAlO2+2H2O
19.AlCl3+3NaOH=Al(OH)3↓+3NaCl
20.NaAlO2+4HCl=AlCl3+NaCl+2H2O
21.2AlCl3+3Na2S+6H2O=2Al(OH)3↓+6NaCl+3H2S↑(水解反应)
22.2AlCl3+3Na2CO3+3H2O=2Al(OH)3↓+6NaCl(水解反应)
23.Al2(SO4)3+6NaHCO3=2Al(OH)3↓+3Na2SO4+6CO2↑(泡沫灭火器原理)
24.AlCl3+3NaHS+3H2O=Al(OH)3↓+3NaCl+3H2S↑(水解反应)
25.2Al+Fe2O3高温Al2O3+2Fe(铝热反应原理)
26.4Al+3MnO2高温2Al2O3+3Mn
27.Al+2WO3高温2Al2O3+2W
28.2Al+3Hg(NO3)2=2Al(NO3)3+3Hg
思考题:
写出十个制备Al(OH)3的反应。
第ⅣA族硅及其化合物间的转化关系
一、转化关系
二、有关反应
Si+2F2=SiF4Si+4HF=SiF4↑+2H2↑
Si+2NaOH+2H2O=Na2SiO3+2H2↑Si+O2加热SiO2
Si(粗硅)+2Cl2加热SiCl4SiCl4+2H2加热Si(纯硅)+4HCl
SiO2+4HF=SiF4↑+2H2O(氢氟酸腐蚀玻璃)
SiO2+2NaOH=Na2SiO3+2H2O(腐蚀玻璃等含二氧化硅的物品)
SiO2+Ca(OH)2=CaSiO3+H2OSiO2+CaO高温CaSiO3
SiO2+2C高温Si+2CO↑(制备粗硅)
SiO2+Na2CO3高温Na2SiO3+CO2↑(制备玻璃的反应之一)
SiO2+CaCO3高温CaSiO3+CO2↑(制备玻璃的反应之一)
SiO2+Na2SO3高温Na2SiO3+SO2↑3C+SiO2高温SiC+2CO↑
SiH4+2O2=SiO2+2H2O(硅烷空气中自燃)H2SiO3=SiO2+H2O(硅酸的不稳定性)
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(硅酸的酸性比碳酸还弱)
Na2SiO3+2HCl=H2SiO3↓+2NaCl(硅酸的实验室制法)
三、其它反应(碳元素及其化合物)
C+O2点燃CO2CO2+C高温2CO
CO2+C高温2CO2C+O2点燃2CO
C+2CuO高温CO2+2CuC+CuO高温CO+Cu
C+H2O高温CO+H23CO+Fe2O3高温3CO2+2Fe
CO2+2NaOH=Na2CO3+H2OCO2+2OH-=CO32—
CO2+NaOH(少量)=NaHCO3CO2+OH-=HCO3-
Ca(HCO3)2+2NaOH(足量)=Na2CO3+CaCO3↓+2H2O
Ca(HCO3)2+NaOH(不足量)=CaCO3↓+NaHCO3+H2O
2NaHCO3加热Na2CO3+CO2↑+H2O
Na2CO3+HCl(不足)=NaHCO3+NaClCO32-+H+=HCO3-
Na2CO3+2HCl(足量)=2NaCl+CO2↑+H2OCO32-+2H+=CO2↑+H2O
第ⅤA族氮及其化合物间的转化关系
一、转化关系图
二、有关反应
1.氨的易溶性和碱性
NH3+H2O
NH3•H2O
NH4++OH-
NH3+H+=NH4+挥发性酸遇到氨有白烟,难挥发性酸遇氨能反应但无白烟
NH3+CH3COOH=CH3COONH4H3PO4+NH3=NH4H2PO4
H3PO4+2NH3=(NH4)2HPO4H3PO4+3NH3=(NH4)3PO4
2.氨的还原性
4NH3+5O2=4NO+6H2O(加热、催化剂)2NH3+3Cl2=N2+6HCl
8NH3+3Cl2=N2+6NH4Cl8NH3+6NO2=7N2+12H2O
4NH3+6NO=5N2+6H2O2NH3+3CuO加热N2+3Cu+3H2O
3.氨分子与某些金属离子形成配合物
Cu(OH)2+4NH3=[Cu(NH3)4](OH)2AgCl+2NH3=[Ag(NH3)2]Cl
AgOH+2NH3=[Ag(NH3)2]OH(银氨溶液主要成分)
4.生成氨的反应
N2+3H2=2NH3(高温、高压、催化剂)(氨的工业制法)
2NH4Cl+Ca(OH)2加热CaCl2+2NH3↑+2H2O(氨的实验室制法)
NH4++OH-加热NH3↑+H2O(加热)(铵盐的检验)
NH3•H2O加热NH3↑+H2O(或加入氧化钙等)(氨的实验室简易制法)
Mg3N2+6H2O=3Mg(OH)2+2NH3↑NH4HCO3加热NH3↑+H2O+CO2↑
(NH4)2CO3加热2NH3↑+H2O+CO2↑NH4Cl加热NH3↑+HCl↑
NH4++H2O
NH3•H2O+H+(铵盐的水解)
NH4NO3+NaOH加热NH3↑+H2O+NaNO3
5.氮气的氧化性和还原性
3Mg+N2
Mg3N2N2+O2放电或高温2NO
6.氮氧化物
2NO+O2=2NO2(无色变红棕色)2NO2
N2O4(无色)
3NO2+H2O=2HNO3+NO(红棕色变无色)4NO2+O2+2H2O=4HNO3
4NO+3O2+2H2O=4HNO3NO2+NO+O2+H2O=2HNO3
NO2+NO+2NaOH=2NaNO2+H2O2NO2+2NaOH=NaNO3+NaNO2+H2O
7.硝酸的酸性、氧化性
2HNO3+CuO=Cu(NO3)2+H2O
2HNO3+CaCO3=Ca(NO3)2+CO2↑+H2O(可用实验室制备CO2)
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
2Ag+4HNO3(浓)=2AgNO3+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+2H2SO4(浓)+2NaNO3=CuSO4+Na2SO4+2NO2↑+2H2O(硝酸盐的检验)
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
C+4HNO3(浓)加热CO2↑+4NO2↑+2H2O
S+6HNO3(浓)加热H2SO4+6NO2↑+4H2O
P+5HNO3(浓)加热H3PO4+5NO2↑+H2O
P4+20HNO3(浓)加热4H3PO4+20NO2↑+4H2O
3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2O
3H2S+2HNO3(稀)=3S↓+2NO+4H2O
6KI+8HNO3(稀)=6KNO3+I2+2NO↑+4H2O
8.硝酸的沸点低、易挥发性
NaNO3+H2SO4(浓)加热HNO3↑+NaHSO4(实验室制备HNO3)
NH3+HNO3=NH4NO3(氨气遇浓硝酸产生白烟)
9.硝酸盐的稳定性及在高温下可作氧化剂的原因
2NaNO3加热2NaNO2+O2↑(K--Na金属硝酸盐分解成亚硝酸盐和氧气)
2Cu(NO3)2加热2CuO+4NO2↑+O2↑
(Mg--Cu金属硝酸盐分解成金属氧化物、二氧化氮和氧气)
2AgNO3加热2Ag+2NO2↑+O2↑
(Cu后的金属硝酸盐分解成金属单质、二氧化氮和氧气)
2KNO3+3C+S=K2S+3CO2↑+N2↑(黑火药爆炸)
10.硝酸的不稳定性:
4HNO3(浓)加热或光照2H2O+4NO2↑+O2↑
11.氮气的实验室制法:
NH4Cl+NaNO2加热N2↑+NaCl+2H2O
第ⅥA族硫及其化合物的有关反应
一、转化关系图
硫及其化合物的反应主要抓住一条变价线——从硫的最低价负二价到最高正六价相互转化的反应和三条等价线——负二价硫的化合物间的转化、正四价硫的化合物间的转化、正六价硫的化合物间的转化。
变价线中掌握实现转化的常用氧化剂或还原剂,等价线主要应用发生复分解反应的条件和规律。
其它族也类似。
二、有关反应
1、硫的氢化物的有关反应
H2S+2NaOH=Na2S+2H2OH2S+NaOH=NaHS+H2O
Na2S+H2S=2NaHSH2S+CuSO4=H2SO4+CuS↓(黑色)
H2S+Pb(CH3COO)2=CH3COOH+PbS↓2H2S+O2=S+2H2O
2H2S+3O2点燃2SO2+2H2OH2S+I2=2HI+S↓
H2S+Br2=2HBr+S↓H2S+Cl2=2HCl+S
2H2S+SO2=3S+2H2OH2S+H2O2=S↓+2H2O
H2S+H2SO4(浓)=S↓+SO2↑+2H2O3H2S+2HNO3(稀)=3S↓+2NO↑+4H2O
5H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O
H2S+2FeCl3=2FeCl2+S↓+2HCl
2Ag+H2S=Ag2S+H2↑不活泼金属置换氢的特例,能反应是因为Ag2S极难溶
2、硫化物的有关反应
Na2S+H2SO4=Na2SO4+H2S↑FeS+2HCl=FeCl2+H2S↑
ZnS+H2SO4=ZnSO4+H2S↑Al2S3+6H2O=2Al(OH)3+3H2S↑
S2-+2H+=H2S↑S2-+H+(少量)=HS-
HS-+H+=H2S↑FeS+2H+=Fe2++H2S↑
HS-+OH-=S2-+H2O
3、硫单质的有关反应
S+H2加热H2SS+O2
SO2S+Fe加热FeSS+2Cu加热Cu2S
S+2Na=Na2SS+Hg=HgS2Al+3S加热Al2S3
3S+6NaOH==2Na2S+Na2SO3+3H2O
4、硫的氧化物有关反应
SO2+CaO=CaSO3SO2+H2O=H2SO3
SO2+Ca(OH)2=CaSO3+H2OSO2+NH3·H2O=NH4HSO3,
SO2+2NH3+H2O=(NH4)2SO3(NH4)2SO3+SO2+H2O=2NH4HSO3
SO2+NO2=SO3+NO3SO2+2HNO3+2H2O=3H2SO4+2NO↑
SO2+X2+H2O=H2SO4+2HX(X2-Cl2、Br2、I2)
催化剂
△
2SO2+O2====2SO3SO2+Na2O2=Na2SO4
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
SO2+Na2SO3+H2O=2NaHSO3SO2+BaSO3+H2O=Ba(HSO3)2
SO2+H2O2=H2SO4SO2+2FeCl3+2H2O=H2SO4+2FeCl2+2HCl
SO2+2NaHCO3=Na2SO3+2CO2+H2OSO2+Na2CO3=Na2SO3+CO2
2SO2+2CaCO3+O2高温2CaSO4+2CO2SO3+H2O=H2SO4
SO3+CaO=CaSO4SO3+2NaOH=Na2SO4+H2O
SO3+Na2SO3=Na2SO4+SO2SO3+H2O+BaCl2=BaSO4↓+2HCl
5、亚硫酸极其盐的反应
2H2SO3+O2=2H2SO4
△
Na2SO3+2Na2S+6HCl=3S↓+NaCl+3H2O
Na2SO3+S===Na2S2O33Na2SO3+2HNO3=3Na2SO4+2NO↑+H2O
2Na2SO3+O2=2Na2SO4Na2SO3+BaCl2=BaSO3↓+2NaCl
Na2SO3+Ba(OH)2=BaSO3↓+2NaOH3BaSO3+2HNO3=3BaSO4+2NO↑+H2O
3BaSO3+2H++2NO3=3BaSO4+2NO↑+H2O
3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O
BaSO3+2HCl=BaCl2+SO2↑+H2O
6、硫酸极其盐的有关反应
H2SO4+Zn=ZnSO4+H2↑H2SO4+Cu(OH)2=CuSO4+2H2O
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3H2SO4+CuO=CuSO4+H2O
2H2SO4+Ca3(PO4)2=2CaSO4+Ca(H2PO4)23H2SO4+Ca3(PO4)2=3CaSO4+2H3PO4
2H2SO4(浓)+Cu加热CuSO4+SO2↑++2H2O
2H2SO4(浓)+C加热2SO2↑+CO2↑+2H2O2H2SO4(浓)+S加热3SO2↑+2H2O
2H2SO4(浓)+Ag加热Ag2SO4+SO2↑+2H2O
H2SO4(浓)+H2S加热S↓+SO2+2H2OH2SO4(浓)+2HBr==Br2↑+SO2↑+2H2O
H2SO4(浓)+8HI===H2S↑+4I2+4H2OH2SO4(浓)+CaF2=CaSO4+2HF↑
H2SO4(浓)+NaCl==NaHSO4+HCl↑H2SO4(浓)+2NaCl加热Na2SO4+2HCl↑
H2SO4(浓)+NaNO3加热NaHSO4+HNO3↑5H2SO4(浓)+2P加热2H3PO4+5SO2+2H2O
HCOOH========CO↑+H2OC2H5OH========C2H4↑+H2O
7、其它反应
Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2ONa2S2O3+Na2S+6HCl=4S↓+6NaCl+3H2O
2Na2S2O3+I2=Na2S4O6+2NaI3O2放电2O3
4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+2H2O2催化剂2H2O+O2↑
2Fe2++H2O2+2H+=2Fe3++2H2O2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
O3+2KI+H2O=O2+I2+2KOH
第ⅦA族氯及其化合物的有关反应归纳
一、转化关系图
二、有关反应
1.氯气的氧化性
3Cl2+2P点燃2PCl35Cl2+2P点燃2PCl5
PCl3+Cl2=PCl5Cl2+H2点燃2HCl
Cl2+H2光照2HCl3Cl2+2Fe点燃2FeCl3
Cl2+2Na点燃2NaClCl2+Cu点燃CuCl2
Cl2+2KI=I2+2KClCl2+2NaBr=Br2+2NaCl
Cl2+H2S=2HCl+SCl2+2Fe2+=2Fe3++2Cl-
Cl2+2H2O+SO2=2HCl+H2SO4Cl2+H2O+SO32-=2H++SO42-+2Cl-
Cl2+CH4光照CH3Cl+HClCl2+C2H4=C2H4Cl2
2.歧化反应
Cl2+H2O=HCl+HClOCl2+2NaOH=NaCl+NaClO+H2O
2Cl2+2Ca(OH)2==Ca(ClO)2+CaCl2+2H2O
Cl2+H2O=H++Cl-+HClOCl2+2OH-=Cl-+ClO-+H2O
Cl2+6OH-(浓)加热5Cl-+ClO3-+3H2O
3.次氯酸的不稳定性、强氧化性、弱酸性
2HClO光照2HCl+O2↑
Ca(ClO)2+4HCl(浓)=CaCl2+Cl2↑+2H2O
Ca(ClO)2+2SO2+2H2O=CaSO4+H2SO4+2HCl
Ca(ClO)2+2HCl=CaCl2+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO(次氯酸的酸性比碳酸还弱)
4.氯气的工业制法
2NaCl+2H2O电解2NaOH+Cl2↑+H2↑2Cl-+2H2O电解2OH-+Cl2↑+H2↑
5.氯气的实验室制法(氯化氢的还原性、酸性)
MnO2+4HCl(浓)加热MnCl2+Cl2↑+2H2O
MnO2+4H++2Cl-加热Mn2++Cl2↑+2H2OKClO3+6HCl=KCl+3Cl2↑+3H2O
ClO3-+5Cl-+6H+=3Cl2↑+