第十七章 周环反应.docx
《第十七章 周环反应.docx》由会员分享,可在线阅读,更多相关《第十七章 周环反应.docx(11页珍藏版)》请在冰豆网上搜索。
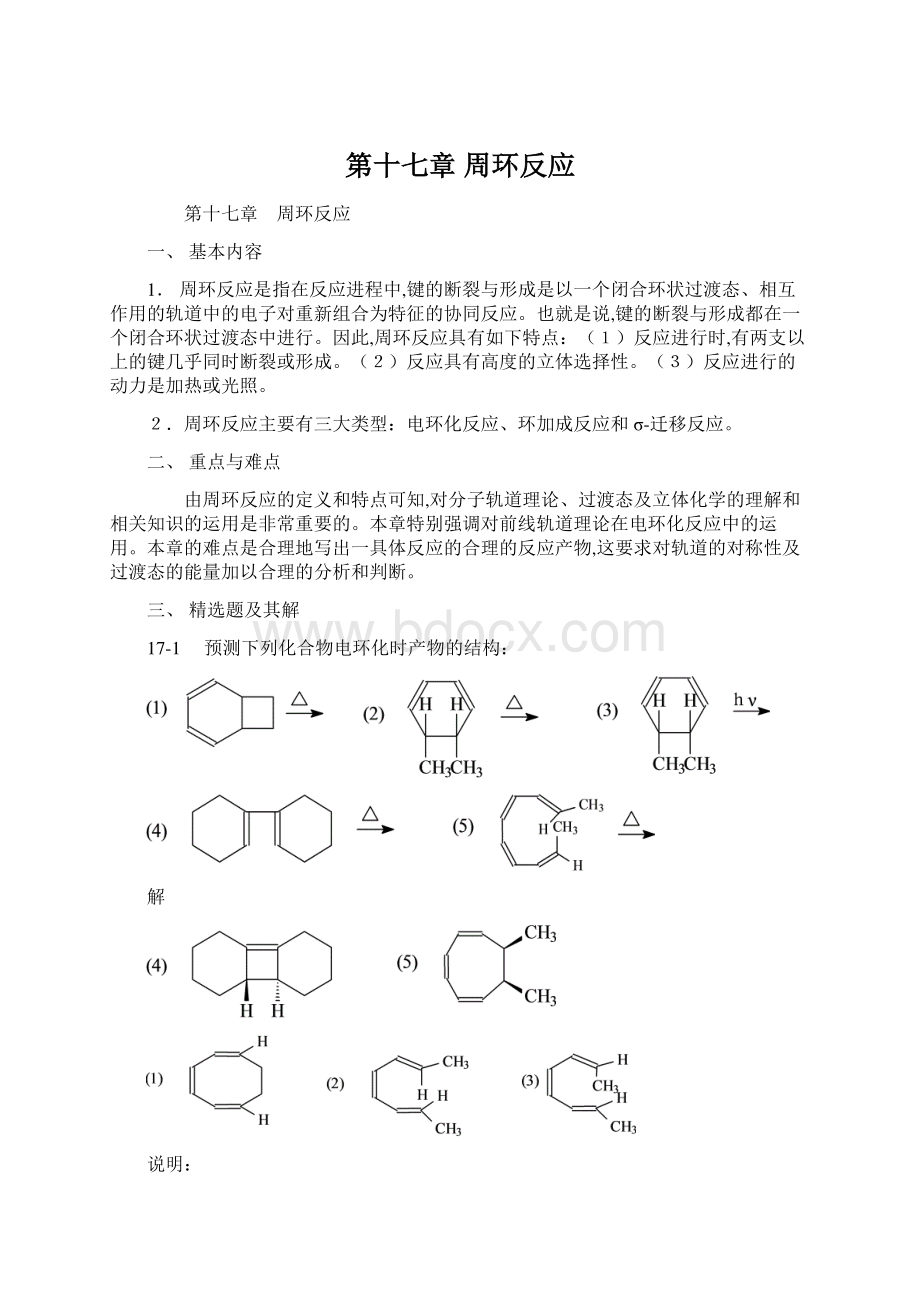
第十七章第十七章周环反应周环反应第十七章周环反应一、基本内容1周环反应是指在反应进程中,键的断裂与形成是以一个闭合环状过渡态、相互作用的轨道中的电子对重新组合为特征的协同反应。
也就是说,键的断裂与形成都在一个闭合环状过渡态中进行。
因此,周环反应具有如下特点:
()反应进行时,有两支以上的键几乎同时断裂或形成。
()反应具有高度的立体选择性。
()反应进行的动力是加热或光照。
周环反应主要有三大类型:
电环化反应、环加成反应和-迁移反应。
二、重点与难点由周环反应的定义和特点可知,对分子轨道理论、过渡态及立体化学的理解和相关知识的运用是非常重要的。
本章特别强调对前线轨道理论在电环化反应中的运用。
本章的难点是合理地写出一具体反应的合理的反应产物,这要求对轨道的对称性及过渡态的能量加以合理的分析和判断。
三、精选题及其解17-1预测下列化合物电环化时产物的结构:
解说明:
我们以本题为例来探讨一下如何运用前线轨道理论,以及如何对反应加以正确的分析、写出合理的产物。
题()是电环化反应。
在反应条件下,反应物有开环和关环两种反应途径。
关环反应的电子数由反应物决定,为4电子体系;开环反应的电子数由产物决定为6电子体系。
关环反应产物B极不稳定(中间的四元环的两支键互为反式),说明形成该产物的过渡态的能量极高,反应不能进行。
因此,该反应经对旋开环形成产物C。
若要验证一下答案的正确性,可将化合物C在同样条件下的关环产物写出,如果写出的产物是A,说明答案是正确的。
因为,由A到C和由C到A的变化的过渡态是一样的。
17-2用前线轨道理论解释17-1()的产物的正确性。
解先画出化合物C的分子轨道如下:
前线轨道分别为最高占有轨道HOMO和最低空轨道LUMO。
电环化反应轨道对称性取决于最高占有轨道的对称性。
如用下图表示A由到B的关环反应的过渡态,可以看出标记为a的那支碳碳键需跨面形成,这对小环化合物是不可能的。
17-3预测下列化合物环加成时产物的结构:
解说明:
本题所涉反应均为环加成反应。
()提示典型的D-A(狄尔斯-阿尔德)反应。
产物中不排除一分子丁二烯和一分子对苯醌所形成的环加成产物。
()可生成两种产物,由电子效应可知,双烯体富电子一端的碳原子和亲双烯体缺电子一端的碳原子成键是有利的,因此所给产物是主要产物。
()为4+6环加成反应。
()为以1,3-偶极离子作为双烯体的环加成反应,也称为1,3-偶极加成反应。
17-4马来酸酐和环庚三烯反应,给出的产物如下。
试说明生成这个产物的合理性。
解环庚三烯先经电环化反应生成A。
A再和马来酸酐经环加成反应生成所给出的产物。
17-5指出下列反应过程所需的条件。
解17-6试说明下列反应从反应物到产物的过程。
解17-7自选原料通过环加成反应合成下列化合物。
解17-8加热下列化合物会发生什么样的变化?
解说明本题所涉的反应为柯普(Cope)重排,即3,3迁移。
()题的3,3迁移理想上还可得另一产物,如下式所示。
但该产物在一个八元环里存在两个反式碳碳双键,能量极高,难以生成。
17-9下面的反应按光化学进行时,反应产物可得到哪一种(或II)?
解()的产物为。
电环化反应,4电子体系,光照对旋关环。
()的产物为II。
电环化反应,6电子体系,光照顺旋关环。
17-10通过怎样的过程和条件,下列反应能得到给出的结果。
解17-11通过什么方法把反-9,10-二氢萘转化为顺-9,10-二氢萘。
解17-12完成下列反应:
解17-13乙酰丙酮在碱性条件下和二硫化碳反应生成双硫负离子A,双硫负离子A和碘甲烷经亲核取代反应生成B;双硫负离子A和烯丙基氯反应除得少量化合物C外主要产物为化合物D。
请说明原因。
解双硫负离子A和烯丙基氯反应先生成化合物C,化合物C经3,3迁移转化为化合物D。
此例说明,3,3迁移反应不仅涉及到碳碳键和碳氧键(如克莱森重排)的迁移,对于能满足1,5-二烯结构、碳链上连有其它杂原子的体系也是可能的,具体情况要具体分析。
17-14丁二烯在波长220-250nm的光的照射下,可直接得到光化反应产物,而在波长大于400nm的光的照射下必须加入少量丁二酮才能得到光化反应产物,解释上述事实并说明丁二酮在这里的作用。
解丁二烯在波长220-250nm的光的照射下可以被激活,从而得到光化反应产物。
丁二烯在波长400nm的光的照射下不能被激活,但丁二酮在此波长下可被激活,被激活的丁二酮通过把能量传递给丁二烯,才能使丁二烯得到光化反应产物。
在此反应中,丁二酮起光敏剂的作用。
17-15有一称为类卓的化合物A,其低温1HNMR谱足以使波谱数据符合该化合物有四个烯氢、两个烯丙基氢和三个环丙基氢。
当温度升高时观测到有两个烯氢的化学位移基本不变,但另外两个烯氢和三个环丙基氢的吸收峰合并了,请给予以解释。
解类卓是一容易发生3,3-迁移反应的化合物。
温度较低时反应速度慢,1HNMR谱足以使波谱数据符合该化合物的结构特征。
随着温度的升高,迁移反应的速度加快,因重排产物和反应物的结构是相同的,1HNMR谱给出的是一动态平衡的测定结果。
17-16狄尔斯-阿尔德(Diels-Alder)反应对溶剂的极性不敏感,在反应中有明显的立体化学保持的特点-顺式取代的亲双烯体总是得到顺式取代的环己烯,反式取代的亲双烯体总是得到反式取代的环己烯(如下式所示),请给与解释。
解可用前线轨道的对称性对如上反应的立体化学加以解释:
以
(1)为例。
形成过渡态时,要求对称性相同的轨道重叠,也就是说,反应物的立体化学特征是保持的。
从成键过程中分子轨道的重叠过程可明显看出其立体化学过程的特征。