化学11111.docx
《化学11111.docx》由会员分享,可在线阅读,更多相关《化学11111.docx(14页珍藏版)》请在冰豆网上搜索。
化学11111
第二部分:
制取气体
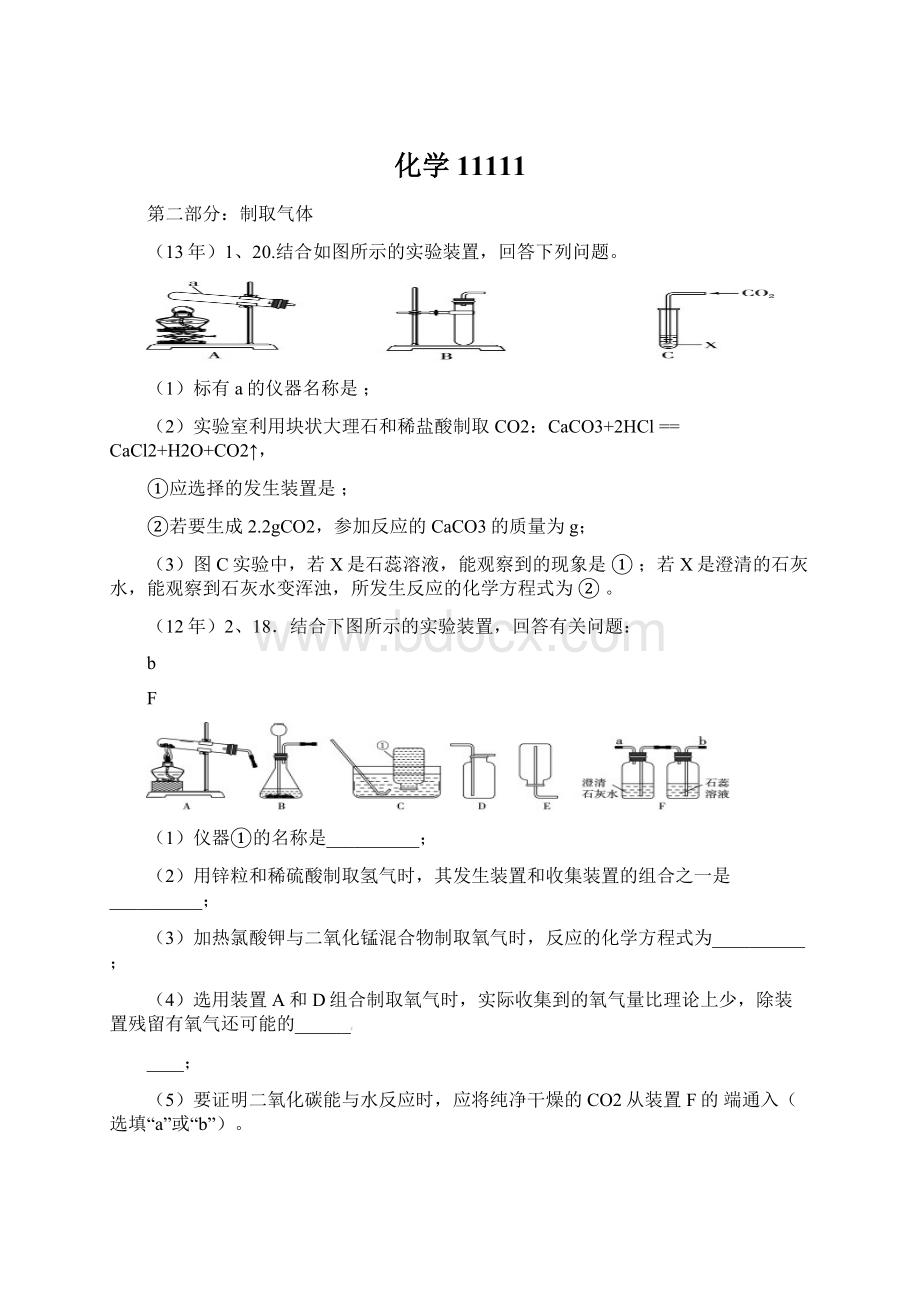
(13年)1、20.结合如图所示的实验装置,回答下列问题。
(1)标有a的仪器名称是;
(2)实验室利用块状大理石和稀盐酸制取CO2:
CaCO3+2HCl==CaCl2+H2O+CO2↑,
①应选择的发生装置是;
②若要生成2.2gCO2,参加反应的CaCO3的质量为g;
(3)图C实验中,若X是石蕊溶液,能观察到的现象是①;若X是澄清的石灰水,能观察到石灰水变浑浊,所发生反应的化学方程式为②。
(12年)2、18.结合下图所示的实验装置,回答有关问题:
b
F
(1)仪器①的名称是__________;
(2)用锌粒和稀硫酸制取氢气时,其发生装置和收集装置的组合之一是__________;
(3)加热氯酸钾与二氧化锰混合物制取氧气时,反应的化学方程式为__________;
(4)选用装置A和D组合制取氧气时,实际收集到的氧气量比理论上少,除装置残留有氧气还可能的______
____;
(5)要证明二氧化碳能与水反应时,应将纯净干燥的CO2从装置F的端通入(选填“a”或“b”)。
(11年)3、18.观察下列各图,回答有关问题
(1)仪器a的名称是;
(2)实验室制取CO2,其反应原理可用化学方程式表示为①;其发生装置可选用上图中的②(填装置序号,下同),收集装置可选用③;
(3)利用收集到的CO2进行图E所示实验,观察到燃着的蜡烛自下而上依次熄灭,体现出CO2的密度比空气大和的性质。
(10年)4、18.结合下图回答制取氧气及验证氧气性质实验的有关问题。
(1)仪器a的名称是;
(2)加热KMnO4或KClO3与MnO2混合物制氧气时,选用的发生装置是;
(3)用H2O2溶液和MnO2制取氧气的反应可用化学方程式表示为;
(4)完成图C所示实验时,为避免集气瓶底炸裂,可预先在集气瓶中放。
(09年)5、
18.下列装置常用于实验室里制备和收集气体,据此回答下列问题:
⑴仪器a的名称是;
⑵加热氯酸钾和二氧化锰混合物制氧气时,发生反应的化学方程式为①;充分反应后,将剩余固体经溶解、②、洗涤、干燥可回收二氧化锰;
⑶将装置A、C组合制取氧气,停止加热前,要先将导管移出水面。
这样做的目的是;
⑷选用装置A制取气体时,对反应物的状态和反应条件的要求是;
⑸常温下利用次氯酸钙固体与盐酸反应制取氯气可选择的发生装置是。
(08年)6、18.某小组在实验室里制取CO2时用到了下列装置,请回答:
⑴能用B装置收集CO2,是因为CO2的密度比空气;
⑵用B装置收集CO2时,检验是否收集满的方法是将燃着的木条放在;
⑶将生成的CO2通入石蕊试液中,试液变红,原因是CO2与反应生成了碳酸;
⑷将A装置改成C装置,通过拉动铜丝可以控制底部破损的小试管升降,这一改进的主要目的是(选填序号);
A.随时使反应发生或停止B.利用破损的小试管C.生成更多的二氧化碳
⑸如果在实验室利用A装置制取氧气,有关反应的化学方程式为。
第三部分:
溶液配制
(13年)1、19.结合配制100g质量分数为6%的H2O2溶液的实验,回答下列问题。
(1)计算:
需要质量分数为30%的H2O2溶液g;
(2)量取:
量取所需水时俯视读数,其他操作均正确,则配制出的稀溶液的质量分数
6%(选填“大于”、“等于”或“小于”);
(3)混匀:
将准确量取的H2O2溶液和水倒入(填写一种仪器名称)中,用玻璃棒搅拌,使溶液混合均匀;
(4)装入棕色瓶中,贴好标签,密封保存在阴凉处。
(12年)2、19.结合配制溶质质量分数一定的氯化钠溶液
的实验图示,回答下列有关问题:
(1)在量取水的操作中,当水面接近所需刻度时,应用滴加;
(2)操作D中用玻璃棒搅拌的作用是;
(3)上图操作中,一定能导致溶质质量分数偏小的是__________。
(11年)3、19.回忆教科书中有关“粗盐的初步提纯”实验的主要步骤,回答下列问题。
【溶解】称取5.0g粗盐,用药匙将该粗盐逐步加入盛有10mL水的烧饼里,边加边用玻璃棒搅拌,直加到粗盐不再溶解为止。
称量尚未向烧杯中加入的粗盐质量。
【过滤】……
【蒸发】……
【计算产率】用玻璃棒把提纯后的精盐转移到纸上,称其质量,计算精盐的产率。
精盐的产率=
×100%
(1)过滤时,玻璃棒的作用是;
(2)蒸发过程中,待蒸发皿中出现固体时,停止加热,利用余热使滤液蒸干;
(3)某同学所得的产率与其他同学比较明显偏低,下列哪些情况会导致产率明显偏低
(选填字母序号)
A.溶解时将5.0g粗盐一次全部倒入水中,立即过滤
B.蒸发时有一些液体、固体溅出
C.提纯后的精盐尚未完全干燥就称其质量
第四部分:
溶解度
(13年)1、
15.根据右图中KNO3和NaCl的溶解度曲线,回答下列问题。
(1)10℃时,溶解度较大的物质是;
(2)20℃时,将20gNaCl加入到100g水中,充分溶解后,所得
溶液质量为g;
(3)将40℃均含100g水的KNO3饱和溶液、NaCl饱和溶液
降温至10℃,析出晶体较多的是。
(12年)2、
14.根据右图中KNO3和NaCl两种物质的溶解度曲线,回答:
(1)在10℃时,KNO3的溶解度约为__________g;
(2)溶解度受温度影响较小的物质是__________;
(3)将20℃时饱和KNO3溶液升温到30℃,则所得溶液是
__________(选填“饱和溶液”或“不饱和溶液”)。
(11年)3、15、根据右图所示的溶解度曲线,回答下列问题。
(1)10℃时,将NaCl、KNO3各30g分别加入到100g水中,充分搅拌后,固体全部溶解的是;
(2)将KNO3的饱和溶液转化为不饱和溶液,通常采用的方法有:
加水和。
(10年)4、14.根据右图所示的KNO3和NaCl的溶解度曲线回答下列问题。
(1)10℃时,KNO3的溶解度约为g;
(2)温度升高时溶解度明显增大的是;
(3)在温度不变的情况下,将NaCl的不饱和溶液变成
饱和溶液,可采用恒温蒸发水和的方法。
(09年)5、13.根据右图所示的甲、乙两种固体物质的溶解度曲线回答:
20℃时,甲物质的溶解度是g;
采用方法可使乙物质从其溶液中全部结晶出来。
(08年)6、13.请根据右图所示硝酸钾的溶解度曲线回答:
⑴在60℃时,100g水最多溶解硝酸钾的质量为g;
⑵在相等质量的水中,要尽可能多地溶解硝酸钾,应选用
(选填“热水”或“冷水”)
第五部分:
金属
(12年)1、15.请回答下列与金属有关的问题:
(1)赤铁矿的主要成分是__________;
(2)黄铜片(铜锌合金)与铜片互相刻划时,在__________的表面可留下划痕;
(3)把金属锰放到硫酸锌溶液中,无明显现象,这说明锰的活动性比锌__________。
2.结合下列有关铁的实验,回答有关问题:
(1)铁丝在氧气中燃烧的实验:
点燃系在螺旋状细铁丝底端的火柴,待火柴将要燃尽时,插入盛有氧气的集气瓶中,观察现象。
这根火柴的作用是①;为了防止集气瓶底炸裂,应采取的方法是②。
(2)右图是探究铁钉锈蚀条件的实验:
①A中植物油的作用是;
②一段时间后,B中铁钉没有锈蚀,而C中铁钉锈蚀,
通过B、C对比说明铁钉锈蚀的条件之一是。
(11年)3、13、根据下列图示,回答与铁有关的问题。
(1)图A为铁元素在元素周期表中的相关信息,可知铁的相对原子质量为
(2)图B为铁原子结构示意图,其中x的数值为;
(3)图C为地壳中某些元素的含量(质量分数),其中含量最多的元素与铁元素组成的化合物的化学式为(写出一种即可)。
17.根据金属的化学性质,将下表中内容补充完整
反应物
反应规律
反应规律的应用举例
金属+氧气
大多数金属能和O2反应生成金属氧化物
铝表面形成致密的氧化薄膜,阻止铝进一步氧化
金属+酸
在金属活动性顺序里,位于①的金属能与盐酸、稀硫酸发生置换反应生成盐和H2
用盐酸和稀硫酸鉴别黄金和黄铜(铜锌合金)
金属+盐
在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来,生成②
将Cu、Mg、Zn中的两种金属分别放入③溶液中,即可比较出上述三种金属的活动性强弱
(10年)4、17.请回答有关金属活动性的问题:
(1)在Mg和Fe中,活动性较强的是;
(2)Mn的活动性比Fe强,由此可知Mn与稀盐酸(选填:
“能”或“不能”)反应;
(3)用Fe和一种盐溶液验证Fe比Cu活泼,写出反应的化学方程式。
(09年)5、15.请回答下列有关金属资源的问题:
⑴某地赤铁矿(主要成分是Fe2O3)和黄铁矿(主要成分是FeS2)储量丰富。
若从保护环境的角度考虑,当地炼铁厂应选用的铁矿石是;
⑵为增大反应物间的接触面积,常将块状铁矿石,从而提高铁矿石的利用率;
⑶从炼铁废气中分离出来的CO,(填“能”或“不能”)再用于炼铁;
⑷金属制品表面的保护膜可隔绝空气中的和水蒸气,有利于保护金属资源。
16.请根据常见金属活动性顺序回答下列问题:
⑴形状、大小相同的Zn、Mg、Fe三种金属片与稀盐酸反应时,最剧烈的是;
⑵把金属浸入相应的溶液中,就能发生置换反应的是。
A.铜和稀盐酸B.银和硫酸锌溶液C.铁和硫酸铜溶液
(08年)6、15.请根据常见金属的活动性顺序回答:
KCaNaMgAlZnFeSnPb(H)CuHgPtAu
金属活动性由强逐渐减弱
⑴在潮湿的空气中铁容易锈蚀而金不能,这是因为;
⑵在镁、铜、锌三种金属中,不能与稀硫酸发生置换反应的是;
⑶要比较铜和银的活动性,如果选用了铜,还需选用的一种盐溶液是。
第六部分:
基础知识
(13年)11.请用化学用语回答下列问题。
(1)钾离子的符号是;
(2)两个氢原子可表示为。
12.请回答下列与O2有关的问题。
(1)检验一瓶气体是O2,可用;
(2)医疗上用纯度较高的O2进行急救,是因为O2能;
(3)铝制品不易锈蚀,是因为它在常温下能与O2反应,表面形成致密的薄膜。
13.请回答下列与水有关的问题。
(1)生活中,鉴别软水、硬水常加入;
(2)用水灭火的原理包括隔绝氧气和;(3)做细铁丝在氧气中燃烧实验时,瓶底留有少量水,目的是防止。
14.玻璃棒是化学实验中常用的一种仪器。
(1)过滤操作中,需用玻璃棒①且其末端应斜靠在②层滤纸一边;
(2)蒸发操作中,边加热边用玻璃棒搅拌,防止局部过热,造成;
(3)测定溶液的pH时,可用玻璃棒,滴在pH试纸上。
16.根据元素周期表中第三周期元素的部分信息,回答下列问题。
(1)硫原子的质子数x=;
(2)将这8种元素排列在同一周期中,是因为这些元素的原子都有个电子层;
(3)该周期元素是由元素过渡到非金属元素,结尾是稀有气体元素。
17.碳和碳的氧化物都是常见的含碳物质,回答下列问题。
(1)在石墨和金刚石中,可用于制作铅笔芯的是;
(2)CO和CO2的化学性质不同,是因为两者不同;
(3)如图所示,碳和碳的氧化物的转化关系中,转化①的基本反应
类型属于,转化②在工业上的用途是。
18.我们常通过控制实验条件,对比实验现象,进而得出实验结论。
根据表中内容填空。
实验目的
实验方案
实验现象及结论
验证①
加热片刻后,a中酒精燃烧,b中水不燃烧;由此可得出燃烧的条件之一是
现象X
需要可燃物
验证稀盐酸能
与Ca(OH)2反应
充分振荡后,a中固体消失,b中仍有
固体剩余;由此可验证稀盐酸能与Ca(OH)2反应
验证铁生锈
与O2有关
一周后,观察到两支铁钉均锈蚀;由此无法验证铁生锈与O2有关。
实验改进:
为达到实验目的,应对b中实验做出的改进是③
(12年)5、11.CaCO3在高温条件下分解生成CaO和CO2,这是工业制取CaO的反应原理。
计算50tCaCO3完全分解可制得CaO的质量为____________g。
12.下图中A是某元素在周期表中的相关信息,B是该元素的原子结构示意图。
(1)该元素的相对原子质量为__________;
(2)该元素属于__________元素(选填“金属”或“非金属”);
(3)该元素的原子在化学反应中容易__________电子。
13.回答下列与水有关的问题:
(1)在过滤、蒸馏三种操作中,能使硬水软化的是__________;
(2)通过__________实验并验证其生成物,可以证明水是由氢、氧两种元素组成的;
(3)H2O和H2O2元素组成相同,但化学性质不同,其原因是它们的__________不同。
17.下图以稀硫酸例的反应关系体现了酸的化学性质,其中的X与图中所给物质的类别不同。
结合此图回答下列问题:
(1)稀硫酸中阳离子的符号是;
(2)反应①中石蕊溶液变为__________色;
(3)反应②的化学方程式为__________;
(4)图中只生成盐和水的反应包括__________(填序号);
(5)若X溶液既能跟稀硫酸反应,又能跟Ca(OH)2反应,
则X可能是(BaCl2、CuSO4、Na2CO3)中的__________。
(11年)5、11、回答下列问题。
(1)浓盐酸有挥发性,应保存;
(2)石墨具有导电性,这属于石墨的(选填“物理”或“化学”)性质;
(3)化学反应CaCO3
CaO+CO2↑属于基本反应类型中的反应。
12、回答下列与水有关的问题。
(1)在水的净化过程中,常利用活性炭的性除去异味;
(2)日常生活中,通常利用加入的方法区别硬水和软水。
(3)电解水所得产物是H2和O2,说明水是由两种元素组成的。
14、对比分析下列各物质,回答有关问题:
(1)生铁和钢都是铁合金,但硬度不同,愿意是;
(2)NH4NO3和NH4Cl都含有(填离子符号),都能与熟石灰反应产生氨气;
(3)稀硫酸和盐酸的化学性质相似,但除去K2SO4中的KOH只能用其中的。
16、实验中注意安全是至关重要的,回答下列有关问题。
(1)点燃H2前需要检验H2的;
(2)不慎将燃着的酒精灯碰倒,洒出的酒精燃烧,立即用湿抹布盖灭,利用了灭火原理中的降低温度和;
(3)做硫在氧气中燃烧的实验时,可用NaOH溶液吸收有毒的SO2,产物是H2O和能溶于水的Na2SO3,这一反应可用化学方程式表示
为。
(10年)5、11.请回答下列问题:
(1)2个钾离子可表示为;
(2)地壳中含量最多的元素是;
(3)生活中降低水硬度的方法是。
12.右图A是某元素在元素周期表中的相关信息,B是其原子结构示意图。
(1)该元素的相对原子质量为;
(2)该元素属于元素;(选填:
“金属”或“非金属”)
(3)该原子在化学反应中容易电子。
13.请回答有关KCl溶液的问题。
(1)KCl溶液跟其它溶液一样,都具有稳定性和性;
(2)测得KCl溶液的pH=7,说明KCl溶液呈性;
(3)若用KCl溶液浇花,相当于为花施用了化肥中的肥。
15.根据“性质决定用途,用途体现性质”回答下列问题。
(1)浓硫酸有吸水性,在实验室中常用它做某些气体的;
(2)氮气常用作保护气,体现了氮气的化学性质;
(3)用稀盐酸除水垢时,盐酸跟水垢中碳酸钙反应的化学方程式为。
16.根据有关燃烧和燃料的知识回答下列问题。
(1)把蜡烛放在空气中,蜡烛没有燃烧,原因是;
(2把冷的白瓷碟子从上方移近蜡烛火焰,过一会儿,在碟子上出现了炭黑。
说明蜡烛中一定含有元素;
(3)常用燃料充分燃烧可以节约资源并减少对空气的污染。
增大燃料与空气的接触面和提供充足的都有利于燃料的充分燃烧。
(09年)5、11.请回答:
⑴地壳中含量最多的金属元素是;
⑵服用含有CaCO3的药物是为了补充元素;
⑶用澄清的石灰水检验二氧化碳时,能观察到的明显现象是。
12.运用化学知识和技能,可使自然界中的水得到一定程度的净化。
⑴自来水生产过程中,常用除去水中的异味;
⑵在家庭生活中,通过的方法可以降低水的硬度。
14.对甲烷(CH4)有如下描述:
A.难溶于水;B.能燃烧;C.可作燃料。
⑴用序号回答:
描述甲烷物理性质的是①,描述甲烷用途的是②;
⑵请写出甲烷在空气中燃烧的化学方程式。
17.酸在生产生活中领域有广泛应用。
请回答下列问题:
⑴胃液中有助于消化的酸是;
⑵浓硫酸常用作某些气体的干燥剂,主要是利用了浓硫酸的性;
⑶依据给出的溶解性表,写出一种跟盐酸、稀硫酸都能反应的可溶性盐;
⑷由①CuO+H2SO4=CuSO4+H2O,②K2O+2HNO3=2KNO3+H2O,③Fe2O3+6HCl=2FeCl3+3H2O可知,常温下酸与金属氧化物反应的规律是。
(08年)5、11.请回答:
⑴在O、O2、O2-中,表示氧离子的是;
⑵氮气的化学式是;
⑶右图是氯原子的结构示意图,由此可知,氯原子在
化学反应中容易电子(选填“得到”或“失去”)。
12.化学与生活紧密相关。
请你回答:
⑴用活性炭除去冰箱里的异味,是利用了活性炭的性;
⑵利用一氧化碳的能把赤铁矿(主要成分是Fe2O3)中的铁冶炼出来。
14.在种植蔬菜的大棚里,燃烧秸杆的目的是利用生成的CO2和草木灰(主要成分是K2CO3)。
请回答:
⑴CO2能促进植物的作用,从而提高蔬菜产量;
⑵草木灰作为肥料时,它的作用与(选填“氮肥”或“磷肥”或“钾肥”)相当;
⑶根据燃烧产物,可以推断秸杆中一定含有钾元素和元素。
16.“物质的组成与结构决定物质的性质,性质决定用途,用途体现性质。
”根据这一理论回答下列的问题:
⑴由于酒精能在空气中燃烧,所以酒精可用作;
⑵用墨书写或绘制的字画,能够保存很长时间而不褪色,这一事实体现了在常温下碳的化学性质;
⑶由于CO分子和CO2分子的不同,导致它们的化学性质不同。