高三化学月考知识点双向细目表.docx
《高三化学月考知识点双向细目表.docx》由会员分享,可在线阅读,更多相关《高三化学月考知识点双向细目表.docx(71页珍藏版)》请在冰豆网上搜索。
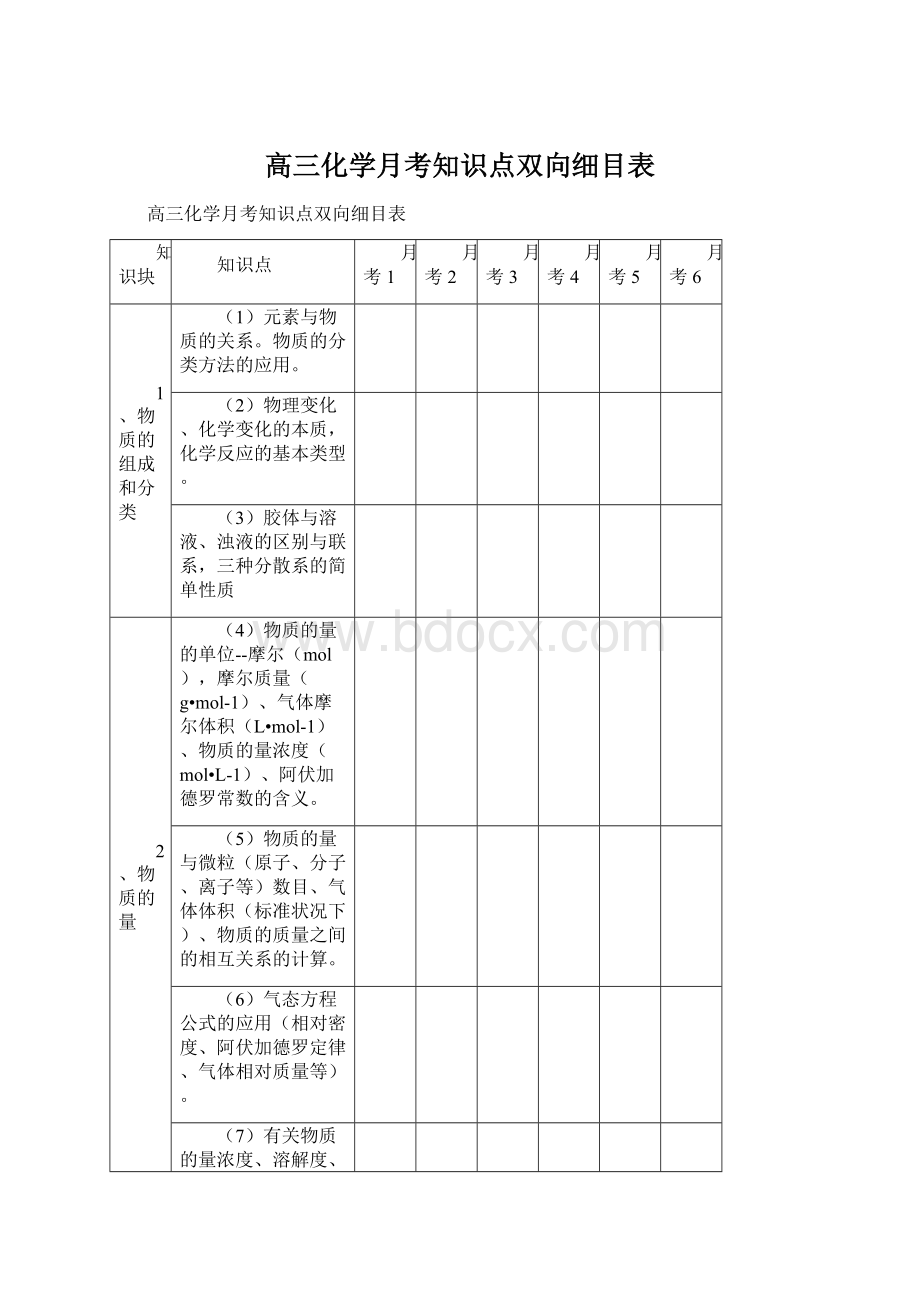
高三化学月考知识点双向细目表
高三化学月考知识点双向细目表
知识块
知识点
月考1
月考2
月考3
月考4
月考5
月考6
1、物质的组成和分类
(1)元素与物质的关系。
物质的分类方法的应用。
(2)物理变化、化学变化的本质,化学反应的基本类型。
(3)胶体与溶液、浊液的区别与联系,三种分散系的简单性质
2、物质的量
(4)物质的量的单位--摩尔(mol),摩尔质量(g•mol-1)、气体摩尔体积(L•mol-1)、物质的量浓度(mol•L-1)、阿伏加德罗常数的含义。
(5)物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)、物质的质量之间的相互关系的计算。
(6)气态方程公式的应用(相对密度、阿伏加德罗定律、气体相对质量等)。
(7)有关物质的量浓度、溶解度、溶质质量分数的简单计算。
3、离子反应
(8)电解质、非电解质、强电解质和弱电解质的概念判断。
(9)离子反应的概念、离子反应发生的条件,离子方程式的书写,离子方程式的正误判断。
(10)离子共存判断,常见离子的检验方法。
4、氧化还原反应
(11)氧化还原反应的本质和特征,氧化还原反应判断,分析氧化还原反应,氧化剂、还原剂判断。
(12)常见的氧化剂、还原剂判断,氧化性、还原性强弱的判断。
(13)简单氧化还原反应的配平,有关氧化还原反应的计算。
5、原子结构
(14)原子“三粒子”(质子、中子、电子)的性质、作用和关系。
(15)核外电子运动的特点及核外电子分层排布的规律,推断元素种类,原子结构示意图、核外电子排布式和同位素原子表示式。
(16)元素、同位素、核素的联系与区别,元素(同位素)相对原子质量的计算。
6、元素周期律与元素性质
(17)元素周期律的实质及元素周期表的结构(周期、族)
(18)元素性质(核外电子排布、原子半径、主要化合价、金属性与非金属性、最高价氧化物水化物的酸碱性、气态氢化物的稳定性)的意义及变化规律
(19)同一周期元素性质递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系。
知识块
知识点
7、化学键与物质性质
(20)化学键的概念,离子键、共价键的概念和形成过程。
(21)共价键的强弱判断,键能、键长与分子稳定性的关系,共价键的极性、分子的的极性概念及判断。
(22)离子化合物、共价化合物判断,共价键的表示方法(电子式、结构式),离子键的表示方法(电子式),用电子式表示化合物的形成过程。
(23)共价键、离子键的强弱对物质熔沸点高低的影响判断。
8、化学反应与能量
(24)化学反应能量变化的实质,焓变与反应热涵义,有关反应热的计算。
(25)热化学方程式的概念、书写与正误判断。
(26)燃烧热的概念,认识能源,提高能量利用效率的实际意义。
(27)理解盖斯定律,运用盖斯定律进行有关反应热的计算。
9、电化学基础
(28)原电池装置原理判断,原电池电极反应和电池反应方程式的书写。
常见化学电源的种类,碱性锌锰干电池、铅蓄电池、燃料电池的工作原理及其应用价值。
(29)电解池装置原理判断,电解池电极判断与电极反应和电池反应方程式的书写。
一些电解过程(如电解熔融氯化钠、饱和食盐水)实例工作原理分析及电极反应式书写与判断;了解电解原理在氯碱生产、金属精炼和电镀中的应用。
(30)金属腐蚀的原理,防止金属发生电化学腐蚀的主要措施。
金属腐蚀的应用等
10、化学反应速率和化学平衡
(31)化学反应速率的定义及其定量表示方法,有关化学反应速率的计算。
(32)“有效碰撞、活化分子和活化能”的概念及与化学反应速率的关系。
(33)浓度,压强、温度和催化剂等对化学反应速率的影响。
(34)化学平衡状态的定义及判断。
平衡常数(浓度平衡常数)的含义及其表达式。
能够进行平衡常数的简单计算和转化率的简单计算。
(35)勒夏特列原理,外界条件(浓度,压强、温度等)对化学平衡移动的影响。
(36)有关速率与平衡的相关计算及图象题。
化学反应速率和化学平衡在生活、生产中的作用。
(37)焓变和熵变与反应自发方向判断。
知识块
知识点
11、水溶液中的离子平衡
(38)强电解质和弱电解质的判断,电离平衡的含义,常见弱电解质的电离方程式的书写。
电离平衡常数的定义与应用,外界条件(浓度、温度、外加酸、碱等)对电离平衡的影响。
(39)水的电离,水的离子积常数的判断。
溶液的酸碱性与水溶液中[H+]和[OH-]的关系,pH的定义,溶液的酸碱性与pH的关系。
测定溶液pH的方法。
并能够计算稀的强酸、强碱溶液的pH。
(40)有关稀的强酸、强碱的单一溶液、混合溶液、溶液稀释等的pH计算。
(41)盐类水解反应的原理,水解规律及水解方程式的书写与判断,盐溶液的酸碱性及各离子浓度大小判断,盐类水解在生产、生活中的应用。
(42)外界条件(温度、浓度、外加酸或碱等)对水解平衡的影响。
(43)难溶电解质在水中存在沉淀溶解平衡,溶度积的含义,运用平衡移动的一般原理分析沉淀的溶解、生成和转化过程。
12、金属及其化合物的性质
(44)钠及其重要化合物的性质,焰色反应实验的应用。
碱金属元素的性质递变。
(45)镁、铝及其重要化合物的性质,铝元素的存在形式与溶液酸碱性的关系,有关铝的图象题。
(46)铁、铜及其重要化合物的性质,Fe(Ⅱ)、Fe(Ⅲ)的转化,变价金属元素的氧化性、还原性。
(47)合金的概念,能列举合金材料的重要应用
13、非金属及其化合物的性质
(48碳、硅及其重要化合物的性质。
(49)氯及其重要化合物的性质,卤素的性质递变。
(50)硫及其重要化合物的性质。
(51)氮及其重要化合物的性质。
14、有机物及性质
(52)有机化合物中碳的成键特征。
有机物的分类。
(53)简单同分异构体的书写。
简单系统命名法应用。
(54)甲烷、乙烯、苯等有机物的性质。
乙烯、氯乙烯、苯的衍生物等的重要作用。
(55)乙醇、乙酸的组成和主要性质及重要应用。
(56)有机反应的类型判断。
(57)糖类、油脂、蛋白质的组成和主要性质及重要应用。
(58)合成高分子化合物的方法(加聚、缩聚),高分子材料的合成反应及单体判断。
知识块
知识点
15、化学实验
(59)化学实验室常用仪器的用途和使用方法。
绘制和识别典型化学仪器装置图。
实验室常用试剂的使用和保存方法。
(60)化学实验的基本操作方法。
过滤和蒸发、蒸馏和萃取等分离和提纯原理、方法及实验注意事项。
(61)识别化学品安全使用标识。
实验室一般事故的预防和处理方法。
(62)常见气体的实验室制法(包括所用试剂、仪器、反应原理、净化、收集等)。
(63)常见离子(NH4+、Cl-、SO42-、CO32-、Fe3+等)的检验方法和常见物质(碳酸钠和碳酸氢钠等)的鉴别。
(64)配制一定物质的量度溶液的配制、酸碱中和滴定等实验操作及误差分析与判断。
16、化学与STS
(65)化学与生活、材料、能源、环境、生命过程、信息技术的关系等,化工生产中的“绿色化学”思想。
(66)海水中存在的重要元素及其在工业生产和高科技领域的潜在价值。
海水化学资源开发利用的方向。
(67)化学反应在制造新物质方面的作用,新物质的合成与应用对人类生活和环境的影响。
选修2化学与技术
一、化学与资源开发利用
1.煤、石油和天然气等综合利用。
2.我国无机化工的生产资源和产品的主要种类。
3.海水的综合利用。
化学科学发展对自然资源利用的作用。
4.化学对废旧物资再生与综合利用的作用。
二、化学与材料的制造、应用
5.社会发展和科技进步对材料的应用。
化学对材料科学发展的促进作用。
6.金属材料、无机非金属材料、高分子合成材料、复合材料和其他新材料的特点,有关的生产原理。
7.用化学方法进行金属材料表面处理。
8.我国现代材料研究和材料工业的发展情况。
新材料的发展方向及应用。
三、化学与工农业生产
9.化学在水处理中的应用。
10.常见化工生产(如合成氨、硫酸、硝酸的工作制法等)的主要原理、原料、重要设备、流程和意义,催化剂的研制对促进化学工业发展的重大意义。
11.精细化工产品的生产特点、精细化工在社会发展中的作用。
12.化学肥料、农药等在农业生产中的作用。
模块
知识块
知识点
选修3物质结构与性质
一、原子结构与元素的性质
1.原子核外电子的能级分布,电子排布式表示常见元素(1~36号)原子核外电子的排布。
原子核外电子的运动状态。
2.元素电离能的含义,用电离能说明元素的某些性质。
3.原子核外电子在一定条件下会发生跃迁的简单应用。
4.电负性的概念,知道元素的性质与电负性的关系。
二、化学键与物质的性质
5.离子键的形成,根据离子化合物的结构特征解释其物理性质。
6.共价键的主要类型(σ键和π键)判断,用键能、键长、键角等说明分子的某些性质。
7.简单配合物的成键情况。
8.原子晶体的特征,描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
9.金属键的含义,用金属键理论解释金属的一些物理性质。
10.杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3),用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构。
三、分子间作用力与物质的性质
11.化学键和分子间作用力的区别。
12.氢键的存在对物质性质的影响,列举含有氢键的物质。
13.分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
模块
知识块
知识点
选修5有机化学基础
一、有机化合物的组成与结构
1.根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
2.常见有机化合物的结构。
判断有机物分子中的官能团,正确地表示它们的结构。
3.确定有机化合物结构的化学方法和某些物理方法。
4.有机化合物同分异构现象,判断与书写简单有机物的同分异构体(不包括手性异构)。
5.根据有机化合物命名规则命名简单的有机化合物。
6.列举事实说明有机分子中基团之间存在相互影响。
二、烃及其衍生物的性质与应用
7.以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、性质上的差异。
8.天然气、石油液化气和汽油的主要成分及其应用。
9.烃类在有机合成和有机化工中的重要作用。
10.卤代烃、醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点以及它们的相互联系。
11.加成反应、取代反应和消去反应等有机反应的判断与应用。
12.某些有机化合物对环境和健康可能产生影响,关注有机化合物的安全使用问题。
三、基本营养物质
13.糖类的组成和性质特点,能举例说明糖类在食品加工和生物质能源开发上的应用。
14.油脂的组成、结构与性质
15.氨基酸的组成、结构特点和主要化学性质,氨基酸与人体健康的关系。
16.蛋白质的组成、结构和性质。
四、合成高分子化合物
17.合成高分子的组成与结构特点,依据简单合成高分子的结构分析其链节和单体。
18.加聚反应和缩聚反应的特点。
19.新型高分子材料的性能及其在高新技术领域中的应用。
20.合成高分子化合物在发展经济、提高生活质量方面的贡献。
2016届高三化学模拟考试知识点双向细目表
必考部分
知识块
知识点
一模
二模
三模
四模
五模
六模
七模
八模
1、物质的组成和分类
(1)元素与物质的关系。
物质的分类方法的应用。
(2)物理变化、化学变化的本质,化学反应的基本类型。
(3)胶体与溶液、浊液的区别与联系,三种分散系的简单性质
2、物质的量
(4)物质的量的单位--摩尔(mol),摩尔质量(g•mol-1)、气体摩尔体积(L•mol-1)、物质的量浓度(mol•L-1)、阿伏加德罗常数的含义。
(5)物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)、物质的质量之间的相互关系的计算。
(6)气态方程公式的应用(相对密度、阿伏加德罗定律、气体相对质量等)。
(7)有关物质的量浓度、溶解度、溶质质量分数的简单计算。
3、离子反应
(8)电解质、非电解质、强电解质和弱电解质的概念判断。
(9)离子反应的概念、离子反应发生的条件,离子方程式的书写,离子方程式的正误判断。
(10)离子共存判断,常见离子的检验方法。
4、氧化还原反应
(11)氧化还原反应的本质和特征,氧化还原反应判断,分析氧化还原反应,氧化剂、还原剂判断。
(12)常见的氧化剂、还原剂判断,氧化性、还原性强弱的判断。
(13)简单氧化还原反应的配平,有关氧化还原反应的计算。
5、原子结构
(14)原子“三粒子”(质子、中子、电子)的性质、作用和关系。
(15)核外电子运动的特点及核外电子分层排布的规律,推断元素种类,原子结构示意图、核外电子排布式和同位素原子表示式。
(16)元素、同位素、核素的联系与区别,元素(同位素)相对原子质量的计算。
6、元素周期律与元素性质
(17)元素周期律的实质及元素周期表的结构(周期、族)
(18)元素性质(核外电子排布、原子半径、主要化合价、金属性与非金属性、最高价氧化物水化物的酸碱性、气态氢化物的稳定性)的意义及变化规律
(19)同一周期元素性质递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系。
知识块
知识点
一模
二模
三模
四模
五模
六模
七模
八模
7、化学键与物质性质
(20)化学键的概念,离子键、共价键的概念和形成过程。
(21)共价键的强弱判断,键能、键长与分子稳定性的关系,共价键的极性、分子的的极性概念及判断。
(22)离子化合物、共价化合物判断,共价键的表示方法(电子式、结构式),离子键的表示方法(电子式),用电子式表示化合物的形成过程。
(23)共价键、离子键的强弱对物质熔沸点高低的影响判断。
8、化学反应与能量
(24)化学反应能量变化的实质,焓变与反应热涵义,有关反应热的计算。
(25)热化学方程式的概念、书写与正误判断。
(26)燃烧热的概念,认识能源,提高能量利用效率的实际意义。
(27)理解盖斯定律,运用盖斯定律进行有关反应热的计算。
9、电化学基础
(28)原电池装置原理判断,原电池电极反应和电池反应方程式的书写。
常见化学电源的种类,碱性锌锰干电池、铅蓄电池、燃料电池的工作原理及其应用价值。
(29)电解池装置原理判断,电解池电极判断与电极反应和电池反应方程式的书写。
一些电解过程(如电解熔融氯化钠、饱和食盐水)实例工作原理分析及电极反应式书写与判断;了解电解原理在氯碱生产、金属精炼和电镀中的应用。
(30)金属腐蚀的原理,防止金属发生电化学腐蚀的主要措施。
金属腐蚀的应用等
10、化学反应速率和化学平衡
(31)化学反应速率的定义及其定量表示方法,有关化学反应速率的计算。
(32)“有效碰撞、活化分子和活化能”的概念及与化学反应速率的关系。
(33)浓度,压强、温度和催化剂等对化学反应速率的影响。
(34)化学平衡状态的定义及判断。
平衡常数(浓度平衡常数)的含义及其表达式。
能够进行平衡常数的简单计算和转化率的简单计算。
(35)勒夏特列原理,外界条件(浓度,压强、温度等)对化学平衡移动的影响。
(36)有关速率与平衡的相关计算及图象题。
化学反应速率和化学平衡在生活、生产中的作用。
(37)焓变和熵变与反应自发方向判断。
知识块
知识点
一模
二模
三模
四模
五模
六模
七模
八模
11、水溶液中的离子平衡
(38)强电解质和弱电解质的判断,电离平衡的含义,常见弱电解质的电离方程式的书写。
电离平衡常数的定义与应用,外界条件(浓度、温度、外加酸、碱等)对电离平衡的影响。
(39)水的电离,水的离子积常数的判断。
溶液的酸碱性与水溶液中[H+]和[OH-]的关系,pH的定义,溶液的酸碱性与pH的关系。
测定溶液pH的方法。
并能够计算稀的强酸、强碱溶液的pH。
(40)有关稀的强酸、强碱的单一溶液、混合溶液、溶液稀释等的pH计算。
(41)盐类水解反应的原理,水解规律及水解方程式的书写与判断,盐溶液的酸碱性及各离子浓度大小判断,盐类水解在生产、生活中的应用。
(42)外界条件(温度、浓度、外加酸或碱等)对水解平衡的影响。
(43)难溶电解质在水中存在沉淀溶解平衡,溶度积的含义,运用平衡移动的一般原理分析沉淀的溶解、生成和转化过程。
12、金属及其化合物的性质
(44)钠及其重要化合物的性质,焰色反应实验的应用。
碱金属元素的性质递变。
(45)镁、铝及其重要化合物的性质,铝元素的存在形式与溶液酸碱性的关系,有关铝的图象题。
(46)铁、铜及其重要化合物的性质,Fe(Ⅱ)、Fe(Ⅲ)的转化,变价金属元素的氧化性、还原性。
(47)合金的概念,能列举合金材料的重要应用
13、非金属及其化合物的性质
(48碳、硅及其重要化合物的性质。
(49)氯及其重要化合物的性质,卤素的性质递变。
(50)硫及其重要化合物的性质。
(51)氮及其重要化合物的性质。
14、有机物及性质
(52)有机化合物中碳的成键特征。
有机物的分类。
(53)简单同分异构体的书写。
简单系统命名法应用。
(54)甲烷、乙烯、苯等有机物的性质。
乙烯、氯乙烯、苯的衍生物等的重要作用。
(55)乙醇、乙酸的组成和主要性质及重要应用。
(56)有机反应的类型判断。
(57)糖类、油脂、蛋白质的组成和主要性质及重要应用。
(58)合成高分子化合物的方法(加聚、缩聚),高分子材料的合成反应及单体判断。
知识块
知识点
一模
二模
三模
四模
五模
六模
七模
八模
15、化学实验
(59)化学实验室常用仪器的用途和使用方法。
绘制和识别典型化学仪器装置图。
实验室常用