第10章酶的作用机制和酶的调节.docx
《第10章酶的作用机制和酶的调节.docx》由会员分享,可在线阅读,更多相关《第10章酶的作用机制和酶的调节.docx(32页珍藏版)》请在冰豆网上搜索。
第10章酶的作用机制和酶的调节
第十章酶的作用机制和酶的调节
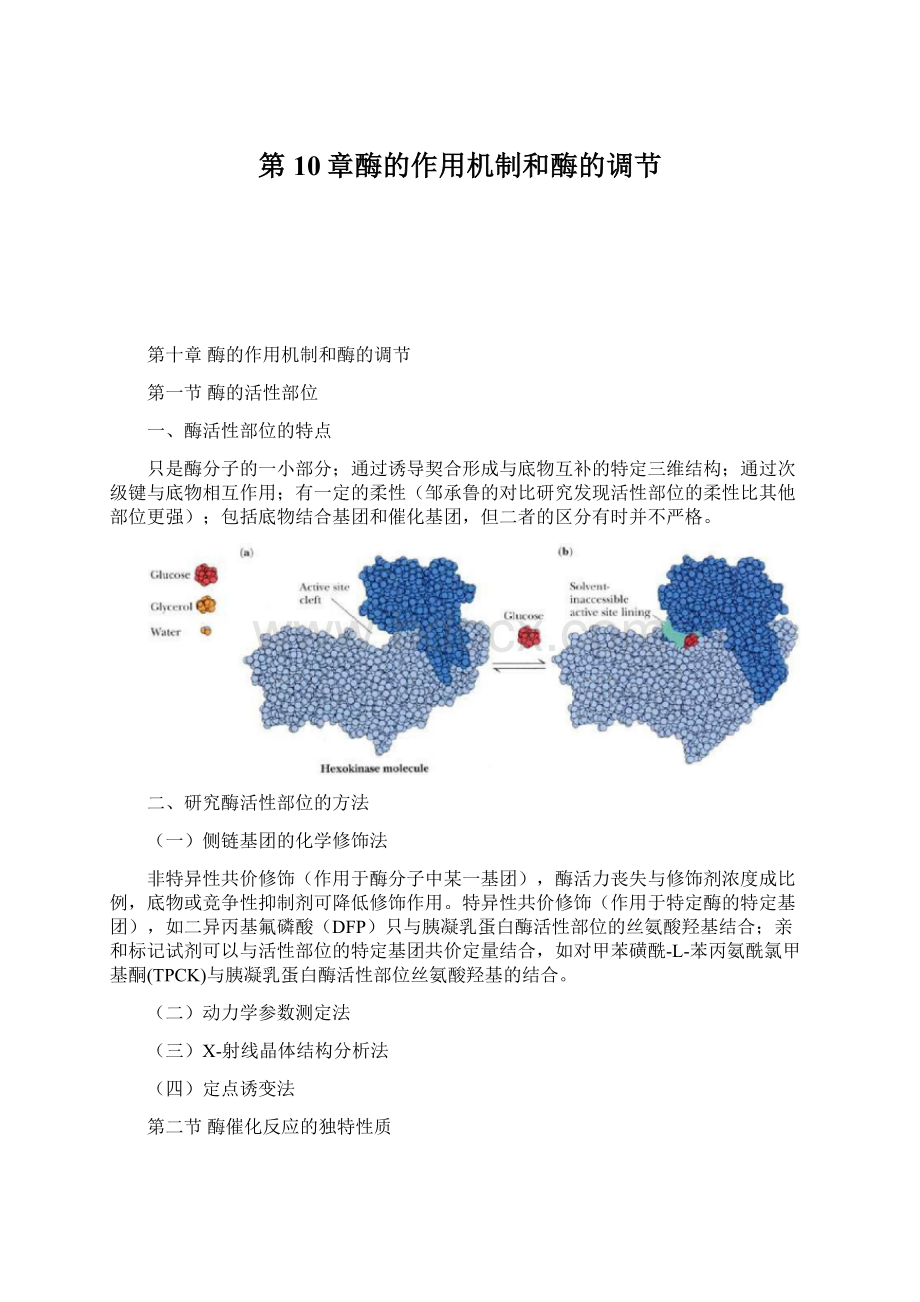
第一节酶的活性部位
一、酶活性部位的特点
只是酶分子的一小部分;通过诱导契合形成与底物互补的特定三维结构;通过次级键与底物相互作用;有一定的柔性(邹承鲁的对比研究发现活性部位的柔性比其他部位更强);包括底物结合基团和催化基团,但二者的区分有时并不严格。
二、研究酶活性部位的方法
(一)侧链基团的化学修饰法
非特异性共价修饰(作用于酶分子中某一基团),酶活力丧失与修饰剂浓度成比例,底物或竞争性抑制剂可降低修饰作用。
特异性共价修饰(作用于特定酶的特定基团),如二异丙基氟磷酸(DFP)只与胰凝乳蛋白酶活性部位的丝氨酸羟基结合;亲和标记试剂可以与活性部位的特定基团共价定量结合,如对甲苯磺酰-L-苯丙氨酰氯甲基酮(TPCK)与胰凝乳蛋白酶活性部位丝氨酸羟基的结合。
(二)动力学参数测定法
(三)X-射线晶体结构分析法
(四)定点诱变法
第二节酶催化反应的独特性质
第三节影响酶催化效率的有关因素
一、底物和酶的邻近效应(approximation,proximity)与定向效应(orientation)
底物分子结合到酶的活性中心,使底物在酶活性中心的有效浓度大大增加,从而加快反应的速度。
一个有机化学模型。
咪唑催化对硝基苯酯的水解,分子内反应比分子间反应快24倍。
底物分子中参与反应的基团相互接近,并被严格定向定位,使酶促反应具有高效率称定向效应。
邻羟基苯丙酸内脂的形成反应,两个甲基使羧基和羟基更好的定向,使反应速率提高2.5×1011。
二、底物的形变(distortion)和诱导契合(inducednt)
脯氨酸消旋酶的过渡态类似物与酶的亲和力远大于其底物,说明酶可以引起底物的形变。
酵母醛缩酶的过渡态类似物与酶的亲和力远大于其底物,说明酶可以引起底物的形变。
小牛小肠腺苷脱氨酶的过渡态类似物与酶的亲和力远大于其底物,说明酶可以引起底物的形变。
三、酸碱催化(acid—basecatalysis)
专一性(狭义)酸碱催化
总酸碱催化或广义酸碱催化
表观速度常数依赖于pH和溶液浓度。
Brφnsted催化作用定律:
Logka=CA−α(pKa)
pKa和pKb是总酸碱的解离常数,ka和kb是反应的速度常数。
CA和CB为常数,与反应类型、温度、溶剂等因素有关。
pKa小,则H+浓度高。
α和β是Brφnsted系数,范围在0到1之间,接近于1为专一性酸碱催化,接近于0表示酸碱催化不起作用。
咪唑基的pK值接近生理pH值,H+的传递速度快,是酸碱催化中最重要的基团。
四、共价催化
酶与底物形成共价键的3个例子,其共同特点是酶的亲核中心X进攻底物的亲电中心。
五、金属离子催化
金属酶含紧密结合的金属离子。
金属激活酶含松散结合的金属离子。
金属离子的作用主要有:
与结合底物为反应定向;
参与氧化还原反应;
稳定或屏蔽负电荷;
活化水分子;
与过渡态底物形成螯合物。
六、多元催化和协同效应
酶的催化过程通常是多种机制同时作用,相互协同,因而有很高的催化效率。
七、活性部位微环境的影响
第四节酶催化反应机制的实例
一、溶菌酶(1ysozyme)
二、胰核糖核酸酶A(pancreaticribonucleaseA,RNaseA)
四、丝氨酸蛋白酶(serineproteases)
胰凝乳蛋白酶、胰蛋白酶、弹性蛋白酶氨基酸序列的比较,黑点表示相同的氨基酸,活性部位的氨基酸用符号标出。
胰凝乳蛋白酶和水蛭蛋白酶抑制剂(蓝色带状)的结构,His57(蓝色),Asp102(红色),Ser195(黄色)在空间上十分靠近。
胰凝乳蛋白酶催化的裂解反应的动力学。
乙酸基以共价键与酶的Ser195结合,因而释放较晚。
酰基-酶中间物快速形成,随后缓慢释放产物。
胰凝乳蛋白酶催化反应的机制:
五、天冬氨酸蛋白酶(asparticproteases)
若为共价催化,会有两种中间物之一,两种中间物均未能找到,说明这一类酶为非共价催化。
(a)HIV-1protease,adimer,and(b)pepsin(amonomer).Pepsin′sN-terminalhalfisshowninred;
C-terminalhalfisshowninblue.
HIV-1proteasecomplexedwiththeinhibitorCrixivanR(red)theflaps(residues46-55fromeachsubunit)coveringtheactivesiteareshowningreenandtheactivesiteaspartateresiduesinvolvedincatalysisareshowninwhite.
第五节酶活性的调节控制
一、别构调控(allosteriregulation)
(一)别构酶的性质
别构酶均为寡聚酶,除活性部位外,还有可以同效应物(调节物)结合的调节部位。
别构酶的调控方式有四类:
正协同效应:
酶的一个亚基与底物结合后,其他亚基与底物的结合能力加强,v-[S]曲线为S形。
负协同效应:
酶的一个亚基与底物结合后,其他亚基与底物的结合能力减弱,v-[S]曲线为平坦的双曲线。
可用Rs([S]90%V/[S]10%V)来定量地区分三种酶:
Rs等于81为米氏酶,大于81则有正协同效应,小于81为负协同效应。
更常用的是Hill系数法,以log(v/(Vm-v))对log[S]作图,曲线的最大斜率为Hill系数,米氏酶等于1,正协同酶大于1,负协同小于1。
别构抑制作用使酶的反应速度降低,正协同效应加强。
别构激活作用使酶的反应速度加快,正协同效应减弱。
目前认为齐变模型不适合于负协同效应。
(二)天冬氨酸转氨甲酰酶的性质
天冬氨酸为正协同效应剂;
ATP为别构激活剂;
CTP为别构抑制剂。
(三)3-磷酸甘油醛脱氢酶
3-磷酸甘油醛脱氢酶是负协同效应酶的典型代表。
3-磷酸甘油醛脱氢酶有4个亚基,一个亚基与NAD+结合后发生构像变化,其它亚基与NAD+结合的能力下降(表10-8),表现为负协同效应。
由于负协同效应,在NAD+浓度很低的情况下,糖酵解过程仍然能以较快的速率顺利进行。
二、酶原的激活
(一)消化系统蛋白酶原的激活
(二)凝血机制
12种蛋白质凝血因子有7种是丝氨酸蛋白酶。
三、可逆的共价修饰(reversiblecovalentmodification)
共价修饰包括:
磷酸化、腺苷酰化、尿苷酰化、ADP-糖基化、甲基化等。
磷酸化存在普遍,有非常重要的生理意义,主要以P-O键或P-N键连接。
蛋白质的磷酸化主要由蛋白激酶催化,常见的蛋白激酶有蛋白激酶A(PKA),蛋白激酶C(PKC),
磷酸化酶激酶(phK),蛋白酪氨酸激酶(PTK)等。
GlycogenPhosphorylase:
AllostericRegulationandCovalentModification.
糖原磷酸化酶二聚体的带状结构:
黑色带子为磷酸化酶b(未磷酸化)的10-25残基;在磷酸化酶a(磷酸化)中,的10-25残基的位置用黄色带子表示。
第六节同工酶