佛山备战中考化学压轴题之流程图备战中考题型整理突破提升.docx
《佛山备战中考化学压轴题之流程图备战中考题型整理突破提升.docx》由会员分享,可在线阅读,更多相关《佛山备战中考化学压轴题之流程图备战中考题型整理突破提升.docx(33页珍藏版)》请在冰豆网上搜索。
佛山备战中考化学压轴题之流程图备战中考题型整理突破提升
一、中考初中化学流程图
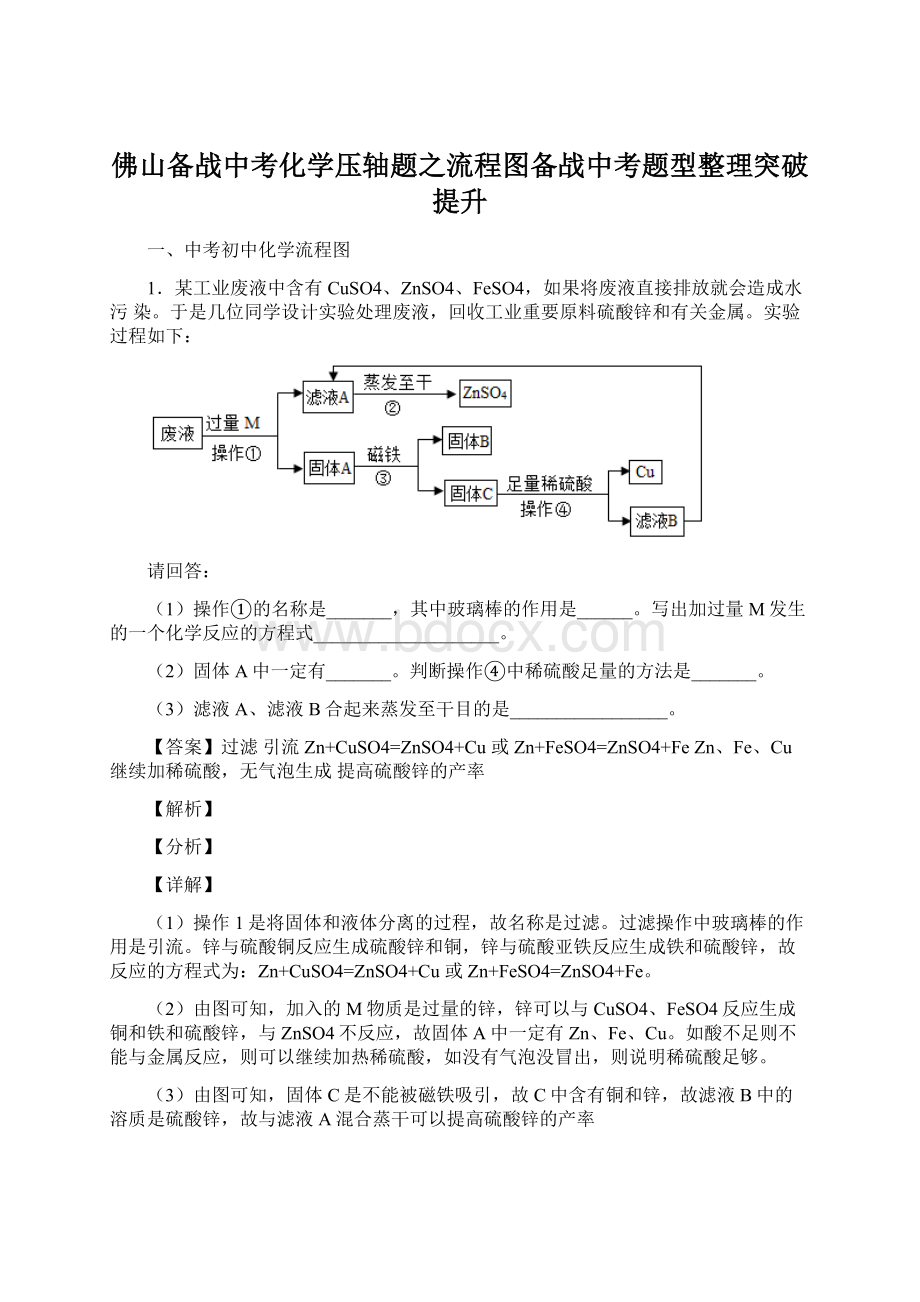
1.某工业废液中含有CuSO4、ZnSO4、FeSO4,如果将废液直接排放就会造成水污染。
于是几位同学设计实验处理废液,回收工业重要原料硫酸锌和有关金属。
实验过程如下:
请回答:
(1)操作①的名称是_______,其中玻璃棒的作用是______。
写出加过量M发生的一个化学反应的方程式____________________。
(2)固体A中一定有_______。
判断操作④中稀硫酸足量的方法是_______。
(3)滤液A、滤液B合起来蒸发至干目的是_________________。
【答案】过滤引流Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4=ZnSO4+FeZn、Fe、Cu继续加稀硫酸,无气泡生成提高硫酸锌的产率
【解析】
【分析】
【详解】
(1)操作1是将固体和液体分离的过程,故名称是过滤。
过滤操作中玻璃棒的作用是引流。
锌与硫酸铜反应生成硫酸锌和铜,锌与硫酸亚铁反应生成铁和硫酸锌,故反应的方程式为:
Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4=ZnSO4+Fe。
(2)由图可知,加入的M物质是过量的锌,锌可以与CuSO4、FeSO4反应生成铜和铁和硫酸锌,与ZnSO4不反应,故固体A中一定有Zn、Fe、Cu。
如酸不足则不能与金属反应,则可以继续加热稀硫酸,如没有气泡没冒出,则说明稀硫酸足够。
(3)由图可知,固体C是不能被磁铁吸引,故C中含有铜和锌,故滤液B中的溶质是硫酸锌,故与滤液A混合蒸干可以提高硫酸锌的产率
2.通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgC12、CaCl2、Na2SO4以及泥沙等杂质。
以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是_______________。
(2)第⑤步“过滤”操作中用到的仪器除烧杯、玻璃棒外还需要的玻璃仪器是_______________。
得到沉淀的成分有:
泥沙、BaSO4、Mg(OH)2、_______________(填化学式)。
(3)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是_______________。
(4)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒________,理由是_______。
(5)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是_______________。
【答案】加快氯化钠的溶解速率漏斗CaCO3、BaCO3会引入新的杂质氯化钾不可以碳酸钠的作用是既除去氯化钙,又除去过量的氯化钡除去过量的氢氧化钠和碳酸钠
【解析】
【分析】
【详解】
(1)用玻璃棒搅拌,使粗盐与水充分接触,能加快氯化钠的溶解速率。
故溶解时搅拌的作用是:
加快氯化钠的溶解速率;
(2)过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;第二步中过量的氯化钡和硫酸钠反应生成硫酸钡沉淀,第三步过量的氢氧化钠和氯化镁反应生成氢氧化镁沉淀,第四步加入过量的碳酸钠,除了和氯化钙反应生成碳酸钙沉淀外,还和第二步剩余的氯化钡反应生成碳酸钡沉淀,故第⑤步“过滤”操作中得到沉淀的成分有:
泥沙、BaSO4、Mg(OH)2、CaCO3、BaCO3;
(3)因为氢氧化钾会与氯化镁反应生成氢氧化镁沉淀和氯化钾,氯化钾对氯化钠来说就是新杂质,所以在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是:
会引入新的杂质氯化钾;
(4)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序不可以颠倒,理由是:
碳酸钠的作用是既除去氯化钙,又除去过量的氯化钡。
如果顺序颠倒,过量的氯化钡不能被除去。
(5)最后得到的滤液中溶质除含有氯化钠外,还含有反应中剩余的碳酸钠和氢氧化钠,利用粗盐制备精盐过程的第⑥步操作,盐酸能和氢氧化钠、碳酸钠反应生成氯化钠,故加入适量盐酸的目的是:
除去过量的氢氧化钠和碳酸钠。
3.随着世界工业经济的发展、人口的剧增、人类欲望的无限上升和生产生活方式的无节制,世界气候面临越来越严重的问题,二氧化碳排放量越来越大,全球灾难性气候变化屡屡出现,已经严重危害到人类的生存环境和健康安全。
以下流程是通过控制化学反应的条件来促进或抑制化学反应,实现“低碳”,从而更好地通过化学反应为人类造福。
根据上述流程回答下列问题:
(1)上述流程中可循环利用的物质是___________。
(2)“低碳”是全世界的主题,这里的“碳”主要是指_____________气体。
(3)甲醇(CH3OH)完全燃烧除了生成二氧化碳外,还生成一种常温下为液态的化合物,发生反应的化学方程式为_______________。
(4)证明液化石油气、汽油、甲醇等燃料燃烧产物中含有二氧化碳的方法是(用化学方程式表示)_______________。
【答案】二氧化碳二氧化碳
【解析】
【分析】
【详解】
(1)根据流程图,可循环利用的物质是二氧化碳。
(2)“低碳”就是较低的二氧化碳排放,这里的“碳”主要是指二氧化碳气体。
(3)甲醇(CH3OH)完全燃烧生成二氧化碳和水,发生反应的化学方程式为
。
(4)检验二氧化碳的方法是通入澄清石灰水,其化学方程式为
。
4.氮化亚铜(CuC1)常用作有机合成工业中的催化剂。
下图是工业上用印刷电路的蚀刻液的废液(含FeCl3、CuCl2、FeCl2)生产CuCl2的流程并制得FeCl3蚀刻液。
[资料]
(1)氯化亚铜是一种白色晶体,微溶于水、不溶于乙醇及稀硫酸;
(2)
按要求回答下列问题:
(1)废液中加入铁粉时,滤渣1的成分是____________(填化学式)。
(2)滤液1、2合并后与过氧化氢溶液反应的化学方程式为_________________。
(3)上述流程中化合价发生改变的非金属元素有____________(填元素符号)。
分离、提纯CuCl晶体过程中的“系列操作”包括“调pH、_________洗涤、低温烘干”。
为得到纯净的Cucl晶体,可用下列___________(填字母序号)进洗涤。
a.乙醇
b.蒸馏水
c.氯化钠溶液
【答案】Cu、Fe2FeCl2+2HCl+H2O2=2FeCl3+2H2OO、S过滤a
【解析】
【分析】
【详解】
(1)废液中加入过量铁粉,氯化铁和铁粉反应生成氯化亚铁,氯化铜和铁粉反应生成氯化亚铁和铜,故滤液1为氯化亚铁溶液,滤渣1为铜和铁粉,故填:
Cu、Fe。
(2)滤渣1加入过量稀盐酸,稀盐酸和铁反应生成氯化亚铁和氢气,滤液2为氯化亚铁溶和稀盐酸混合溶液,滤液1和滤液2混合后溶质是氯化亚铁和氯化氢,氯化亚铁氯化氢混合溶液和过氧化氢反应生成氯化铁,根据质量守恒,生成物中除了氯化铁以外,必须含有氢元素,氧元素,故生成物必须有水,故化学方程式为2FeCl2+2HCl+H2O2=2FeCl3+2H2O,故填:
2FeCl2+2HCl+H2O2=2FeCl3+2H2O。
(3)反应过程中过氧化氢中氧元素为-1价变为了-2价,滤渣2加浓硫酸生成二氧化硫,硫元素由+6价变为+4价,化合价发生改变的非金属元素有O、S,分离、提纯CuCl晶体过程中的“系列操作”包括“调pH、过滤、洗涤、低温烘干”。
为得到纯净CuCl晶体,可用下乙醇洗涤,因为CuCl在乙醇中不溶解,故填:
O、S;过滤;a。
5.某校兴趣小组欲利用ZnCO3和Cu2O的混合物制备硫酸锌和金属铜。
该小组设计了如图的实验方案,回答下列有关问题:
(查阅资料:
Cu2O是红色固体,它与稀硫酸的反应为:
Cu2O+H2SO4═CuSO4+Cu+H2O)
(1)图中X的化学式为_____,A中的物质有_____。
(2)加入过量的Y有两个作用:
一是_____,二是_____。
写出其中1个反应的化学方程式_____。
(3)操作Ⅰ、Ⅱ用到的玻璃仪器有烧杯、漏斗和_____,该仪器在操作Ⅱ中起到的作用是_____。
(4)操作Ⅲ包含蒸发浓缩、_____、过滤。
【答案】H2SO4Zn和Cu除去过量的硫酸将铜完全置换出来Zn+H2SO4=ZnSO4+H2↑或Zn+CuSO4=ZnSO4+Cu玻璃棒引流降温结晶
【解析】
【分析】
ZnCO3和Cu2O的混合物制备硫酸锌和金属铜,而碳酸锌不溶水,可以溶于酸,依据质量守恒定律,制备硫酸锌,反应物中需要有硫酸根离子,所以X是硫酸,混合物中加入过量的硫酸反应后的溶液中有硫酸锌、硫酸铜、铜,加入过量的Y后得到了滤液B和固体A,所以Y是锌,过量的锌可以使硫酸和硫酸铜完全反应,所以A中的物质有:
Zn和Cu;在固体A中加入硫酸后可以得到硫酸锌和铜,硫酸锌溶液经过蒸发后可以得到硫酸锌晶体。
【详解】
(1)该实验流程是利用ZnCO3和Cu2O的混合物制备硫酸锌和金属铜,而碳酸锌不溶水,可以溶于酸,依据质量守恒定律,制备硫酸锌,反应物中需要有硫酸根离子,所以X是硫酸,X的化学式:
H2SO4,混合物中加入过量的硫酸反应后的溶液中有硫酸锌、硫酸铜、铜,加入过量的Y后得到了滤液B和固体A,所以Y是锌,过量的锌可以硫酸和硫酸铜完全反应,所以A中的物质有:
Zn和Cu。
(2)加入过量Y后得到了硫酸锌和固体A,而上一步中加入的硫酸是过量的,反应中也生成了硫酸铜,所以加入过量锌的作用是:
除去过量的硫酸,将铜完全置换出来;锌与硫酸铜反应生成硫酸锌和铜,反应的化学方程式为:
Zn+CuSO4=ZnSO4+Cu。
(3)操作Ⅰ后得到了固体和液体,所以操作Ⅰ是过滤,操作Ⅱ后也得到了固体和液体,所以操作Ⅱ是过滤,操作Ⅰ、Ⅱ用到的玻璃仪器有烧杯、漏斗和玻璃棒,该仪器在操作Ⅱ中起到的作用是引流。
(4)经过操作Ⅲ后从溶液中得到了硫酸锌晶体,所以操作Ⅲ的名称:
蒸发,操作Ⅲ包含蒸发浓缩、降温结晶、过滤。
【点睛】
碳酸锌不溶水,可以溶于酸,过量的锌可以硫酸和硫酸铜完全反应,过滤用到的玻璃仪器有烧杯、漏斗和玻璃棒,玻璃棒起到的作用是引流。
6.我国科学家侯德榜,在氨碱法的基础上,创立了更为先进的联合制碱法生产纯碱碳酸钠。
某海边工厂利用贝壳、海盐等生产纯碱的主要工艺流程如下:
(1)反应①的化学方程式为_____。
反应②属于_____反应(填基本反应类型)。
(2)工业上常用_____的方法制取氮气,该过程属于_____变化。
(3)操作a的名称是_____,实验室在进行该操作时,用到的玻璃仪器有烧杯、漏斗和_____。
(4)在工农业生产过程中,会排放CO2加剧温室效应。
下列做法能减少二氧化碳排放的是_____(填序号)。
a焚烧秸秆肥田b提高火力发电量c大力使用清洁能源
(5)有一种处理CO2的方法,是将CO2与氢气在一定条件下反应生成甲烷和水,该反应的化学方程式为:
_____。
【答案】CaCO3
CaO+CO2↑分解分离液态空气物理过滤玻璃棒cCO2+4H2
CH4+2H2O
【解析】
【分析】
【详解】
(1)反应①是高温煅烧碳酸钙生成氧化钙和二氧化碳,反应的化学方程式为:
CaCO3
CaO+CO2↑;反应②中,碳酸氢钠加热分解生成碳酸钠、水和二氧化碳,属于分解反应。
故填:
CaCO3
CaO+CO2↑;分解反应。
(2)工业上用分离液态空气的方法制取氮气时,只是把氮气从空气中分离出来,没有生成新物质,属于物理变化。
故填:
分离液态空气;物理。
(3)操作a的名称是过滤,通过过滤把碳酸氢钠从溶液中分离出来;实验室进行此操作时所需的玻璃仪器有烧杯、漏斗、玻璃棒。
故填:
过滤;玻璃棒。
(4)a.焚烧秸杆时能够产生大量的二氧化碳,加剧温室效应;
b.火力发电时需要燃烧大量的煤,煤燃烧时能够产生大量的二氧化碳,加剧温室效应;
c.发展太阳能不会产生二氧化碳。
故选:
c。
(5)CO2与氢气在一定条件下反应生成甲烷和水,该反应的化学方程式为:
CO2+4H2
CH4+2H2O。
故填:
CO2+4H2
CH4+2H2O。
7.SrCl2·6H2O具有很高的经济价值,以工业碳酸锶(SrCO3质量分数为98.5%,极少量Ba2+,微量Fe2+)为原料制备SrCl2·6H2O的工艺流程如下:
已知:
①SrCl2难溶于酒精,SrCl2·6H2O在61.5℃会失去结晶水,生成SrCl2·2H2O。
②降温结晶速率太快,会导致晶体细碎,夹带溶液,导致晶体不纯。
③SrCl2溶解度曲线及结晶装置图如下:
(1)酸浸时,搅拌的作用是____。
发生反应的化学方程式主要为____,属于____反应(填基本反应类型)。
能否用稀硫酸代替稀盐酸,__(填“能”或“否”)理由是___。
(2)沉淀A为____(填化学式),沉淀B为红褐色,是____(填化学式)。
调节pH时,最好选用的试剂是____。
ANaOH
BCa(OH)2
CSr(OH)2
(3)流程中,“……”为一系列操作,分别为蒸发浓缩→____→过滤→洗涤→烘干。
实验室完成过滤操作所需的玻璃仪器有烧杯、玻璃棒、____。
夹套式玻璃结晶器的夹套内是冷却水,可由外接计算机程序精确控制进水的温度,进水口为____(填“a”或“b”)。
(4)洗涤SrCl2·6H2O晶体适宜选用的试剂是____。
A0℃时蒸馏水
B常温SrCl2饱和溶液
C热水
D无水酒精
(5)SrCl2·6H2O晶体烘干的适宜温度为___。
A50~60℃
B70~80℃
C80~100℃
D100℃以上
(6)常用锶转化率衡量工艺水准,本工艺使用100吨工业碳酸锶,最终得到176.9吨SrCl2·6H2O,则本工艺中的锶转化率约为___。
(精确到小数点后一位)
【答案】使反应物充分接触,反应更快更充分
复分解否因为要制备SrCl2·6H2O,使用稀硫酸会引入杂质硫酸根离子BaSO4Fe(OH)3C冷却结晶漏斗aBA99.5%
【解析】
【分析】
【详解】
(1)酸浸时,搅拌的作用是使反应物充分接触,反应更快更充分。
发生反应的化学方程式主要为
,具有两种化合物交换成分生成另外两种化合物,属于复分解反应。
不能用稀硫酸代替稀盐酸,填否,理由是:
因为要制备SrCl2·6H2O,使用稀硫酸会引入杂质硫酸根离子。
(2)钡离子和硫酸根离子结合成硫酸钡沉淀,沉淀A为BaSO4,沉淀B为红褐色的氢氧化铁,化学式为Fe(OH)3)。
调节pH时,最好选用的试剂是Sr(OH)2,以免引入钠离子和钙离子。
故选C。
(3)流程中,“……”为一系列操作,分别为蒸发浓缩→冷却结晶→过滤→洗涤→烘干。
实验室完成过滤操作所需的玻璃仪器有烧杯、玻璃棒、漏斗。
夹套式玻璃结晶器的夹套内是冷却水,可由外接计算机程序精确控制进水的温度,进水口为a,有利于充满装置,冷却效果好。
(4)洗涤SrCl2·6H2O晶体适宜选用的试剂是:
常温SrCl2饱和溶液,以免晶体损失。
故选B。
(5)SrCl2·6H2O在61.5℃会失去结晶水,生成SrCl2·2H2O。
SrCl2·6H2O晶体烘干的适宜温度为50~60℃,不超过61.5℃。
故选A。
(6)常用锶转化率衡量工艺水准,本工艺使用100吨工业碳酸锶,最终得到176.9吨SrCl2·6H2O,则本工艺中的锶转化率约为
,
。
8.无水溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。
实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
完成下列填空:
(1)上述使用的氢溴酸(HBr)的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸,所需的玻璃仪器有玻璃棒、烧杯、__________。
(2)已知步骤Ⅲ的滤液中不含NH4+。
步骤Ⅱ加入的试剂a是_____,控制溶液的pH约为8.0,将Al3+、Fe3+分别转化成沉淀而除去,写出沉淀的化学式__________。
(3)试剂b的作用__________,写出发生的化学反应方程式____________________。
(4)步骤Ⅴ所含的操作依次是_______________、降温结晶、过滤。
【答案】量筒和胶头滴管Ca(OH)2Al(OH)3、Fe(OH)3除去过量的Ca(OH)2Ca(OH)2+2HBr=CaBr2+2H2O蒸发浓缩
【解析】
【分析】
【详解】
(1)若用47%的氢溴酸配置26%的氢溴酸,属于浓溶液的稀释问题,稀释溶液所需的玻璃仪器有玻璃棒、烧杯、量筒和胶头滴管。
需要计算好加水的体积和浓溶液的体积,量取一定量的液体体积需要用到玻璃仪器有:
量筒和胶头滴管。
故填:
量筒和胶头滴管。
(2)步骤Ⅰ中加入的氢溴酸是过量的,所以步骤Ⅱ中的溶液是酸性的,加入的试剂a后,控制溶液的pH约为8.0,能将Al3+、Fe3+分别转化成沉淀而除去,所以a是碱,同时不能引入新杂质,所以a是氢氧化钙(石灰水);将Al3+、Fe3+分别转化成氢氧化铝和氢氧化铁沉淀,所以沉淀的化学式为Al(OH)3、Fe(OH)3。
故填:
Ca(OH)2;Al(OH)3、Fe(OH)3。
(3)步骤Ⅱ中的溶液是酸性的,加入的试剂a(氢氧化钙)过量,所以步骤Ⅲ的滤液中含有氢氧化钙,加入试剂b目的除去氢氧化钙还不能引入新杂质,故b是适量的氢溴酸。
氢溴酸与氢氧化钙反应生成溴化钙和水,反应方程式为:
Ca(OH)2+2HBr=CaBr2+2H2O。
故填:
除去过量的Ca(OH)2;Ca(OH)2+2HBr=CaBr2+2H2O。
(4)步骤Ⅳ加入适量氢溴酸后得到的是不含其它溶质的溴化钙溶液,步骤Ⅴ经过蒸发浓缩、降温结晶、过滤,可以得到溴化钙晶体。
故填:
蒸发浓缩。
9.己知某粗盐样品中含有Na2SO4、MgCl2、CaCl2等杂质。
实验室提纯流程如下:
(1)第④步操作发生反应的化学方程式是______________________________。
(2)第⑤步操作的目的是__________________________________。
(3)现用质量分数为12%的氯化钠溶液(密度约为1.09g/cm3),配制20g质量分数为6%的氯化钠溶液:
①需要质量分数为12%的氯化钠溶液_________mL(计算结果精确到0.1),需要水____________mL(水的密度为1g/cm3)。
②该溶液配制过程中用到的仪器除了量筒、烧杯、玻璃棒外,还需要____________。
量取所需要的12%的氯化钠溶液时,应选用________(填“10mL”或“20mL”或.“50mL”)规格的量筒。
【答案】MgCl2+2NaOH=Mg(OH)2↓+2NaCl除去杂质CaCl2和加入的过量试剂BaCl29.210胶头滴管10mL
【解析】
(1).加入过量氢氧化钠溶液的目的是除去氯化镁,发生反应的化学方程式是MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(2)加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2;因为碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;和氯化钡反应生成碳酸钡沉淀和氯化钠;(3)设配制20g质量分数为6%的氯化钠溶液,需要质量分数为12%的氯化钠溶液xml,20g×6%=12%×x×1g/cm3,x=9.2ml;②量取液体时应先倾倒至接近刻度,然后用胶头滴管滴加至刻度线,所以还需要胶头滴管。
选取量筒的原则是量筒的量程和被量的液体体积接近,同时一定一次量完,所以量取9.2ml的12%的氯化钠溶液时,应选用10mL的量筒。
10.侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展做出了杰出贡献。
工业上以半水煤气(主要成分是N2、H2、CO2)、食盐等为原料制取纯碱,相关流程如下:
(1)流程中循环利用的物质有H2O和_____(写化学式)。
(2)请写出步骤Ⅴ中的化学反应方程式_____。
(3)已知A为铵态氮肥,请推断该物质为_____(写化学式)。
(4)侯氏制碱法制取纯碱过程中部分物质的溶解度曲线如下,试回答下列问题:
①60℃时,27.6gNH4Cl完全溶解至少需要_____g水。
②从图中可以看出温度高于60℃,NaHCO3的溶解度曲线“消失”了,原因是_____。
③结合上述化学反应方程式和物质的溶解度曲线回答,在氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵中,先结晶析出的物质是_____(填物质名称)。
【答案】CO2
NH4Cl50高于60℃时,碳酸氢钠将会分解碳酸氢钠
【解析】
【分析】
【详解】
(1)从流程中可知,氨气和二氧化碳通入饱和的食盐水中生成氯化铵和碳酸氢钠,该反应需要水和二氧化碳做反应物,而步骤Ⅴ中的碳酸氢钠分解生成碳酸钠、水和二氧化碳,故流程中可循环利用的物质有H2O和CO2。
(2)步骤Ⅴ中发生的化学反应是碳酸氢钠分解生成碳酸钠、水和二氧化碳,其化学方程式是:
。
(3)因为氨气和二氧化碳通入饱和的食盐水中生成A和碳酸氢钠,已知A为铵态氮肥,根据化学反应前后元素种类不变,可推断该物质中一定含有氯离子,则A为氯化铵,化学式是:
NH4Cl。
(4)①根据侯氏制碱法制取纯碱过程中部分物质的溶解度曲线,60℃时,氯化铵的溶解度是55.2g,故27.6gNH4Cl完全溶解至少需要50g水。
②因为碳酸氢钠受热易分解,所以图中温度高于60℃时,NaHCO3的溶解度曲线“消失”的原因是:
高于60℃时,碳酸氢钠将会分解。
③从各物质的溶解度曲线中可以发现,在氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵中,图中温度范围内碳酸氢钠的溶解度小于氯化铵,故先结晶析出的物质是:
碳酸氢钠。
【点睛】
本题的难点之一是:
温度高于60℃,NaHCO3的溶解度曲线“消失”的原因是什么?
要根据碳酸氢钠受热易分解的性质进行分析。
11.某校化学兴趣小组为检测出某工厂排出的浅蓝色、澄清透明废水中的离子,并加以综合处理。
取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成;过滤,并将滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,只产生蓝色沉淀。
请回答。
(1)废水中一定含有的物质是________(选填编号)。
A、氯化物
B、硫酸盐
C、硝酸盐
D、碳酸盐
(2)该小组设计了从该废水中除去有毒离子的实验方案(如下图所示)。
(已知:
经实验测得废水样品的质量等于溶液B的质量,溶液C中仅含一种溶质;金属钡比金属钙活泼。
)
①写出符合题意的固体A的组成_________________(写化学式)。
②溶液B中的一定含有的溶质阳离子__________(写离子符号)。
【答案】CAg、Cu、ZnBa2+、Zn2+
【解析】
【分析】
(1)取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成,说明溶液中含有Ag+;过滤,并将滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成,说明溶液中含有Ba2+;另一份滤液中加入氢氧化钠溶液,只产生蓝色沉淀,说明溶液中含有Cu2+。
即溶液中的阳离子有:
Ag+、Ba2+、Cu2+。
(2)金属钡比金属钙活泼,说明加入的金属只能置换Ag+、Cu2+;废水样品的质量等于溶液B的质量,Ag的相对原子质量是108,Cu的相对原子质量是64,说明能和银铜反应的金属的相对原子质量在108~64之间,则利用金属活动性顺序表找到Zn合适,相对原子质量65;锌和硝酸银反应使溶液的质量减小,锌和硝酸铜反应使溶液的质量增大,这样才会使溶液的质量不变。
所以