药物临床试验质控表 泰州人民医院.docx
《药物临床试验质控表 泰州人民医院.docx》由会员分享,可在线阅读,更多相关《药物临床试验质控表 泰州人民医院.docx(11页珍藏版)》请在冰豆网上搜索。
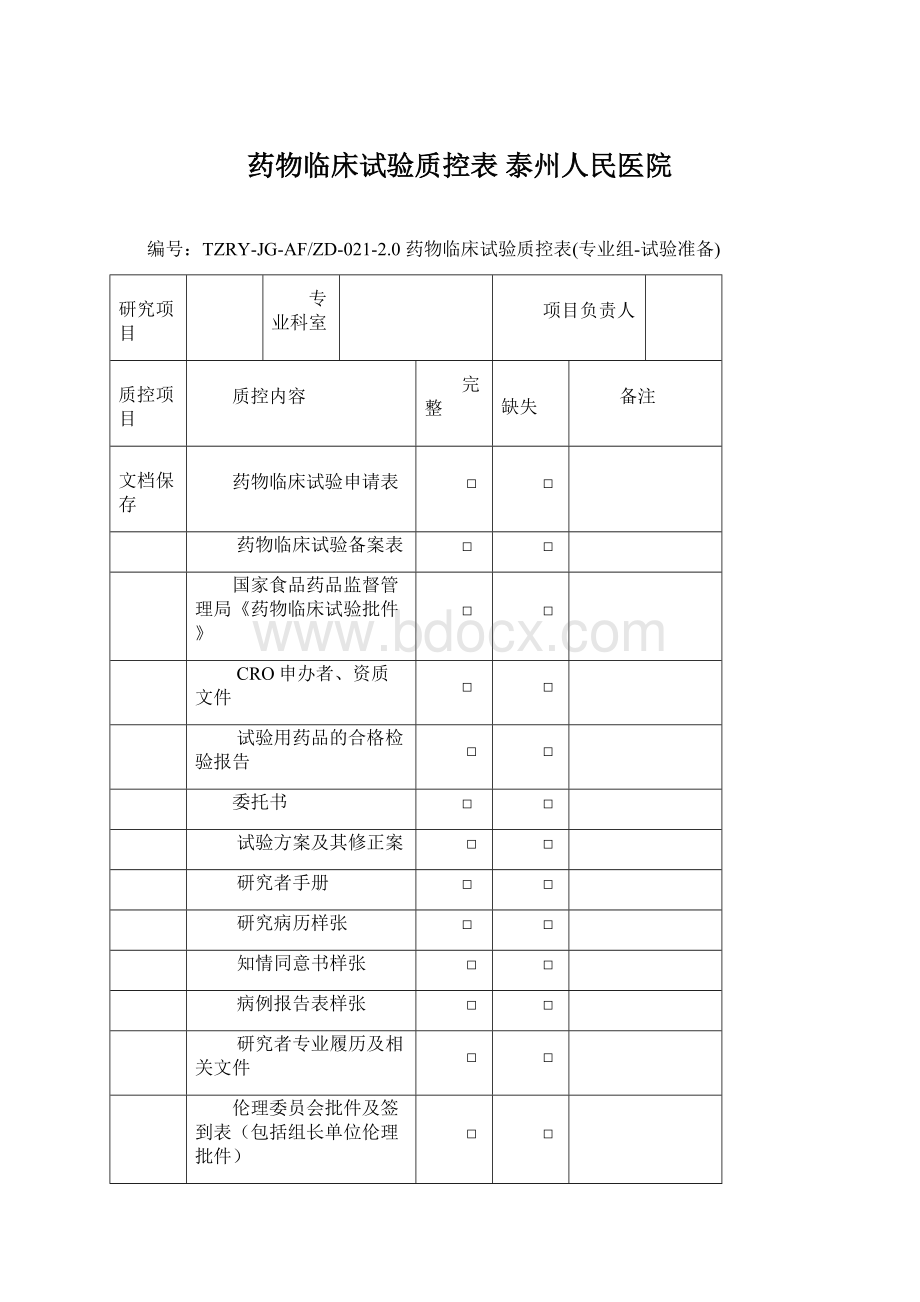
药物临床试验质控表泰州人民医院
编号:
TZRY-JG-AF/ZD-021-2.0药物临床试验质控表(专业组-试验准备)
研究项目
专业科室
项目负责人
质控项目
质控内容
完整
缺失
备注
文档保存
药物临床试验申请表
□
□
药物临床试验备案表
□
□
国家食品药品监督管理局《药物临床试验批件》
□
□
CRO申办者、资质文件
□
□
试验用药品的合格检验报告
□
□
委托书
□
□
试验方案及其修正案
□
□
研究者手册
□
□
研究病历样张
□
□
知情同意书样张
□
□
病例报告表样张
□
□
研究者专业履历及相关文件
□
□
伦理委员会批件及签到表(包括组长单位伦理批件)
□
□
临床试验协议书
□
□
临床试验有关的实验室检测正常值范围.
□
□
医学或实验室操作的质控证明
□
□
试验准备
启动会培训记录(签到表、课件或讲义等)
□
□
SOPs试验相关
□
□
药物临床试验研究成员责任/分工及签名表
□
□
其他试验相关表单准备
□
□
药品与物品准备
试验用药品接收记录
□
□
试验用物资接收记录
□
□
应急信件
□
□
试验用药品或物品保存温湿度记录
□
□
试验用药品表单
□
□
专业组质量监督员意见
(签名及日期)
整改情况
项目负责人(签名及日期).
整改评价
专业组质量监督员(签名及日期)
注:
本表为项目准备阶段质控表,请在对应的□内打×,填否的项目均需说明,内容过多请附纸详述。
编号:
TZRY-JG-AF/ZD-022-2.0
药物临床试验质控表(专业组-第一例受试者筛选期)
研究项目
专业科室
项目负责人
受试者姓名或缩写
住院号或ID
门诊
筛选号
质控项目
质控内容
是
否
说明
筛选期
是否签署知情同意书
□
□
知情同意书是否为受试者本人签字
□
□
知情同意书上受试者是否留有地址或电话号码
□
□
知情同意书上研究者是否留有地址或电话号码
□
□
研究者签字日期是否与受试者签字日期相符
□
□
是否交给受试者一份知情同意书副本
□
□
是否在签署知情同意书后进行筛选检查
□
□
筛选是否合格
□
□
是否符合入组标准
□
□
是否不符合排除标准
□
□
是否填写筛选/入选表
□
□
筛选过程是否在原始记录中体现
□
□
专业组质量监督员意见(签名及日期).
整改情况
研究者(签名及日期)
项目负责人(签名及日期)
整改评价
专业组质量监督员(签名及日期)
注:
本表须在受试者入组前完成质控,请在对应的□内打×,填否的项目均需说明,内容过多请附纸详述。
编号:
TZRY-JG-AF/ZD-023-2.0
药物临床试验质控表(专业组-第一例受试者入组后)
研究项目
专业科室
项目负责人
受试者编号、姓名或缩写
住院号或ID门诊
筛选号
质控项目
质控内容
是
否
说明
方案执行
是否遵循随机原则
□
□
是否根据方案要求的剂量、方法、时间给药
□
□
是否按照方案要求的项目进行检查、检验
□
□
是否按照方案要求的时间进行检查、检验
□
□
是否按方案要求进行随访
□
□
合并用药是否为方案允许
□
□
受试者未脱落
□
□
临床试验方案是否是最新版本
□
□
知情同意书是否是最新版本
□
□
数据溯源
是否填写受试者鉴认代码表
□.
□
是否在原始记录上体现入组过程
□
□
是否在原始记录上体现给药记录
□
□
原始记录上检查、检验结果没有遗漏
□
□
原始记录上检查、检验阳性结果是否有分析
□
□
填写是否及时、准确、完整、规范、真CRF实
□
□
CRF的记录是否可溯源
□
□
CRF上合并用药记录是否完整
□
□
AE/SAE
用药后是否有临床意义的异常检验值
□
□
有临床意义的异常检验值是否随访(如有)
□
□
是否记录(如有)AE/SAE有
□
□
是否及时救治、处理及报告(如有)SAE
□
□
专业组质量监督员意见(签名及日期)
整改情况
研究者(签名及日期).
项目负责人(签名及日期)
整改评价
专业组质量监督员(签名及日期)
项外,填否的项目均需说明,内容过多请附纸详述。
AE/SAE注:
本表须在受试者入组后完成质控,请在对应的□内打×,除.
编号:
TZRY-JG-AF/ZD-024-2.0
药物临床试验质控表(专业组-第一例受试者研究结束)
研究项目
专业科室
项目负责人
受试者编号、姓名或缩写
住院号或ID
门诊
筛选号
质控项目
质控内容
是
否
说明
试验结束
受试者是否已完成临床试验全部随访
□
□
受试者的任何原因的脱落已记录在案(如有)
□
□
临床试验过程未违背试验方案
□
□
原始资料记录是否及时、准确、完整、规范、真实
□
□
CRF填写是否及时、准确、完整、规范
□
□
CRF填写数据是否可溯源
□
□
是否按要求处理、记录及上报(如AE/SAE有)
□
□
检查或检验值异常是否已随访结束(如有)
□
□
合并用药是否均已记录
□
□
剩余试验用药品是否回收
□
□
剩余量是否等于分发试验用药品的使用量、量
□
□
既往质控、督察及监查意见是否整改到位
□
□
专业组质量监督员意见(签名及日期)
整改情况
研究者(签名及日期)
项目负责人(签名及日期)
整改评价
专业组质量监督员(签名及日期)
日内完成质控,请在对应的□内打×,填否的项目均需说明,内容过多请附纸详述。
3注:
本表须在受试者末次随访结束
TZRY-JG-AF/ZD-025-2.0
编号:
药物临床试验质控表(专业组-抽查表)
研究项目
专业科室
项目负责人
受试者编号、姓名或缩写
住院号或ID门诊
筛选号
质控项目
质控内容
是
否
说明
筛选过程
是否签署知情同意书
□
□
知情同意书是否为受试者本人签字
□
□
知情同意书上受试者是否留有地址或电话号码
□
□
知情同意书上研究者是否留有地址或电话号码
□
□
研究者签字日期是否与受试者签字日期相符
□
□
是否交给受试者一份知情同意书副本
□
□
是否在签署知情同意书后进行筛选检查
□
□
筛选是否合格
□
□
是否符合入组标准
□
□
是否不符合排除标准
□
□
/是否填写筛选入选表
□
□
筛选过程是否在原始记录中体现
□
□
数据填写
是否填写受试者鉴认代码表
□
□
是否在原始记录上体现入组过程
□
□
是否在原始记录上体现给药记录
□
□
原始记录上检查、检验结果没有遗漏
□
□
原始记录上检查、检验阳性结果是否有分析
□
□
填写是否及时、准确、完整、规范、真CRF实
□
□
CRF的记录是否可溯源
□
□
上合并用药记录是否完整CRF
□
□
用药后是否有临床意义的异常检验值
□
□
有临床意义的异常检验值是否随访(如有)
□
□
合并用药是否均已记录
□
□
是否记录(如有)AE/SAE有
□
□
是否及时救治、处理及报告(如有)SAE.
□
□
方案执行
是否遵循随机原则
□
□
是否根据方案要求的剂量、方法、时间给药
□
□
是否按照方案要求的项目进行检查、检验
□
□
是否按照方案要求的时间进行检查、检验
□
□
是否按方案要求进行随访
□
□
合并用药是否为方案允许
□
□
受试者未脱落
□
□
临床试验方案是否是最新版本
□
□
知情同意书是否是最新版本
□
□
试验用药品的使用
剩余试验用药品是否回收
□
□
试验用药品的使用量、剩余量是否等于分发量
□
□
专业组质量监督员意见(签名及日期)
整改情况
研究者(签名及日期)
项目负责人(签名及日期)
整改评价
专业组质量监督员(签名及日期)
纸详述。
填否的项目均需说明,内容过多请附注:
本表须在对完成病例进行抽查时填写,请在对应的□内打×,