高三一轮复习第二章氧化还原反应24.docx
《高三一轮复习第二章氧化还原反应24.docx》由会员分享,可在线阅读,更多相关《高三一轮复习第二章氧化还原反应24.docx(12页珍藏版)》请在冰豆网上搜索。
高三一轮复习第二章氧化还原反应24
一、选择题
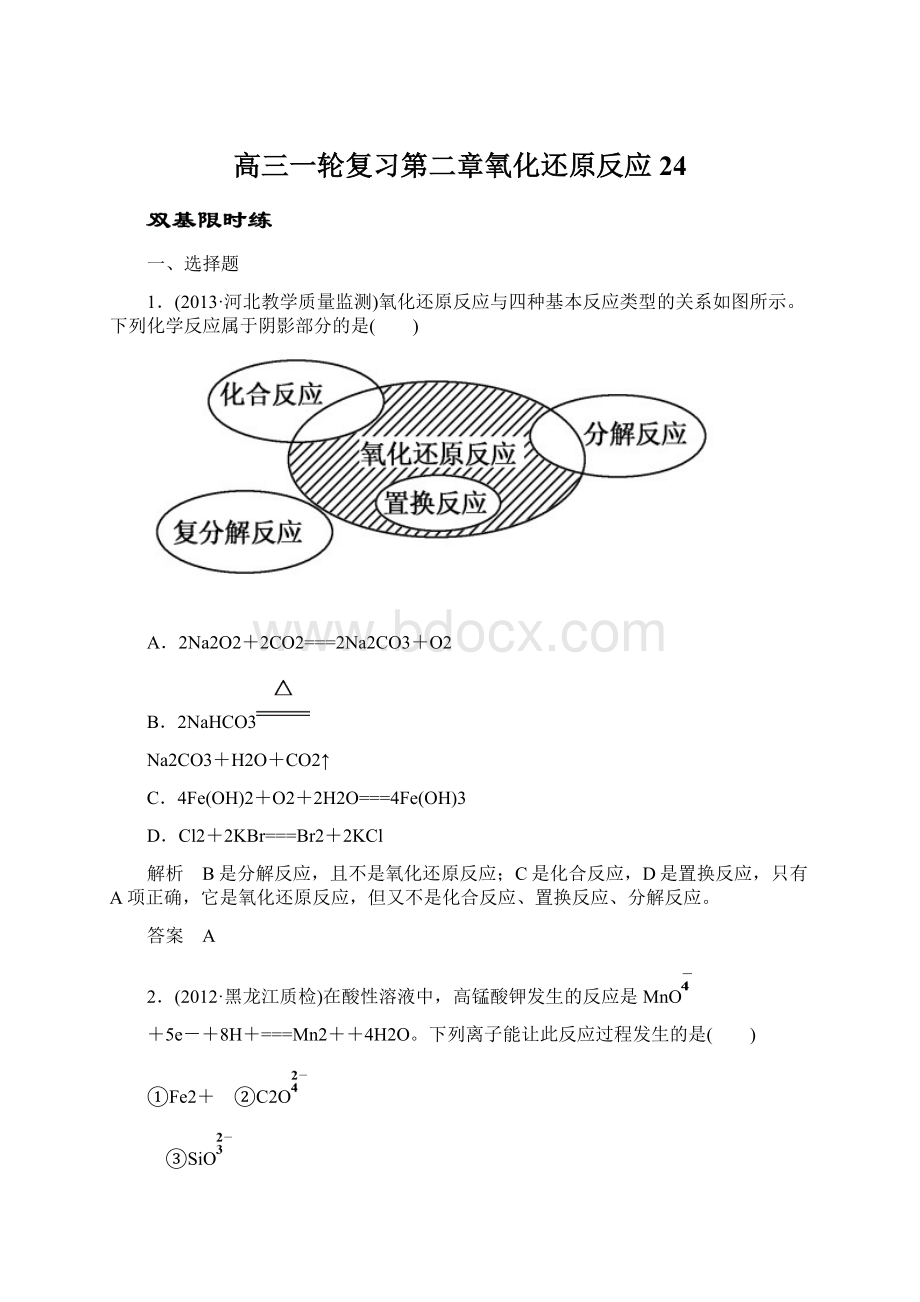
1.(2013·河北教学质量监测)氧化还原反应与四种基本反应类型的关系如图所示。
下列化学反应属于阴影部分的是( )
A.2Na2O2+2CO2===2Na2CO3+O2
B.2NaHCO3
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.Cl2+2KBr===Br2+2KCl
解析 B是分解反应,且不是氧化还原反应;C是化合反应,D是置换反应,只有A项正确,它是氧化还原反应,但又不是化合反应、置换反应、分解反应。
答案 A
2.(2012·黑龙江质检)在酸性溶液中,高锰酸钾发生的反应是MnO
+5e-+8H+===Mn2++4H2O。
下列离子能让此反应过程发生的是( )
①Fe2+ ②C2O
③SiO
④IO
A.①②B.①③
C.②③D.③④
解析 Fe2+和C2O
都具有还原性,都能被酸性KMnO4氧化。
答案 A
3.(2012·河南调研)下列叙述正确的是( )
A.发生化学反应时失去电子数越多的金属原子,其还原能力越强
B.工业制备Si、Fe没有发生氧化还原反应
C.铝热反应常被用于野外焊接钢轨,说明铝的氧化性很强
D.某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀产生,说明溶液中有SO
解析 A中,金属原子的还原能力只与失电子的难易程度有关,而与失电子数目的多少无关;B中,工业制备Si、Fe均发生了氧化还原反应;C中,铝热反应说明铝的还原性很强。
答案 D
4.(2012·江西九校联考)MnO2的一些性质或用途如图,下列说法正确的是( )
A.①、②、③三个反应中MnO2均作氧化剂
B.足量MnO2与2L10mol/LHCl共热,可生成5molCl2
C.反应②若生成1molAl2O3,则反应过程中转移12mol电子
D.反应③中K2CO3和KNO3的化学计量数均为1
解析 反应③中二氧化锰作还原剂,A项错;足量MnO2与2L10mol/LHCl共热,随着反应的进行浓盐酸变为稀盐酸,反应不再进行,所以生成的氯气小于5mol,B项错;反应②若生成1molAl2O3,则反应过程中转移6mol电子,C项错;反应③:
MnO2+KNO3+K2CO3===K2MnO4+KNO2+CO2↑,D项正确。
答案 D
5.(2012·上海13校第二次联考)氰氨基化钙(CaCN2)是一种重要的化工原料,制备CaCN2的化学方程式为CaCO3+2HCN===CaCN2+CO↑+H2↑+CO2↑。
在该反应中( )
A.氢元素被氧化,碳元素被还原
B.HCN仅作氧化剂
C.CaCN2是氧化产物,H2为还原产物
D.CO为氧化产物,H2为还原产物
解析 本题可用排除法。
分析HCN中各元素化合价,氢元素化合价降低,被还原,A项错误;从氢的化合价降低的角度分析,HCN为氧化剂,而很明显CaCO3在反应中没有化合价变化,既不作氧化剂也不作还原剂,则HCN又作还原剂,故B项错误;HCN中碳元素与CO中碳元素化合价均为+2价,故D项错误。
只有C项正确。
答案 C
6.(2012·山东莱州一中三检)钯的化合物氯化钯可用来检测有毒气体CO,常温下发生反应的化学方程式为:
CO+PdCl2+H2O===CO2+Pd↓+2HCl下列说法正确的是( )
A.氧化性:
PdCl2>CO2
B.反应中PdCl2被氧化
C.生成22.4LCO2时,转移的电子为2mol
D.CO气体只有在高温下才能表现还原性
解析 反应中CO被氧化为CO2,而PdCl2被还原为单质Pd,故A对,B、D项错;C项忽视了气体所处的条件不一定是标准状况,错误。
答案 A
7.(2012·陕西五校第二次模拟联考)在pH=1的某溶液中,可能存在NO
、I-、Fe3+中的一种或两种,向该溶液中滴入溴水,单质Br2被还原,由此推断该溶液里,上述三种离子中一定存在的离子为( )
A.NO
、Fe3+B.只有NO
C.I-、Fe3+D.只有I-
解析 “单质Br2被还原”说明溶液中一定存在I-,则NO
、Fe3+都不存在,原因是Fe3+具有强氧化性,能氧化I-,NO
在酸性条件下也能氧化I-。
答案 D
8.(2012·上海13校第二次联考)下列物质在酸性条件下氧化KI,自身发生如下变化:
Fe3+→Fe2+;MnO
→Mn2+;Cl2→2Cl-;HNO3→NO;如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.Fe3+B.MnO
C.Cl2D.HNO3
解析 1mol上述氧化剂发生相应转化可接受的电子的物质的量分别为:
1mol、5mol、2mol、3mol,根据电子守恒,用等物质的量的上述物质分别氧化足量的KI,得到I2的物质的量比为1:
5:
2:
3。
答案 B
9.(2012·北京昌平二模)已知:
①向KMnO4晶体中滴加浓盐酸,产生某黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液为黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断中正确的是( )
A.①中产生气体的电子式是ClCl
B.上述实验中,共有两个氧化还原反应
C.实验②中FeCl2被氧化
D.实验③发生的是同主族元素单质间的置换反应
解析 A项,①中产生的气体是氯气,氯气的电子式为:
:
:
,B项,上述实验中,①、②、③发生的反应都是氧化还原反应;C项,实验②中,FeCl2被氧化生成FeCl3而使溶液显黄色;D项,实验③中,Fe3+把I-氧化成I2而使试纸变为蓝色。
答案 C
10.(2012·北京东城二模)根据表中信息判断,下列选项不正确的是( )
序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4……
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO
……
Cl2、Mn2+……
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1:
2
C.第③组反应中生成1molCl2,转移电子2mol
D.氧化性由强到弱顺序为MnO
>Cl2>Fe3+>Br2
解析 本题考查氧化还原反应的相关知识。
A项,MnSO4是还原产物,H2O2是还原剂,氧化产物是O2,依据原子守恒可知,产物中还应有水,正确;B项,Fe2+的还原性强于Br-,Cl2与FeBr2的物质的量之比为12时,1molCl2恰好氧化2molFe2+,Br-不被氧化,产物为FeCl3、FeBr3,正确;C项,MnO
得电子,Cl2是氧化产物,只有Cl-失电子,生成1molCl2时转移2mol电子,正确;D项,氧化产物的氧化性弱于氧化剂的氧化性,故氧化性:
MnO
>Cl2>
Br2>Fe3+(还原性Fe2+强于Br-,故氧化性Br2>Fe3+),不正确。
答案 D
二、填空题
11.化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。
某学生按下列操作做一个实验:
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。
(已知2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O)
(1)e处反应的离子方程式为________________________。
该反应中氧化剂和还原剂的物质的量之比为________。
(2)b处的实验现象:
_________。
d处的实验现象:
_________。
(3)c处反应的化学方程式为__________________________。
标准状况下,当有0.224LCl2被NaOH溶液吸收后,转移电子的物质的量为________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是______________________________________________。
解析
(1)根据e处发生反应的化学方程式判断反应中的氧化剂为KMnO4,还原剂为HCl,其中氧化剂和还原剂的物质的量之比为2:
10=1:
5,而不是1:
8。
(2)b处发生反应为:
2KI+Cl2===2KCl+I2,I2遇淀粉显蓝色;d处发生的反应为:
2FeCl2+Cl2===2FeCl3,Fe3+和SCN-反应使溶液变红色。
(3)Cl2与NaOH溶液反应的化学方程式:
被吸收时,转移0.01mol电子。
(4)e处实验说明氧化性KMnO4>Cl2。
d处实验说明氧化性Cl2>FeCl3。
因此,三种物质氧化性强弱顺序为:
KMnO4>Cl2>FeCl3。
答案
(1)2MnO
+16H++10Cl-===2Mn2++5Cl2↑+8H2O
1:
5
(2)溶液由无色变为蓝色 溶液由浅绿色变为红色
(3)Cl2+2NaOH===NaCl+NaClO+H2O 0.01
(4)能 KMnO4>Cl2>FeCl3
12.(2012·浙江杭州师大附中模拟)已知溶液中:
还原性HSO
>I-,氧化性IO
>I2>SO
。
在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
(1)写出a点反应的离子方程式__________________;反应中还原剂是__________;被还原的元素是__________(写名称)。
(2)写出b点到c点反应的离子方程式________________________
____________________________________________________________________________________________________________________。
(3)当溶液中的I-为0.4mol时,加入的KIO3为___________mol。
(4)若往100mL1mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为______________________________________
_________________________________________________________。
解析 由题意氧化性IO
>I2>SO
,NaHSO3溶液中逐滴加入KIO3溶液时,首先发生反应3HSO
+IO
===3SO
+I-+3H+;当HSO
消耗完时(b点以后),发生的是IO
和I-的归中反应5I-+IO
+6H+===3I2+3H2O。
(3)当溶液中的I-为0.4mol时,有两种情况:
①b点之前,由第一个方程式知,加入的KIO3物质的量就等于生成的I-的物质的量,等于0.4mol;②b点之后,第一步生成的I-部分被氧化,根据两个方程式计算。
(4)若往100mL1mol·L-1的KIO3溶液中滴加NaHSO3溶液,此时KIO3是过量的,只有I2生成。
答案
(1)3HSO
+IO
===3SO
+I-+3H+ NaHSO3
碘元素
(2)5I-+IO
+6H+===3I2+2H2O
(3)0.4或1.12
(4)2IO
+5HSO
===I2+5SO
+3H++H2O
13.(2012·南昌模拟)氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程离子方程式为:
NO
+4H++3e-===NO↑+2H2O。
下列四种物质:
KMnO4,Na2CO3,KI,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生。
(1)被还原的元素是________;还原剂是________。
(2)写出并配平该氧化还原反应方程式:
____________________
____________________________________________________________________________________________________________________。
(3)反应生成0.3molH2O,则转移电子的数目为________个。
(4)若反应后,氧化产物的化合价升高,而其他物质保持不变,则反应中氧化剂与还原剂物质的量之比将________(填“增大”、“不变”、“减小”或“不能确定”)。
解析
(1)物质甲应该发生氧化反应,在题给四种物质中,能发生氧化反应的只有KI。
被还原的元素为N,还原剂是KI。
(3)反应6KI+8HNO3===6KNO3+2NO↑+3I2+4H2O中转移的电子数为6e-,即每生成4molH2O,转移6mol电子。
因此若生成0.3molH2O,转移0.45mol电子。
(4)若反应后氧化产物的化合价升高,则需氧化剂的物质的量增大,故氧化剂与还原剂的物质的量之比增大。
答案
(1)N KI
(2)6KI+8HNO3===6KNO3+2NO↑+3I2+4H2O
(3)0.45NA
(4)增大
14.(2012·山东四市联考)智能材料是当今材料研究的重要方向之一,由于纳米Fe3O4具有高的比表面、高的比饱和磁化强度和剩磁为零的超顺磁性而被广泛地用作磁流体的磁性粒子。
水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O
+O2+4OH-===Fe3O4+S4O
+2H2O,回答下列问题。
(1)该反应中的还原剂是________,当有1molFe2+被氧化时,被Fe2+还原的O2的物质的量为________。
(2)所制得的水基磁流体在重力场中30天以上无分层和浑浊现象,因为它是一个________体系。
(3)完成上述反应,对Fe2+、S2O
的浓度有严格要求。
①通常用已知浓度的KIO3溶液标定S2O
的浓度:
先让KIO3溶液与过量的酸性KI溶液反应,再以________为指示剂来滴定。
准确量取含S2O
的溶液应选用________(填“酸式”或“碱式”)滴定管,原因是______________________________(用离子方程式表示)。
②Fe2+的浓度用标准的K2Cr2O7溶液测定。
配制标准K2Cr2O7溶液除烧杯和玻璃棒外还需要下列仪器中的________(填字母序号)。
A.托盘天平B.容量瓶
C.酸式滴定管D.碱式滴定管
E.量筒F.胶头滴管
若在配制溶液时没有洗涤烧杯和玻璃棒,测得Fe2+的浓度与其真实浓度相比________(填“偏高”、“偏低”或“无影响”)。
解析
(1)由反应方程式知,铁元素和硫元素的化合价升高,被氧化,所以Fe2+、S2O
作还原剂;1molFe2+被氧化时转移1mol电子,1mol氧气被还原时,转移4mol电子,由得失电子守恒知1molFe2+可还原0.25mol氧气。
(2)制得的水基磁流体是胶体,不会出现分层和浑浊。
(3)S2O
水解使溶液显碱性,应用碱式滴定管量取含S2O
的溶液;配制溶液时没有洗涤烧杯和玻璃棒,则会使所配溶液的浓度偏低,导致测定的Fe2+浓度偏高。
答案
(1)Fe2+、S2O
0.25mol
(2)胶体
(3)①淀粉 碱式 S2O
+H2OHS2O
+OH- ②ABF,偏高