有机计算题及解析.docx
《有机计算题及解析.docx》由会员分享,可在线阅读,更多相关《有机计算题及解析.docx(13页珍藏版)》请在冰豆网上搜索。
有机计算题及解析
(1)求有机物相对分子质量
根据化学方程式的有关计算求物质的相对分子质量
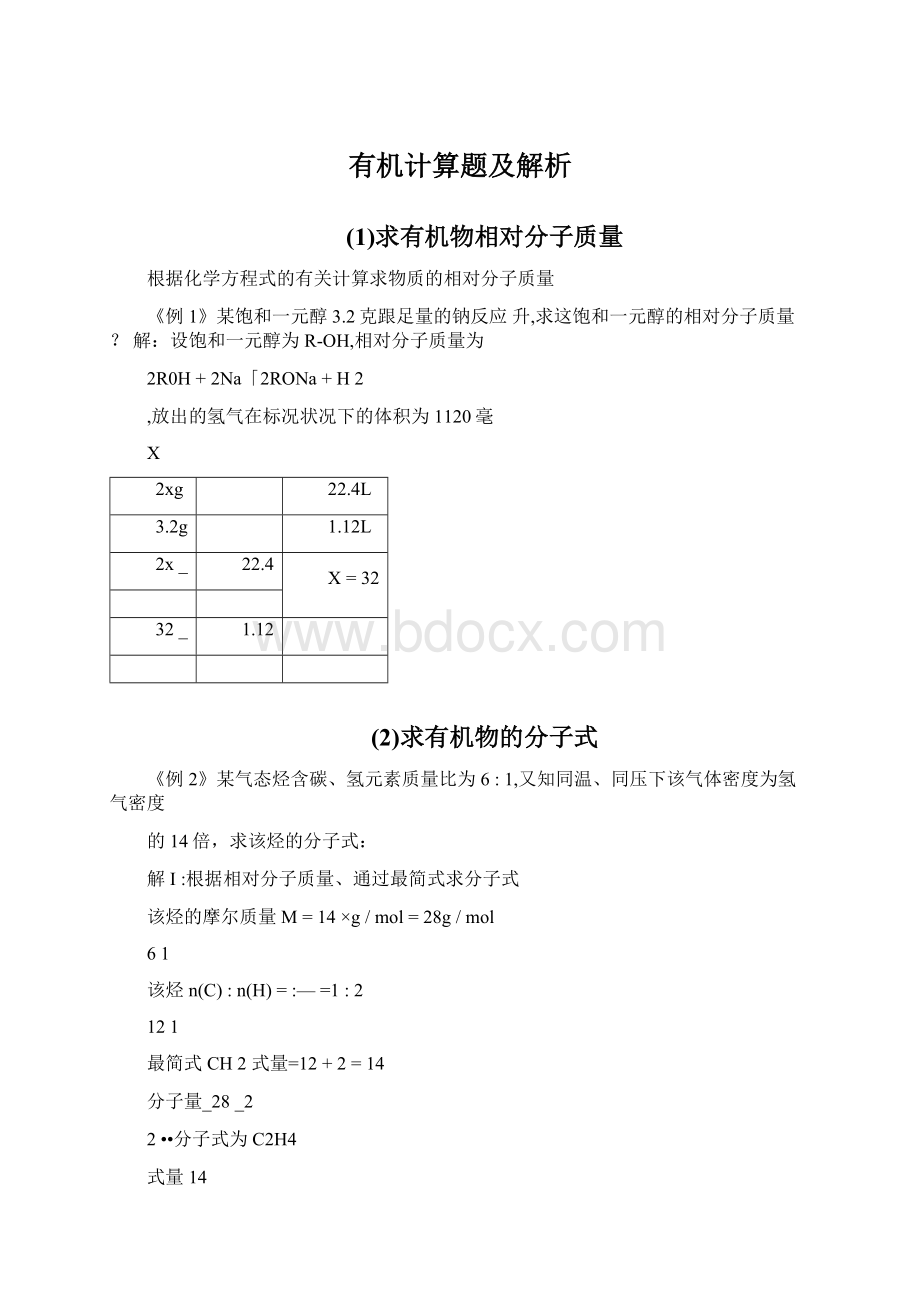
《例1》某饱和一元醇3.2克跟足量的钠反应升,求这饱和一元醇的相对分子质量?
解:
设饱和一元醇为R-OH,相对分子质量为
2R0H+2Na「2RONa+H2
放出的氢气在标况状况下的体积为1120毫
X
2xg
22.4L
3.2g
1.12L
2x_
22.4
X=32
32_
1.12
(2)求有机物的分子式
《例2》某气态烃含碳、氢元素质量比为6:
1,又知同温、同压下该气体密度为氢气密度
的14倍,求该烃的分子式:
解I:
根据相对分子质量、通过最简式求分子式
该烃的摩尔质量M=14×g/mol=28g/mol
61
该烃n(C):
n(H)=:
—=1:
2
121
最简式CH2式量=12+2=14
分子量_28_2
2••分子式为C2H4
式量14
解∏:
根据相对分子质量、通过计算每摩物质所含各元素的原子的“物质的量”求分子式
该烃的摩尔质量M=14×g/mol=28g/mol
1mol28g/mol
1摩该烃分子量n(C)=7=2mol
12g/mol
1
1mol28g/mol
1摩该烃分子量n(H)=7=4mol
1g/mol
•该烃分子式为C2H4
《例3》某气态有机物标准状况下密度为1.34克/升,取1.50克该有机物在足量的氧气中燃烧。
将所得气体通过装有浓H2SO4的洗气瓶后再通过碱石灰干燥管,结果洗气瓶和干燥管分别增重0.9克和2.2克,测得尾气中除氧气外无其它物质,求该有机物的分子式?
解I:
根据有机物燃烧化学方程式(通式)求分子式
摩尔质量M=1.34g/L22×L/mol=30g/mol
y
302
1.5一0.05
-H2O2
解∏:
根据反应关系式求分子式
12g44g
2H〜H20
0.9g
218
y~0.9
y=0.1g
0.2
2g
18g
《例4》某气态不饱和烃在标准状况下的密度为2.41克/升。
取0.54克该烃恰与浓度为
摩/升的溴水100毫升完全反应,使溴水完全褪色。
求该烃的分子式、结构简式及名称?
根据有机物分子式通式求有机物分子式
解:
摩尔质量M=2.41g/L22.4L/mol=54g/mol
n(CXHy)=54gτmoιe°1m°ln(Br2)=0.2mol/L0.1×=0.02mol
n(CχHy)0.0lmol_1n(Br2)0.02mol2
•••该烃为炔烃或二烯烃
依据C∏H2∏-2通式12n+2n—2=54n=4
•分子式为C4H6
结构简式L-√=L..■■名称:
1—丁炔
I--,--名称:
2—丁炔
《例5》标准状况下10毫升某气态烷烃跟80毫升过量的氧气混合,通入一个容积为90毫
升的密闭容器中点火爆炸后,恢复到原状态,测得的压强为原来的55.56%。
求烷烃的分子
式?
解I:
利用燃烧化学方程式计算
沁02
2
•烷烃的分子式为
C5H12
解∏:
根据反应前后压强变化
3∏1
O2
2
CnH2n2
通过差量法求有机物分子式
—点燃_nco2(n1)H2O(液态)
•:
n减少
1mol
3n1
-^--n(mol)
10
40
n=5
.∙.烷烃分子式为C5H12
《例6》某有机物由C、H、O三种元素组成,分子中含有8个原子。
1摩该有机物含有46摩质子,完全燃烧该有机物在相同条件下测定CO2和水蒸气体积比为2:
1。
取2.7克该有
机物恰好与1摩/升的碳酸钠溶液30毫升完全反应,求
(1)有机物分子式?
(2)有机物结构简式?
利用解联立方程组法求有机物分子式
解:
设有机物分子式
CXHyOz
根据题意Vc°2
2
n(C)
1
VH2O
1
n(H)
1
X+y+z=8
X=2
-■
6x+y+8z=46
y=2
分子式C2H2O4
√χ=y
2.7
z=4
n(C2H2。
4)
90
_0.03
_1
n(Na2CO3)
1=<0.03
0.03
1
OO
IlIl
•有机物为二元羧酸
结构简式
HO-C-C-OH
(3)有机物燃烧问题
《例7》一定量的甲烷不完全燃烧,生成由CO、CO2和H2O(气)组成的混合气体49.6
克,将混合气体缓慢通过无水CaC∣2并作用完全、CaC∣2质量增加25.2克,计算混合气中
CO、CO2和H2O(气)的物质的量?
若将此甲烷完全燃烧还缺少标准状况下多少升氧气?
解I:
常规方法,通过联立方程组法解题:
由题意得知m(H2O)=25.2g二n(H2O)25'2g1.4mol
18g/mol
m(CO)+m(CO2)=49.6g—25.2g=24.4g
•••关系式CH4〜2H2O
0.7mol1.4mol
.∙.n(CO)+n(CO2)=0.7mol
设:
生成Co的物质的量为X、生成C02物质的量为y。
设:
此甲烷完全燃烧还需标况下氧气体积为Z
点燃
2C0O22CO2
∙m(CO)+m(CO2)=49.6g—25.2g=24.4g
1mol2mol
0.7mol1.4mol
∙n(CO)+n(CO2)=0.7mol
∙CO与CO2混合气平均摩尔质量M=244(g/mol)
0.7mol7
0.4molX
222.4
0.4
X=4.48(L)
4
∙n(CO)=0.7mol=0.4mol
7
3n(CO2)=0.7mol=0.3mol
4
设此甲烷完全燃烧还需标况下氧气体积为X
点燃
2CO+O22CO2
解川:
通过极限法解题
∙m(CO)+m(CO2)=49.6g—25.2g=24.4g
1mol2mol0.7mol1.4mol
∙n(CH4)=0.7mol
∙完全燃烧生成CO2的质量应为0.7mol×44g∕mol=30.8g
与实际燃烧产物质量的差量为30.8—24.4=6.4g
即CO完全燃烧所需O原子的质量
∙n(CO)=0.4mol
n(CO2)=0.3mol
甲烷完全燃烧还需标况下氧气0.2mol
WmolC2H6,
《例8》把MmoIH2和NmoIC2H4混合,在一定条件下使它们一部分发生反应生成将反应后所得的混合气体完全燃烧,消耗氧气的物质的量为多少?
利用守恒法解决可燃物完全燃烧时耗氧量
分析:
反应过程
H3Mmal
—定条件、
C乳Wmal
CiH4Nnlol
J
余F⅛余C2H4成两看均剰余
T
丁
各种元素的原子的物质的重守區
•••不用讨论和计算多少H2、多少C2H4参加了反应及剩余多少H2、C2H4再按混合物各
2mol
Mmol
1mol
Mmol
2
1mol3mol
Nmol3Nmol
∙耗氧量为M'3N(mol)
2
《例9》标准状况下,将1升CH4、2升C2H6的混合气体,向该混合气体通入相同状况下
50升的空气,完全燃烧后,所得气体经干燥恢复到原状态,气体总体积为多少升?
利用差量法解题
解:
Vo2=50L21%=10.5升
CH4~2O2C2H6~7O2
2
1升2升2升7升
2升+7升<10.5升∙∙∙CH4、C2H6适量
占燃
CH4202—占一CO22H2O(液态)•:
V减
(3—1)升=2升
2C2H6+702—竺T4CO2+6H2O(液)心V减少
2升(2+7—4)升=5升
.∙.V气体总=1+2+50—(2+5)=46升答(略)
《例10》平均相对分子质量为30.4的CO、C2H4和。
2混合气体经点燃完全反应后,测知反应后混合气体不再含CO和C2H4。
试推算原混合气体各成分的体积分数?
(确定体积组
成范围)
利用含不等式联立方程组法及平均值法解题。
解:
认真分析混合气组成中各组分的相对分子质量,可以看出
MCO=Mc2h4=28(分子量)
∙平均值法解出Vo2%(体积分数)
㈣掘\/鮎,
(C0λCiH4)28/
1.6
…2
3
∙Vo2%×100%=60%
点燃
∙∙∙2CO+022CO2
21
X
X
2
CO、C2H4共占40%
设混合气总体积为100(L)>
25
占燃
C2H4+302占》2CO2+2H20
13V
y3y
CO气体积为x,C2H4气体积为y。
O:
:
:
Vc2h4%_16%
答:
Vo%为60%24%乞VCo%<40%
(4)有关混合物组成有机计算
《例11》相同状况下9升甲烷与6升某烯烃混合,所得混合气的密度等于相同条件下氧气的密度,求该烯烃的分子式、可能的结构简式?
平均值法解题
∙∙∙CO2气体体积分数不影响混合气平均摩尔质量定答案,它们体积分数必须满足下列关系
丁烷(C4H10)58
\/282
;44—=—
甲烷(CH4)M/\141
因此应由丁烷、甲烷的体积分数确
即VC4HIO=2
VCH41
解:
混合气平均摩尔质量M=MO=32g∕mol
A.1:
2:
5B.5:
2:
1
C.5:
1:
5D.2:
1:
5
答案:
D
解:
混合气平均摩尔质量M=22×2g/mol=44g/mol
■/Mco2-44g/mol
∙D为答案
《例13》两种气态烃组成的混合物(分子中碳原子数<4)20毫升,与过量氧气混合充分燃烧,燃烧所得气体产物通过浓H2SO4时,体积减少了30毫升,剩余气体再通过碱石灰时体积又减少了40毫升(以上气体均在相同状况下测定的),求这两种气态烃的可能组成及体积百分含量?
根据混合物平均分子组成来确定混合物中各成分及体积百分含量
解:
设混合气态烃的平均分子组成为CXHy
>xCO2
点燃--y
H2O
y
CXHy(X4)°2
(2)—种烃的碳原子数为2,则另一种烃的碳原子数也必须为2,碳原子数为2的烃
2
C2H2
C2H4
IOmL
IOmL
I3
C2H220=15mL
4
I1
C2H6-20=5mL
4
《例14》a毫升A、B、C三种气态烃的混合物跟足量氧气混合点燃后,恢复到原常温常压
状态,气体体积共缩小了2a毫升,那么A、B、C三种烃可能是
A.CH4、C