第三章金属及其化合物.docx
《第三章金属及其化合物.docx》由会员分享,可在线阅读,更多相关《第三章金属及其化合物.docx(18页珍藏版)》请在冰豆网上搜索。
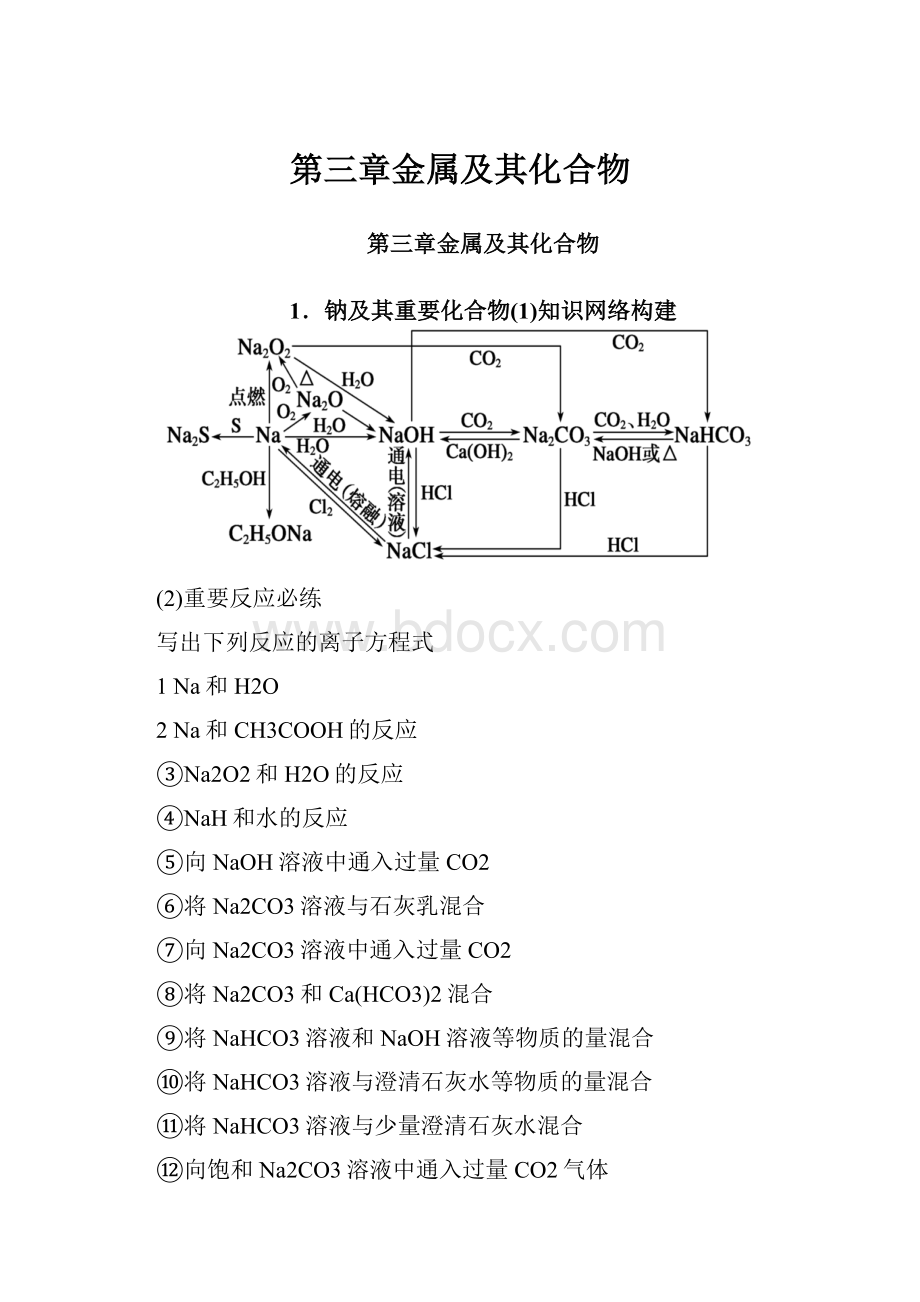
第三章金属及其化合物
第三章金属及其化合物
1.钠及其重要化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的离子方程式
1Na和H2O
2Na和CH3COOH的反应
③Na2O2和H2O的反应
④NaH和水的反应
⑤向NaOH溶液中通入过量CO2
⑥将Na2CO3溶液与石灰乳混合
⑦向Na2CO3溶液中通入过量CO2
⑧将Na2CO3和Ca(HCO3)2混合
⑨将NaHCO3溶液和NaOH溶液等物质的量混合
⑩将NaHCO3溶液与澄清石灰水等物质的量混合
⑪将NaHCO3溶液与少量澄清石灰水混合
⑫向饱和Na2CO3溶液中通入过量CO2气体
2.铝及其重要化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的离子方程式
①Al和NaOH溶液的反应
②Al(OH)3和NaOH溶液的反应
③Al(OH)3和盐酸的反应
④Al2O3和NaOH的反应
⑤Al2O3和盐酸的反应
⑥NaAlO2和过量盐酸的反应
⑦向NaAlO2溶液中通入过量CO2气体
⑧将NaAlO2与NaHCO3混合
⑨将NaAlO2与AlCl3溶液混合
⑩向AlCl3溶液中加入过量NaOH溶液
⑪向AlCl3溶液加入过量氨水
⑫将AlCl3溶液与NaHCO3溶液混合
(3)铝三角
习题1:
向明矾溶液中逐滴加入Ba(OH)2溶液,
(1)当n[KAl(SO4)2]∶n[Ba(OH)2]=2∶3时,铝元素的存在形式是什么?
(2)当n[KAl(SO4)2]∶n[Ba(OH)2]=1∶2时,铝元素的存在形式是什么?
1.在推断题中的注意点
(1)Al与Fe2O3、Fe3O4等发生置换反应(铝热反应)经常出现在推断题中,如一种金属与一种金属的氧化物在高温下反应生成一种金属和氧化物。
(2)Al是中学阶段学习的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属;Al2O3、Al(OH)3也是中学阶段接触的唯一与强碱反应的金属氧化物和金属氢氧化物。
这些知识点在无机推断题中出现的频率特别高。
2.注意铝与酸或碱反应生成H2的量的关系
Al分别与盐酸、氢氧化钠溶液的反应原理:
2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
3.注意酸碱性强弱
与Al反应的碱溶液必须是强碱溶液,如Al不能与氨水反应放出氢气;Al2O3、Al(OH)3能与强酸、强碱反应,但不溶于氨水或CO2的水溶液。
练习:
1、甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL0.1mol·L-1AlCl3溶液,两烧杯中都有沉淀生成。
下列判断正确的是( )
A.甲中沉淀一定比乙中的多
B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少
D.以上说法都不正确
2、甲、乙两烧杯中各盛有100mL3mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A.5.4g B.3.6g
C.2.7g D.1.8g
1.实验原理
方案一 用铝盐(Al3+)制取Al(OH)3
加入氨水至沉淀完全,一般不用NaOH等强碱。
Al3++3NH3·H2O===Al(OH)3↓+3NH
方案二 用铝屑、烧碱、稀H2SO4制取Al(OH)3
方法一:
Al
Al3+
Al(OH)3;
方法二:
Al
AlO
Al(OH)3;
方法三:
Al(OH)3。
每制取1molAl(OH)3,方法一耗H+和OH-各3mol;方法二耗H+和OH-各1mol;方法三耗H+和OH-各
mol。
故方法三最节省原料。
2.实验步骤(以方案一为例)
在试管里加入10mL0.5mol·L-1的Al2(SO4)3溶液,滴加氨水,生成白色沉淀,继续滴加氨水,直至不再产生沉淀为止。
过滤,用蒸馏水洗涤沉淀,可得到较纯净的Al(OH)3。
3.注意事项
(1)氢氧化铝易溶于强碱而不溶于氨水,因此实验室制备氢氧化铝时一般不用氢氧化钠等强碱代替氨水,以免强碱过量时氢氧化铝溶解,或强碱不足时铝离子未完全沉淀。
(2)洗涤氢氧化铝沉淀,其目的是洗去氢氧化铝表面附着的硫酸铵等杂质。
(3)洗涤的方法是:
向盛有氢氧化铝沉淀的过滤器中倒入适量蒸馏水至刚好浸没沉淀,等水自然流出后,再重复操作2~3次。
3、实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种实验方案,
方案①
Al→Al3+→Al(OH)3
方案②
Al→AlO
→Al(OH)3
方案③
→Al(OH)3
(1)用方案①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,不用氢氧化钠代替氨水的原因是_______________;
写出该方案中有关的离子方程式_________________。
(2)用方案②来制备Al(OH)3时,必须注意________的用量,以防止生成的Al(OH)3溶解。
(3)三种方案中,你认为最好的是________(填序号),原因是__________________________。
【答案】
(1)若用NaOH溶液沉淀Al3+,终点不易控制,因为Al(OH)3会溶于过量的NaOH溶液,从而影响Al(OH)3的生成量 2Al+6H+===2Al3++3H2↑,
Al3++3NH3·H2O===Al(OH)3↓+3NH
(2)稀硫酸
(3)③ 药品用量最少,操作最为简单
4、(双选)某无色溶液加入铝可以生成H2,则在该溶液中一定不可能大量共存的离子组是( )
A.K+、Cu2+、NO
、Cl-
B.Na+、K+、SO
、NO
C.NH
、K+、HCO
、Cl-
D.Na+、Ba2+、Br-、Cl-
某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是( )
A.H+、Ba2+、Mg2+、Cl-B.Cl-、CO
、Cu2+、Mg2+
C.NO
、SO
、K+、H+D.NO
、OH-、Fe2+、Cl-
数形思想在图像解题中的应用
一、反映Al3+、Al(OH)3、AlO
之间转化的有关图像
1.往AlCl3溶液中逐滴加入NaOH溶液至过量(见下图)
2.往NaOH溶液中逐滴加入AlCl3溶液至过量(见下图)
3.往NaAlO2溶液中逐滴加入HCl溶液至过量(见下图)
4.往盐酸中逐滴加入NaAlO2溶液至过量(见下图)
5.往等物质的量的AlCl3、MgCl2混合溶液中加入NaOH溶液至过量(见下图)
5、向20mL某物质的量浓度的AlCl3溶液中滴入2mol·L-1NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
(1)图中A点表示的意义是_________________________。
(2)图中B点表示的意义是__________________________。
(3)上述两步用总的离子方程式可表示为:
____________。
(4)假定反应混合物中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为________。
【答案】
(1)表示滴入15mLNaOH溶液时AlCl3完全能转化为Al(OH)3沉淀的质量为0.78g
(2)表示滴入20mLNaOH溶液生成的Al(OH)3沉淀完全溶解
(3)Al3++4OH-===AlO
+2H2O (4)17.5mL或7.5mL
6.(2012年安徽理综)已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。
向浓度均为0.1mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。
下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是
( )
7.(2012年山东理综)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)如下图所示,请指出过滤操作中的一处错误________。
(3)判断流程中沉淀是否洗净所用的试剂是________。
高温焙烧时,用于盛放固体的仪器名称是________。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是____________________。
F中试剂的作用是______________________,用一件仪器填装适当试剂后也可起到F和G的作用,所装填的试剂为________。
答案:
(1)B
(2)漏斗末端没有紧靠烧杯内壁(或没有使用玻璃棒引流等) (3)氨水 坩埚 (4)除去氯气中HCl 防止水蒸气进入E 碱石灰
3.铁及其重要化合物
用化学方程式或离子方程式表示下列变化
(1)铁的氧化物
化学式
FeO
Fe2O3
Fe3O4
俗名
颜色状态
溶解性
铁的化合价
稳定性
与H+反应的离子方程式
(2)铁的氢氧化物
化学式
Fe(OH)2
Fe(OH)3
色态
与盐酸反应
受热分解
制法
二者的关系
(3)+2、+3价铁的化学性质
1.Fe2+的氧化性和还原性
Fe2+处于铁的中间价态,既有氧化性,又有还原性。
在中学阶段接触Fe2+的氧化还原反应中其主要表现,如:
Fe2+遇Br2、Cl2、H2O2、NO3-(H+)等均表现。
2.Fe3+的氧化性
Fe3+处于铁的高价态,表现较强的,如:
它能Fe、Cu、HI、H2S等。
3.Fe2+与Fe3+的相互转化
用离子方程式实现下列转化
:
①;
②
--
④。
1.下列试剂中,不能使Fe2+转化为Fe3+的是( )
①氯气 ②NaCl溶液 ③KMnO4溶液 ④稀硝酸 ⑤盐酸 ⑥NaNO3溶液
A.①②③B.①③④
C.②④⑤D.②⑤⑥
2.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是(双选)( )
A.硫酸B.氯水C.硝酸锌D.氯化铜
3.在含有Fe3+、Fe2+、Al3+、NH
的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+B.Al3+
C.Fe2+、NH
D.Fe3+
4.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列物质中的( )A.锌粉B.镁粉C.铁粉D.铝粉5.如何除去括号中的杂质
(1)Fe2+(Fe3+):
;
(2)FeCl3(FeCl2):
;(3)FeCl2(CuCl2):
;(4)Fe(Al):
(5)Fe2O3(Al2O3、SiO2):
。
6.要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③B.③②
C.③①D.①②③
7.下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈血红色,说明
不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶
液变血红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,
说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg
题组一 实验探究——Fe(OH)2的制备
1.用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入___________________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是_____________________________________。
【解析】 Fe2+易水解,要加入稀H2SO4防止其水解;Fe2+易被空气中的O2氧化,要加铁粉,将被氧化生成的Fe3+还原成Fe2+。
气体的溶解度是随温度升高而降低的,所以煮沸后的蒸馏水中溶解的O2减少。
优点:
装置简单。
缺点:
难以控制FeSO4、NaOH中不含氧气。
即使加热煮沸FeSO4、NaOH溶液,在冷却和实验过程中还会有少量氧气溶解。
2.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是______(填序号)。
成功制备Fe(OH)2的关键
由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成为物质制备实验探究的热点。
制备原理:
Fe2++2OH-===Fe(OH)2↓①溶液中不含Fe3+和O2等氧化性物质。
题组二 含铁化合物的框图推断
3.A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体。
D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。
它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
请回答下列问题:
(1)写出下列物质的化学式:
A________、D________、E________、X_______。
(2)在反应①~⑦中,不属于氧化还原反应的是__________(填编号)。
(3)反应④的离子方程式是__________________________________________;(4)反应⑦的化学方程式是__________________________________________;该反应中每消耗0.3mol的A,可转移电子______mol。
(5)写出D的溶液与小苏打溶液反应的离子方程式是________________________。
(6)除去D溶液中混有的少量G的方法是_________________________________。
(7)在D溶液中制备无水D固体的方法是________________________________。
4.(2012·四川理综,26)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中第________周期,________族。
(2)A在B中燃烧的现象是_________________。
(3)D+E―→B的反应中,被氧化与被还原的物质的物质的量之比是_______。
(4)G+J―→M的离子方程式___________________________________________。
(5)Y受热分解的化学方程式是__________________________________。
6.在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述不正确的是( )
A.白色沉淀是BaSO4和BaSO3
B.溶液的酸性增强
C.白色沉淀是BaSO4
D.FeCl3全部被还原为FeCl2
7.将3.48g四氧化三铁完全溶解在100mL1mol·L-1的硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O
全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )
A.0.05mol·L-1B.0.1mol·L-1
C.0.2mol·L-1D.0.3mol·L-1
8.根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
(1)写出M溶于稀硫酸和H2O2混合液的化学方程式为_________________________________。
(2)某同学取X的溶液,酸化后加入KI淀粉溶液,变为蓝色。
写出与上述变化过程相关的离子方程式为__________________________________、____________________。
(3)写出Cl2将Z氧化为K2EO4的化学方程式为
______________________________________________________。
9.某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验。
(1)硬质玻璃管中发生反应的化学方程式为_________________________
______________。
(2)反应前A中投放碎瓷片的目的是___________。
(3)装置E中的现象是_______________________________。
探究二 设计如下实验方案确定反应后硬质玻璃管中黑色固体的
成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于________后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。
若溶液变血红色,推断硬质玻璃管B中固体物质的成分为________(选填序号,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为________。
①一定有Fe3O4②一定有Fe
③只有Fe3O4④只有Fe
(6)另一份用__________(填仪器名称)加入________________________,可以证明溶液中存在Fe2+。
探究三 设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
固体28.8g
淡黄色溶液
淡红色溶液
血红色溶液
红棕色固体32g
(7)试剂b的化学式是________。
(8)计算反应后B装置中铁元素的质量分数为________。