23食品中的有机化合物1.docx
《23食品中的有机化合物1.docx》由会员分享,可在线阅读,更多相关《23食品中的有机化合物1.docx(13页珍藏版)》请在冰豆网上搜索。
23食品中的有机化合物1
龙文教育学科教学案
教师:
孟磊学生:
钱莹日期:
2013-8-11星期:
日时段:
10:
00-12:
00
课题
食品中的有机化合物-1
学习目标与
考点分析
乙醇、乙酸、乙酸乙酯
学情分析
基本掌握
学习重难点
全部
教学方法
回顾、总结
教学提纲与过程
第一部分:
教学提纲
第二部分:
教学过程
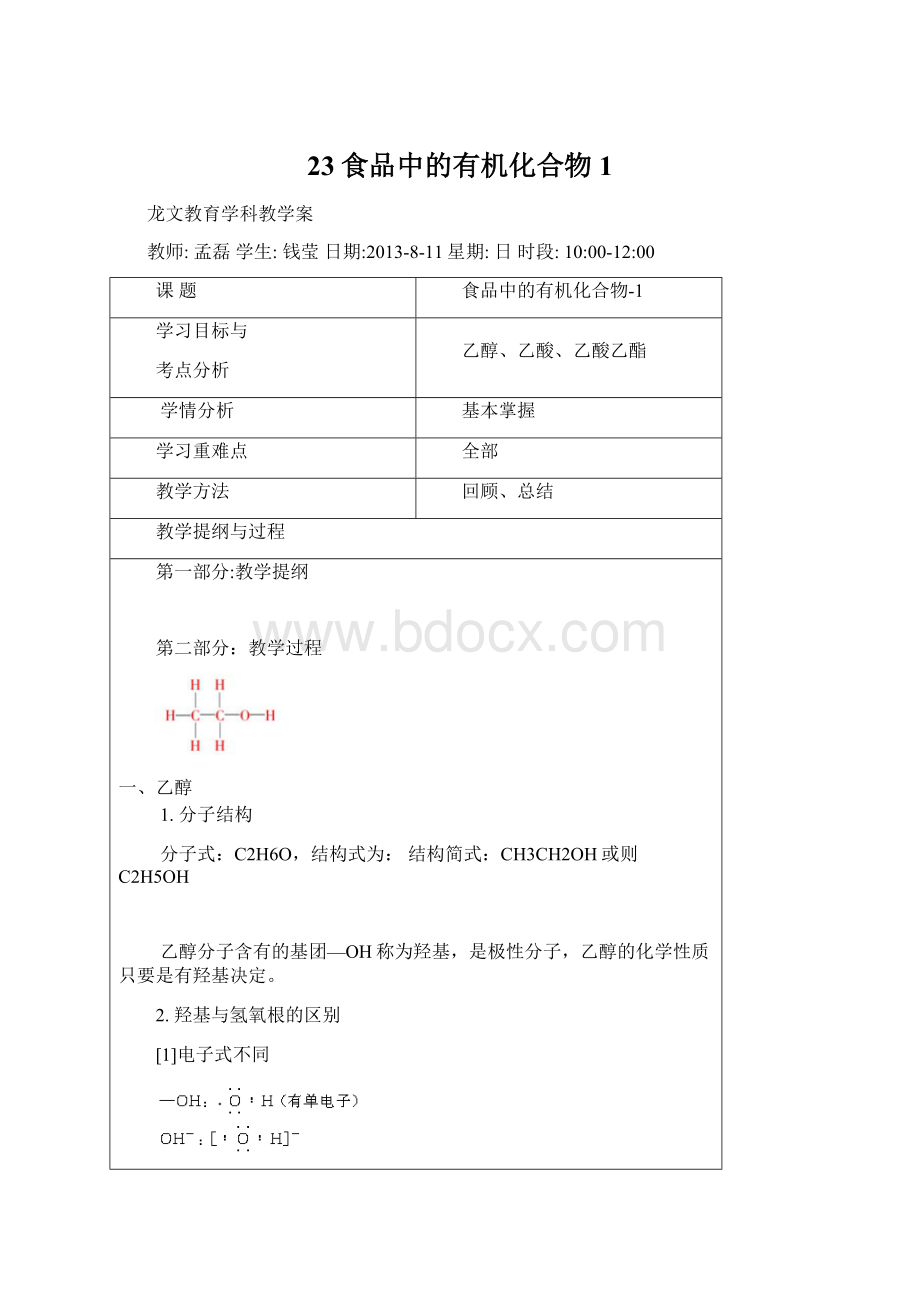
一、乙醇
1.分子结构
分子式:
C2H6O,结构式为:
结构简式:
CH3CH2OH或则C2H5OH
乙醇分子含有的基团—OH称为羟基,是极性分子,乙醇的化学性质只要是有羟基决定。
2.羟基与氢氧根的区别
[1]电子式不同
[2]电性不同:
—OH呈电中性,OH-呈负电性.
[3]存在方式不同:
—OH不能独立存在,只能与别的“基”结合在一起,OH-能够独立存在,如溶液中的
和晶体中的OH-.
[4]稳定性不同:
—OH不稳定,能与Na等发生反应,相比而言,OH-较稳定,即使与Fe3+等发生反应,也是整体参与的,OH-并未遭破坏.
3.物理性质
乙醇俗名酒精,是一种无色、透明、有特殊香味的液体,密度比水小,沸点为78.5℃,能溶于多种无机物和有机物,跟水任意比例混合。
【思考】如何证明某酒精为污水酒精?
4.化学性质
乙醇分子的官能团是羟基,羟基比较活泼,它决定着乙醇的化学性质,但乙基(—CH2CH3)对羟基也有影响。
(图1)
[1]钠与乙醇的反应
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
①本反应是取代反应,也是置换反应.
②其他活泼金属也能与CH3CH2OH反应,
如2CH3CH2OH+Mg
Mg(CH3CH2O)2+H2↑
③Na与乙醇的反应比与水的反应缓和的多:
2HO—H+2Na
2NaOH+H2↑
说明乙醇中羟基上的H原子不如水分子中羟基上的H原子活泼
④CH3CH2ONa(aq)水解显碱性.
CH3CH2ONa+H—OH
CH3CH2OH+NaOH
【思考】
A.乙醇可能存在的结构(结合化合价)?
B.
从什么角度进行确定其结构?
实验室利用如图所示的实验装置,测定乙醇与
钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中
能与金属钠反应的氢原子的数目。
试回答下列问题:
①指出实验装置中的错误_________________________。
②若实验中用含有少量水的乙醇代替相同质量的无水
乙醇,相同条件下,测得的氢气体积将__________
(填“偏大”、“偏小”或“不变”)。
③请指出能使该实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)____________________。
【注】1.金属钠要过量;2加入乙醇要缓慢;3读数时要冷却至室温,且量筒与广口瓶内的液面平衡。
[2]氧化反应
A.燃烧(可以是碳碳键断裂)
C2H6O+3O2
2CO2+3H2O
①CH3CH2OH燃烧,火焰淡蓝色
②烃的含氧衍生物燃烧通式为:
CxHyOz+(x+
-
)O2
xCO2+
H2O
B.催化氧化
【注】①乙醇去氢被氧化
②催化过程为:
CH3CHO生成时,Cu又被释出,Cu也是参加反应的催化剂.
C.乙醇能被酸性高锰酸钾氧化
5.工业制法
[1]乙烯水化法
[2]发酵法
6.醇类分子里羟基与烃基相连的有机化合物为醇,一般易溶于水。
甲醇:
丙三醇:
【例题】乙醇分子中不同的化学键如图1所示,指出下列反应所断裂的键
A.和金属钠反应键断裂B.在Ag催化下和O2反应键断裂
【例题】能证明乙醇分子中有一个羟基的是()
A.乙醇完全燃烧生成二氧化碳和水B.乙醇能与水以任意比混溶
C.0.1mol乙醇与足量钠反应只生成0.1g氢气D.乙醇在铜催化下可被氧化
【例题】关于乙醇结构方面的说法中正确的是()
A.乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性
B.乙醇与钠反应可以产生氢气,所以乙醇显酸性
C.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
【练习】
1.下列物质不能从溴水中萃取溴的是( )
A.乙醇 B.苯 C.四氯化碳 D.戊烷
2.质量为ag的铜丝,在空气中灼烧变黑,趁热放入下列物质中,铜丝变红,质量仍为ag的是( )
A.盐酸B.硝酸C.一氧化碳D.乙醇
3.一定量的乙醇在氧气不足的情况下燃烧,生成CO、CO2、H2O的总质量为27.6g,其中水的质量为10.8g,则CO的质量为( )
A.1.4gB.2.2gC.4.4gD.在2.2g~4.4g之间
4.下图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。
请你与同学合作组装实验装置完成实验,并回答下列问题。
图中A试管中盛的无色液体为无水乙醇(沸点为78.5℃),B处放置的为绕成螺旋状的细铜丝或银丝,C处放置的为无水CuSO4粉末,D干燥管中盛放的为碱石灰,F试管中盛的为新制的碱性Cu(OH)2悬浊液(与含有—CHO的物质作用生成砖红色沉淀)。
(1)在上述装置中,实验时需要加热的仪器按加热的先后顺序排列为________(填仪器或某部位的代号)。
E处是一种纯净物,其发生反应的化学方程式为_______________________。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是___________________,
D装置的作用是_____________________________。
(3)能证明乙醇反应后产物的实验现象是___________________________。
(4)图中G处导管倾斜的作用是______________________________。
(5)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同。
推断B处发生反应的化学方程________________________________。
二、乙酸
1.分子结构
分子式:
C2H4O2,结构式:
,结构简式:
CH3COOH,可以看成是由甲基和羧基结合而成,官能团为—COOH。
乙酸中的—COOH叫羧基,乙酸的化学性质主要有羧基决定。
2.物理性质
乙酸俗称醋,是有强烈刺激性气味的无色液体,纯净的乙酸在温度低于16.6℃时凝结成冰一样的晶体,所以纯净的乙酸又称为无水乙酸或冰醋酸,乙酸易溶于水和乙醇。
食醋中一般含3-5%。
【思考】为什么乙酸的沸点较高?
3.化学性质
(1)乙酸的酸性
乙酸在水中可以电离:
,乙酸是弱酸但酸性比碳酸强。
乙酸具有酸的通性:
①使酸碱指示剂变色。
②与活泼金属(如Mg)反应:
2CH3COOH+Mg―→(CH3COO)2Mg+H2↑
③与碱性氧化物(如CaO)反应:
2CH3COOH+CaO―→(CH3COO)2Ca+H2O
④与碱(如NaOH)反应:
CH3COOH+NaOH
CH3COONa+H2O
⑤与盐(如Na2CO3)反应:
^^^^^^^^^^^^^?
?
?
?
?
?
?
?
?
?
[2]酯化反应
乙酸和乙醇发生酯化反应的化学方程式为
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
【例题】将一定质量的铜片在酒精灯火焰上加热后,分别插入①醋酸;②甲醇;③石灰水溶液中,取出洗涤、干燥称量,质量变化正确的是()
A.①变轻②变重③不变B.①变轻②不变③变重
C.①变轻②不变③不变D.①变重②不变③变重
【例题】下列物质中含有少量的杂质,能用饱和碳酸钠溶液并借助于分液漏斗除去杂质的是()
A.苯中含有少量甲苯B.乙醇中含有少量乙酸
C.溴苯中含有少量苯D.乙酸乙酯中含有少量乙酸
【例题】能用于除去乙酸乙酯中乙酸和乙醇杂质的试剂是()
A.饱和碳酸钠溶液B.氢氧化钠溶液C.苯D.水
【思考】如何鉴别乙醇及乙酸?
【思考】如何分离乙醇及乙酸?
三、乙酸乙酯
【结构】酸和醇起反应生成的一类有机化合物。
其结构式可用
,(-R,-R′代表烃基)表示。
酯的官能团是
【物理性质】酯类大多数难溶于水,密度比水小,低级酯具有一定的芳香气味。
【命名】根据生产该酯所用的酸和醇进行命名,如乙酸乙酯。
【化学性质】
[1]酸性条件下的水解
乙酸乙酯在稀H2SO4催化作用下发生反应的化学方程式为
[2]碱性条件下的水解(不可逆反应)
乙酸乙酯在NaOH催化作用下反应的化学方程式为
【注】酸性条件下,酯的水解不完全;碱性条件下,酯的水解趋于完全。
【主要用途】常用作溶剂,也可以用作制备饮料和糖果的香料。
【乙酸乙酯的制备】
[装置]如图
[步骤]
(1)在一支大试管里注入3mL乙醇,然后边振荡试
管边慢慢加入2mL浓硫酸和2mL乙酸。
(2)用小火加热试管里的混合物,把产生的蒸气经导
管通到3mL饱和Na2CO3溶液中(导管口在液面上方约
2~3mm处),注意观察盛Na2CO3溶液的试管内的变化;待有透明的油状液体浮在液面上时,取下盛有Na2CO3溶液的试管,并停止加热。
振荡盛有Na2CO3溶液的试管,静置,待溶液分层。
[现象]Na2CO3溶液表面有油状物出现,闻到芳香的气味。
[需要注意的问题]
(1)试剂的加入顺序为先加乙醇和乙酸,再加浓硫酸,不能先加浓硫酸。
(2)浓硫酸在此实验中起催化和吸水的作用。
(3)要小心加热,以防乙酸和乙醇大量挥发,液体剧烈沸腾。
(4)输导乙酸乙酯蒸气的导气管不能插入饱和Na2CO3溶液中,防止倒吸。
(5)用饱和Na2CO3溶液吸收乙酸乙酯蒸气,优点主要是:
①乙醇易溶于水,乙酸易与Na2CO3反应生成易溶于水的CH3COONa,这样便于闻酯的香味;②乙酸乙酯在浓的无机盐溶液中,溶解度会降低,便于乙酸乙酯分层析出。
(6)若要将制得的乙酸乙酯分离出来,可用分液漏斗进行分液,得到的上层油状液体即为乙酸乙酯。
[提高产率的措施]
(1)用浓硫酸吸水,使平衡向正反应方向移动。
(2)加热将酯蒸出,使平衡向正反应方向移动。
(3)可适当增加乙醇的量,并采用冷凝回流装置。
【例题】参考乙酸乙酯的制备装置,回答下列问题:
(1)加入药品的顺序及原因?
(2)浓硫酸的作用?
(3)饱和Na2CO3溶液的作用?
(4)碎瓷片的作用?
(5)直角长导管的作用?
(6)导管末端不能插入液面以下的原因?
(7)请从速率和平衡的角度分析上述可逆反应。
哪些因素能加快该反应的速率?
哪
些因素能促进该反应向生成酯的方向进行?
[思考]酯化反应脱水方式的证明:
浓硫酸
△
(1)乙酸乙酯的脱水方式,可通过同位素标记的方法得以证实:
CH3COOH+H18O—CH2CH3→CH3CO18OCH2CH3+H2O
(M=88)
(2)若将18O原子标记在羧酸分子的羟基上(CH3CO18OH),所得到的乙酸乙酯的结构将如何?
______________________________。
(3)实验测知:
用CH3CO18OH和CH3CH2OH反应所得到的乙酸乙酯的平均分子量为89。
这是为什么?
_____________________。
所得到的乙酸乙酯的结构可能是_____和_________,它们的物质的量之比为___________,质量比为___________。
(4)乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B)。
反应可能经历了生成中间体(I)这一步。