ISO17025-2017实验室风险和机遇识别分析评估及应对措施表.docx
《ISO17025-2017实验室风险和机遇识别分析评估及应对措施表.docx》由会员分享,可在线阅读,更多相关《ISO17025-2017实验室风险和机遇识别分析评估及应对措施表.docx(8页珍藏版)》请在冰豆网上搜索。
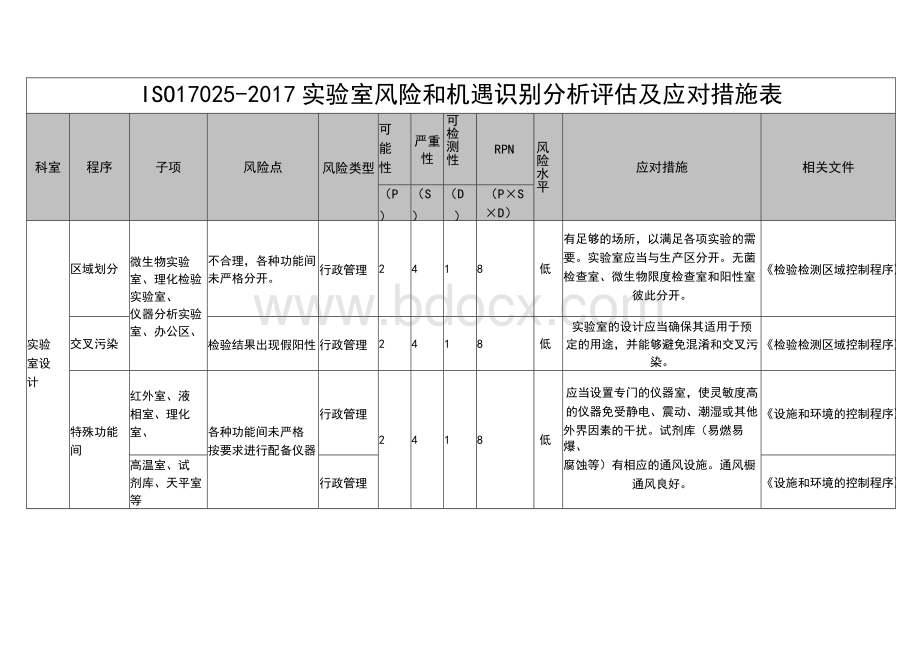
ISO17025-2017实验室风险和机遇识别分析评估及应对措施表
科室
程序
子项
风险点
风险类型
可
能
性
严重性
可检测性
RPN
风险水平
应对措施
相关文件
(P
)
(S
)
(D
)
(P×S
×D)
实验
室设
计
区域划分
微生物实验室、理化检验实验室、
仪器分析实验室、办公区、
不合理,各种功能间未严格分开。
行政管理
2
4
1
8
低
有足够的场所,以满足各项实验的需
要。
实验室应当与生产区分开。
无菌
检查室、微生物限度检查室和阳性室
彼此分开。
《检验检测区域控制程序》
交叉污染
检验结果出现假阳性
行政管理
2
4
1
8
低
实验室的设计应当确保其适用于预
定的用途,并能够避免混淆和交叉污染。
《检验检测区域控制程序》
特殊功能间
红外室、液
相室、理化室、
各种功能间未严格
按要求进行配备仪器
行政管理
2
4
1
8
低
应当设置专门的仪器室,使灵敏度高
的仪器免受静电、震动、潮湿或其他
外界因素的干扰。
试剂库(易燃易爆、
腐蚀等)有相应的通风设施。
通风橱
通风良好。
《设施和环境的控制程序》
高温室、试
剂库、天平室等
行政管理
《设施和环境的控制程序》
管理层
组织机构
分工合理性
人员数量不足,不能及时完成检验工作。
行政管理
2
4
1
8
低
每年根据编制实际情况申请人员招
聘计划;明确科室职责。
《人员管理程序》
管理人员
技术负责人、质量负责人、授权签字人
能力、资质及经验不足
行政管理
2
4
1
8
低
仔细审核学历职称等,并对工作经历
做调查。
技术负责人和授权签字人必
须经过资质认定部门现场考核确认。
《人员管理程序》
办公室
安全隐患
消防、生物、人身等安全
未及时发现及处理,对实验操作人员构成威胁。
支持服务
2
4
1
8
低
制定消防、危险品、生物安全防护制度
《安全管理体系文件》
人员安全
伤害应急
处理
人员培训
安全防护不到位,实验人员造成不必要的损伤
支持服务
1
4
1
4
低
要求实验人员进行岗前安全培训。
配
备安全防护和应急处理设备
《安全管理体系文件》
三废处理
环境安全
未处理彻底,污染环境
支持服务
2
5
1
10
低
制定三废处理文件
《安全管理体系文件》
业务室
试剂试药验收
验收项目不全面,验收错误
验收项目不全面,
验收错误,导致实
验失败,影响药品
质量
技术运作
1
4
1
4
低
制定验收作业指导书,明确验收流程。
《服务和供应控制程序》
合同评审
检验资质、合同要求
不能按合同完成检
验,不具备检验资质
技术运作
1
3
1
3
低
认真进行合同评审,开始工作前将各种偏离进行判断。
《合同评审程序》
样品受理
样品信息、样品标识
流转卡与样品信息
不一致,样品标识
混乱
技术运作
1
4
1
4
低
样品进行标识,仔细核对样品流转卡
《样品处置控制程序》
样品留样
留样样品包
装、储存环境
包装完整性受到破
坏,储存环境不符合要求。
留样质量受到影响,检验结
果不准确
技术运作
1
4
1
4
低
检查留样包装完整性,按样品储存要求进行存储。
《样品处置控制程序》
标准品对
照品管理
来源、检测、管理
标准品对照品保存不当,或出现过期变质,导致检验结果不正确
技术运作
2
4
1
8
低
进行对照品的期间核查,及时剔除过
期和变质的对照品。
定期监控储存环境。
《标准物质管理程序》
菌种
接受、传代、
保存方法、
销毁方式
未按照要求进行传代、保存、销毁。
导致检验结果不正确
技术运作
2
5
1
10
低
保证有检验所需的各种检定菌,并建
立检定菌保存、传代、使用、销毁的
操作规程和相应记录。
《菌种管理程序》
微生
物检
验室
微生物实
验室、无
菌实验室
卫生
实验室污染滋生微生物影响检验结果,或影响人身安全
技术运作
1
3
1
3
低
定期对洁净室进行消毒处理
微生物室管理规定
检验人员进入微生物实验室、无菌实验室
检验人员未按要求
进入洁净区造成环
境污染
技术运作
1
4
1
4
低
制定物生物实验室控制程序
微生物室管理规定
检验器具清洁
检验器具灭菌不彻
底造成检验结果假
阳性
技术运作
2
4
1
8
低
制定物生物实验室控制程序
微生物室管理规定
培养基
培养基未进行适用
性检查,导致检验
结果不正确
技术运作
2
5
1
10
低
已配制的培养基及时标注配制批号、
配制日期和配制人员姓名,并有配制
(包括灭菌)记录,并对培养基进行适用性检查。
《培养基的质量控制程序》
微生物用检验样品包扎
检验样品包装损坏
造成微生物污染
技术运作
2
5
1
10
低
按照标准操作方法进行操作
检验室
质量标准
未按质量标准进行
检验;质量标准未
作废版本,造成检
验结果无效。
技术运作
2
5
1
10
低
选择经过查新的质量标准。
《标准查新控制程序》
检验记录、各种辅助记录
(如仪器设备使用、环境监测)
誊抄记录、热敏记
录纸使用不当;假
记录、杜撰记录、
技术运作
2
5
1
10
低
建立原始记录书写规范
《化学药品记录及报告
书写规范》《中药记录
及报告书写规范》
未实施连码设计;未装订成册管理等。
技术运作
2
4
1
8
低
原始记录按顺序编码;电子数据:
是
由分析员和仪器产生的原始数据,由
仪器管理员定期备份。
《记录控制程序》《计
算机软件及数据控制程
序》
样品管理
样品接收、贮存、分发与剩余样品的处理
样品分发不正确或贮存条件不正确导致检验结果不正确。
样品分发错误:
直接导致结果错误。
不能及时安排检验时,样品的存放条件不合适:
导致样品变质或被污染。
技术运作
3
5
1
15
低
按要求对样品进行封装,需认真核对标签,确定无误。
《样品处置控制程序》
检验
依法操作
未掌握检验规程及检验方法,检验技术不熟练,检验结果不完全、不正确。
未对实验器材、试剂试药、实验条件进行确认。
未按照检验操作规程依法操作。
技术运作
3
5
1
15
低
应当确保按照质量标准或注册批准
的方法进行检验。
对人员进行检验方
法及检验操作规程的培训,保证检验
结果的及时、真实、可靠、准确。
《检验工作程序》
试剂试液管理
定期配制
试剂、试液过期或
保管不当,影响检验结果的准确性。
技术运作
2
5
1
10
低
试液的配制应当标注配制批号、配制
日期和配制人员姓名,并有配制记
录。
不稳定的试剂、试液和培养基应
当标注有效期及特殊贮存条件。
中国药典附录、检验方法中的规定
滴定液管理
定期标化
滴定液未定期标化,导致F值不正确,影响检验结果的准确性。
技术运作
3
5
1
15
低
标准液、滴定液还应当标注每次标化
的日期和校正因子,并有配制、标化、发放记录。
《滴定液与标准溶液控制程序》
异常结果的分析
紧急情况处理、偏差可能出现的原因、调查方案、调查过程、方案的扩大调查、
对检验结果异常未及时进行调查与处理。
检验结果异常调查方法错误,错误原因不明。
调查方式不正确。
缺少证据及书面支持材料。
技术运作
3
4
1
12
低
明确超常异常结果调查步骤。
对实验
条件、明确错误来源(操作方法不当、
计算错误、使用对照品不当等)。
找
到原因,对检验过程进行分析。
《质量控制程序》
标准操作
规程和表
操作性不强,不能指导仪器操作。
技术运作
2
4
1
8
低
建立标准操作规程并按操作规程进
行检验,表格设计考虑周全,避免遗
作业指导书
格
漏。
仪器
管理
仪器检定
主要仪器验证管理
主要仪器设备未进
行检定校准,或超
过检定周期。
无法
保证检验结果的准
确性
技术运作
3
4
1
12
低
仪器设备及时进行验证,定期检定与
校准,始终保证检验设备及仪器保持
持续稳定的验证状态。
《量值溯源和检定校准总体要求》
仪器期间核查
定期进行
仪器未按要求进行期间核查,不能随时掌握仪器的运行情况,造成检验结
果不准确
技术运作
3
4
1
12
低
制定年度仪器期间核查计划
《期间核查控制程序》
仪器维护
仪器未按要求进行
维护,易造成仪器设备的损坏。
技术运作
2
4
1
8
低
定期检查仪器维护记录
作业指导书
抽样室
取样
取样人、取样区域和工具、取样计划、取样技术、样品标示、取样记录
取样不具备代表性,影响分析检验结果的可信度,未能按取样操作规程进行操作,取样有
可能产生污染。
技术运作
2
5
1
10
低
对抽样人员培训合格后上岗。
制定完善的抽样计划。
抽样控制程序
留样
代表性、留样量、留样样品包装、保存条件、保存时间、定期观察
留样不具有代表性,留样量不够不足无法完成必要的检验;留样包装与
实物包装不一致。
技术运作
3
4
1
12
低
保证样品留样代表性,按照抽样计划执行。
抽样控制程序
资质认定扩项
申请扩项的检验项目或方法未进行相应验证
质量管理
3
5
1
15
低
现场评审前必须完成所扩检验方法的验证或确认。
特定项目开发控制程序
质保办
年度报告
未按时完成检验机构年度报告
质量管理
2
4
1
8
低
定期按要求进行上报,质保办负责
质量手册,资质认定管理办法
变更
中心出现需要变更的相关情况时,未及时上报质监系统。
质量管理
2
4
1
8
低
认真学习手册4.5.25
质量手册,资质认定管理办法