高中化学原电池知识练习题附答案.docx
《高中化学原电池知识练习题附答案.docx》由会员分享,可在线阅读,更多相关《高中化学原电池知识练习题附答案.docx(17页珍藏版)》请在冰豆网上搜索。
高中化学原电池知识练习题附答案
高中化学原电池知识练习题
一、单选题
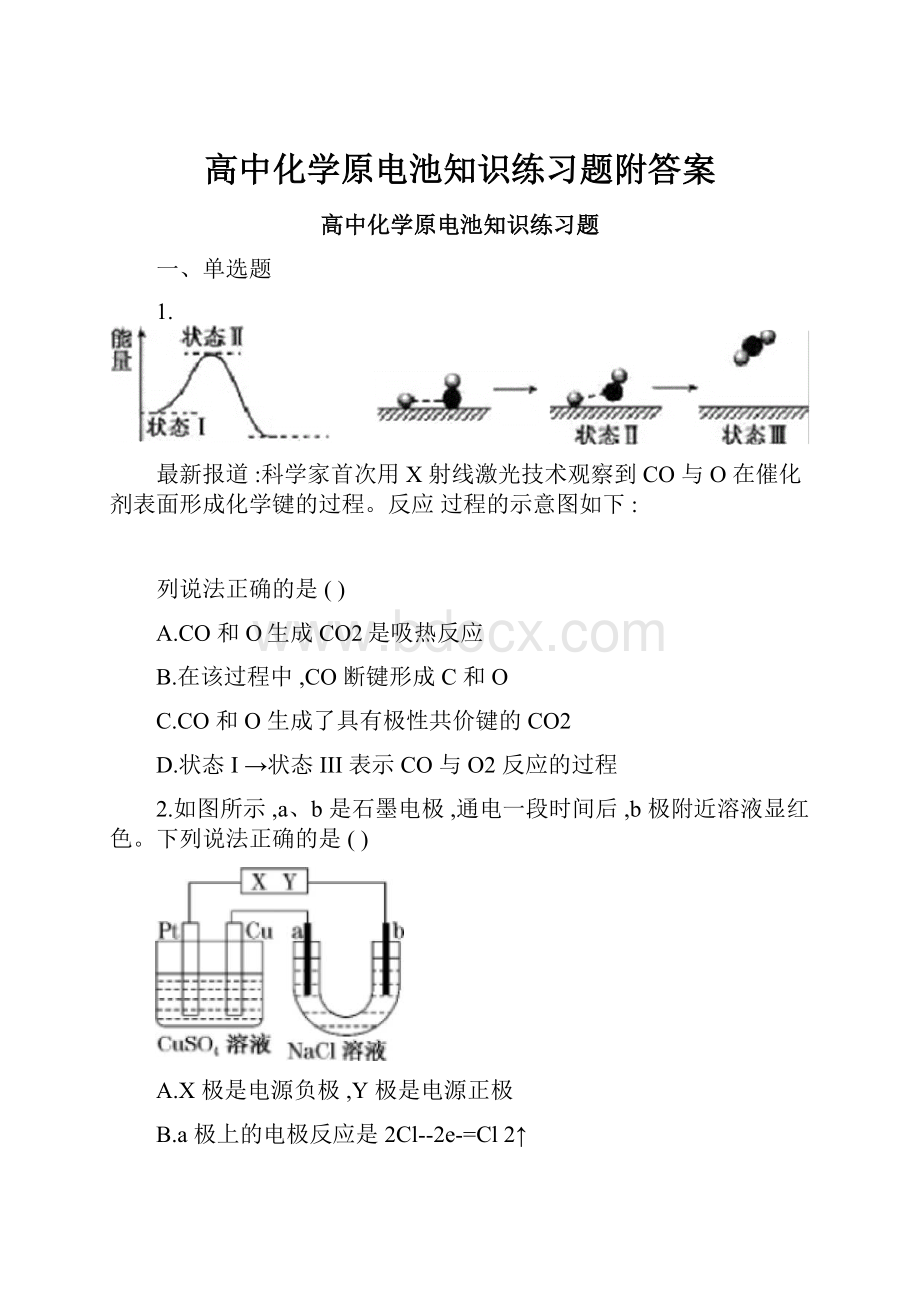
1.
最新报道:
科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。
反应过程的示意图如下:
列说法正确的是()
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态I→状态III表示CO与O2反应的过程
2.如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。
下列说法正确的是()
A.X极是电源负极,Y极是电源正极
B.a极上的电极反应是2Cl--2e-=Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.b极上产生2.24L(标准状况下)气体时,Pt极上有6.4gCu析出
3.海洋电池以铝合金为电池负极,金属(Pt、Fe)网为正极,科学家把正极制成仿鱼鳃的网状结构。
它以海水为电解质溶液,靠海水中的溶解氧与铝反应产生电能。
海水中只含有0.5%的溶解氧。
不放
入海洋时,铝极就不会在空气中被氧化,可以长期储存。
用时,把电池放入海水中,便可供电,电池设计使用周期可长达一年以上,避免经常更换电池的麻烦。
即使更换,也只是换一块铝合金板,电池总反应式:
4Al3O26H2O4AlOH3。
下列说法错误的是()
A.负极铝被氧化
B.海水温度升高,电池反应速率可能加快
C.正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气的接触面积
D.正极电极反应式为O24H4e2H2O
4.三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO4可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是()
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O-4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
5.支持海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸
铁为惰性辅助阳极。
下列有关表述不正确的是()
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
6.一定条件下使用甲烷可以消除氮氧化物(NOx)的污染。
已知:
①CH4(g)+4NO2(g)=
4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJm·ol-1;②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJm·ol-1。
下列选项正确的是()
A.若在相同条件下用0.2molCH4还原NO2生成N2,则该反应放出的热量为173.4kJ
B.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)HΔ=-867kJm·ol-1
C.CH4催化还原NOx生成N2的过程中,若x=1.6,则生成1molN2时转移的电子为3.2mol
D.若用标准状况下4.48LCH4还原NO2生成N2,则整个过程中转移的电子为3.2mol
A.石墨与金刚石之间的转化是物理变化
B.C(s,石墨)=C(s,金刚石)ΔΗ=+1.9kJm·ol
C.金刚石的稳定性强于石墨
D.断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
8.已知:
锂离子电池的总反应为:
LixC+Li1-xCoO2C+LiCoO2,锂硫电池的总反应为:
2Li+S
Li2S
有关上述两种电池说法正确的是()
A.锂离子电池放电时,Li+向负极迁移B.锂硫电池充电时,锂电极上发生还原反应
C.理论上两种电池的比能量相同D.如图表示用锂离子电池给锂硫电池充电
9.
下图是某同学设计的验证原电池和电解池的实验装置,下列有关说法不正确的是()
C.关闭
K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为负极,b为正极
K2,打开K1,一段时间后,用拇指堵住试管移出烧杯,向试管内滴入酚酞,发现左侧试管内溶液变
红色,则a为负极,b为正极
D.关闭K2,打开K1,一段时间后,再关闭K1,打开K2,电流计指针不会偏转
10.已知下列热化学方程式
(1)CH3COOHl+2O2g2CO2g+2H2OlΔH1=-870.3kJm·ol
-1
(2)Cs+O2gCO2gΔH2=-393.5kJm·ol
-1
(3)H2g+1/2O2gH2OlΔH3=-285.8kJm·ol-1
则反应2Cs+2H2g+O2gCH3COOH(l)的ΔH为()
-1-1
A.-488.3kJmo·l-1B.-244.15kJmo·l-1
-1-1
C.+488.3kJm·ol-1D.+244.15kJm·ol-1
11.银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理:
在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。
下列说法正确的是()
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S=6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
E.
下面有关电化学的图示,完全正确的是()
12.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆2-
(ZrO2)晶体,在熔融状态下能传导O。
下列对该项燃料电池说法正确的是()
2-
A.在熔融电解质中,O2-由负极移向正极
B.电池总反应式是:
2C4H10+13O28CO2+10H2O
-2-
C.通入空气的一极是正极,电极反应为:
O2+4e-2O2-
D.通入丁烷的一极是正极,电极反应为:
C4H10+26e-+13O2-4CO2+5H2O
13.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。
下列说法正确的是()
A.Zn为电池的负极
2
B.正极反应式为2FeO410H6eFe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时OH-向负极迁移
14.某固体酸燃料电池以CsHSO4固体为电解质传递H,其基本结构如图。
下列有关说法错误的是
A.a极为负极,电极上发生氧化反应
B.电池总反应可表示为2H2+O2=2H2O
C.外电路中电子由b电极通过导线流向a电极D.该装置工作时把电能转化为化学能三、填空题
15.研究电化学过程的实验装置如图所示。
1.甲池中通入O2的一极作极,丙池中C(Pt)电极作极。
2.通入O2的电极电极反应式为,通入CH3OH的电极的电极反应式为
3.乙池中总反应的化学方程式为。
4.当乙池中B(Ag)电极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)。
16.回答下列问题:
1.图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:
2.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是-1①CH3OH(g)+H2O(g)CO2(g)+3H2(g)ΔH=+49.0kJ·mol
②CH3OHg+1O2gCO2g+2H2gH192.9kJmol
-1
又知:
③H2O(g)H2O(l)ΔH=-44kJ·mol则甲醇蒸气完全燃烧生成液态水的热化学方程式为。
3.下表是部分化学键的键能数据:
化学键
P-P
P-O
O=O
P=O
-1
键能/(kJ·mol-1)
a
b
c
x
已知1molP4(g)完全燃烧生成P4O10(g)放出的热量为dkJ,P4和P4O10的结构如图Ⅱ所示,则上表中x=(用含有a、b、c、d的代数式表示)。
17.
人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图所示
3.电解结束后,阴极室溶液的pH与电解前相比将
况),则除去的尿素为g(忽略气体的溶解)
四、实验题
18.对金属制品进行抗腐蚀处理可延长其使用寿命。
1.以下为铝材表面处理的一种方法
以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
2.镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是.
3.利用下图装置可以模拟铁的电化学防护.
若X为碳棒,为减缓铁的腐蚀,开关K应置于处。
若X为锌,开关K置于M处,该电化学
保护法称为.
参考答案
1.答案:
C
解析:
A项,CO和O生成CO2是放热反应;B项,观察反应过程的示意图知,该过程中,CO中的化学键没有断裂形成C和O;C项,CO和O生成的CO2分子中含有极性共价键;D项,状态I→状态III表示CO与O反应的过程。
2.答案:
B
解析:
b极附近溶液显红色,所以b极上的电极反应为2H++2e-=H2↑,a极上的电极反应为2Cl--2e-=Cl2↑则,Y为电源负极,X为电源正极,Pt为阳极,Cu为阴极,a为阳极,b为阴极,A项错误,B项正确;2CuSO4+2H2O2Cu+O2↑+2H2SO4,电解过程中CuSO4溶液的pH逐渐变小,C项错误;Pt极上发
生氧化反应,不会有Cu析出,D项错误。
3.答案:
D
解析:
A.根据电池总反应式:
4Al3O26H2O4AlOH3,铝失电子作负极,被氧化,A项
正确;
B.海水温度升高,化学反应速率加快,电池反应速率可能加快,B项正确;
C.正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积,C项正确;
D.氧气在正极得电子,海水呈中性,正极电极反应式为O22H2O4e4OH,D项错误;选
D。
考点:
考查原电池的工作原理。
4.答案:
B
解析:
该装置为电解池。
H2O在正(阳)极区放电,生成O2和H+,中间隔室中的阴离子SO42-通过cd膜移向正(阳)极,故正(阳)极区得到H2SO4,当电路中通过1mol电子时生成0.25molO2,正(阳)极区溶液pH减小,H2O在负(阴)极区放电,生成OH-和H2,负(阴)极区溶液pH增大,A、C、D项错误。
H2O在负(阴)极区放电生成H2和OH-中间隔室中的阳离子通过ab膜移向负(阴)极,故负(阴)极区可得到NaOH,而正(阳)极区可得到H2SO4,故B项正确;
5.答案:
C解析:
由图可知,高硅铸铁与直流电源的正极相连,作电解池的阳极,钢管桩与直流电源的负极相连,作电解池的阴极,通入保护电流使钢管桩表面腐蚀电流接近于零,钢管桩得到保护,A正确;通电后,外电路中电子由高硅铸铁经导线流向正极,再由电源的负极经导线流向钢管桩,故通电后外电路中电子被强制从高硅铸铁流向钢管桩,B正确;高硅铸铁为惰性辅助阳极,只起到传递电流的作用,不会被损耗,C错误;通入的保护电流要根据海水中电解质的浓度、温度等环境条件变化进行调整,从而有效保护钢管桩,D正确。
6.答案:
A
解析:
根据盖斯定律,由①+②得:
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)ΔH=-1734kJm·ol-1,A项正确;B项中H2O应该为气态,B项错误;C项中转移的电子为1mol×(3.2-0)2×=6.4mol,C项错误;标准状况下4.48LCH4还原NO2生成N2,转移的电子为0.2mol×8=1.6mol,D项错误。
7.答案:
B解析:
石墨与金刚石是两种不同的单质,二者之间的转化是化学变化,A项错误;由图可知,1mol金刚
石的能量比1mol石墨的能量高395.4kJ-393.5kJ=1.9kJ,故有C(s,石墨)=C(s,金刚石)ΔΗ=+1.9kJ·m-ol1,B项正确;金刚石的能量高于石墨的能量,物质的能量越高越不稳定,C项错误;C(s,石墨)=C(s,金刚石)ΔΗ=+1.9kJ·-1m,1omlol石墨的总键能比1mol金刚石的总键能大1.9kJ,D项错误。
8.答案:
B
解析:
锂离子电池放电时Li+(阳离子)向正极迁移,A项错误;锂硫电池放电时负极反应为锂失去电子变为锂离子,发生氧化反应,则充电时,锂电极上发生还原反应,B项正确;比能量是指参与电极反应的单位质量的电极材料放出电能的大小,二者的比能量不同,C项错误;题中装置不能表示用锂离子电池
给锂硫电池充电,锂电极和硫电极互换位置后可以表示用锂硫电池给锂离子电池充电,D项错误。
9.答案:
D
解析:
关闭K2、打开K1,是电解NaCl溶液的过程,反应方程式为
2NaCl+2H2O2NaOH+Cl2↑+H2↑,C-在l阳极上放电生成Cl2,H+在阴极上放电生成H2,则两极都有
气泡产生;且由于Cl2可以溶于水,则收集到的Cl2的体积略小于H2的体积,则与外电源b极相连的石墨棒作电解池的阳极,则b极为正极;左侧试管中溶液变红色,说明左侧试管中溶液呈碱性,则H+放电,则左侧石墨棒为电解池的阴极,则a为外电源的负极;一段时间后,打开K2,关闭K1,可以构成原电池,放电时会引起检流计指针发生偏转。
故A、B、C均正确,D错误,故应选D。
10.答案:
A
解析:
根据盖斯定律,由
(2)×2+(3)×2-
(1)得2Cs+2H2g+O2gCH3COOH(l)HΔ=(-
-1-1-1-1
393.5kJm·ol-1)×2+(-285.8kJm·ol-1)×2-(-870.3kJmo·l-1)=-488.3kJm·ol-1.
11.答案:
B
解析:
处理过程中,银器为正极,Ag2S被还原为Ag,致使该过程中银器质量减小,A错;该过程是在溶液中进行,Al2S3会发生双水解,所以总方程式应为2Al+3Ag2S+6H2O=6Ag+2Al(OH)3+3H2S,C错;黑色褪去是由于Ag2S转化为Ag,D错。
12.答案:
D
解析:
A、由图可知,金属性ZnCu,则原电池中Zn作负极,故A错误;
B、与电源负极相连的为阴极,粗铜的精炼中粗铜作阳极,由图可知,粗铜作阴极,故B错误;
C、与电源负极相连的为阴极,铁片镀锌,铁片应作阴极,由图可知,铁片作阳极,故C错误;
D、电流由正极流向负极,由图可知,碳棒为阳极,电解食盐水在阳极生成氯气,氯气与碘化钾淀粉溶
液反应使溶液变蓝,在阴极生成氢气,溶液变红,故D正确;故选D.
13.答案:
BC
解析:
在原电池中,阴离子向负极移动,A项错误;燃料电池的反应本质一般是燃料的燃烧反应,B项正确;通入空气的一极为正极,C项正确;通入丁烷的为负极,D项错误。
14.答案:
AD
解析:
由电极材料为K2FeO4和Zn可知,Zn作负极,A项正确;K2FeO4作正极,得电子发生还原反应,则
2
正极反应式为2FeO426e5H2OFe2O3+10OH-,在碱性溶液中,电极反应式中不能出现
+
H,B项错误;该电池放电时的总反应为3Zn+2K2FeO4+5H2O3Zn(OH)2+Fe2O3+4KOH,反应消耗H2O,且生成KOH,故电解质溶液浓度增大,C项错误;根据原电池原理可知,溶液中的阴离子向负极移动,则该电池工作时OH-向负极迁移,D项正确。
15.答案:
CD解析:
根据原电池工作原理,通氢气一极为负极,A项正确;从图可以看出,电池的总反应为2H2+O2=2H2O,B项正确;原电池中,电子从负极经导线到正极,C项错误;该装罝为原电池,是化学能转化成电能的装置,D项错误。
16.答案:
1.正;阳;2.O2+4e-+2H2O4OH;CH3OH+8OH--6e-CO32-+6H2O
3.2H2O+4AgNO34Ag+O2↑+4HNO3
4.280
解析:
甲池属于燃料电池,通入燃料CH3OH的电极作负极,电极反应为CH3OH+8O-H-6e-CO23-+6H2O,
通入O2的电极作正极,电极反应为O2+4e-+2H2O4OH-,进而可判断出A为阳极,B为阴极,C为阳极,D为阴极。
乙池中阳极、阴极的电极反应式分别为:
2H2O-4e-O2+4H+、Ag++e-Ag,则总反应
的化学方程式为2H2O+4AgNO34Ag+O2↑+4HNO3。
当乙池中B(Ag)电极的质量增加5.40g时,转移
的电子为5.40g-1=0.05mol,甲池中理论上消耗O2的体积为
108gmol-1
0.05mol-1
22.4Lmol-1=0.28L=280mL。
4
-1
17.答案:
1.NO2(g)+CO(g)CO2(g)+NO(g)ΔH=-234kJ·mol
3-1
2.CH3OHg+O2gCO2g+2H2O(l)H764.7kJmol-1
2
1
3.d6a5c12b
4
-1
解析:
1.观察图像,该反应的热化学方程式为NO2(g)+CO(g)CO2(g)+NO(g)ΔH=134kJ·mol-1
-1-1
368kJ·mol=-234kJ·mol
2.根据盖斯定律,由3×②-①×2+③×2可得:
3
CH3OHg+O2g
2
CO2g+2H2OlΔH=3-192.9kJmol-1-249.0kJmol-1+-44kJmol-12=-764.7kJmol-1。
-1
3.P4(g)+5O2(g)P4O10(g)ΔH=-dkJ·mol-1,由于反应热=反应物键能总和-生成物键能总和,故
1
6a+5c-(4x+12b)=-d,可得xd6a5c12b
4
18.答案:
1.B;2.2Cl--2e-Cl2↑;CO(NH2)2+3Cl2+H2ON2+CO2+6HCl
3.不变;7.2
解析:
1.根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律,结合本题图中的电极产物H2
和Cl2可以判断出A为电源的正极,B为电源的负极;
2.阳极室中发生的反应依次为2Cl--2e-Cl2↑,CO(NH2)2+3Cl2+H2ON2+CO2+6HCl。
3.阴极反应为2H2O+2e-2OH-+H2↑,阳极反应为2Cl--2e-Cl2↑,同时在阳极室发生反应
-+
CO(NH2)2+3Cl2+H2ON2+CO2+6HCl,根据上述反应可以看出在阴、阳极上产生的OH-、H+的数目相等,
+-
阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的13.44L气体中VN2VCO213.44L2.688L,即
5
nN2nCO20.12mol,根据方程式CONH22+3Cl2+H2ON2+CO2+6HCl可知,生成
-1
0.12molN2时所消耗的CO(NH2)2也为0.12mol,其质量为m[CO(NH2)2]=0.12mol×60g·mol=7.2g。
-+
19.答案:
1.2Al+3H2O-6e-=Al2O3+6H+
2+2+
2.用铜作阳极可补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定
3.N;牺牲阳极的阴极保护法
解析:
1.活泼金属作阳极,阳极材料本身失电子被氧化,其氧化产物为Al2O3,由此可得阳极的电极反-+
应式为2Al+3H2O-6e=Al2O3+6H。
3.若X为碳棒,则只能用外加电流的阴极保护法,此时开关K应置于N处.若X为Zn,K置于M处,其保护原理为牺牲阳极的阴极保护法.