第八章 水溶液中的离子平衡热点专题五四大平衡常数的重要应用.docx
《第八章 水溶液中的离子平衡热点专题五四大平衡常数的重要应用.docx》由会员分享,可在线阅读,更多相关《第八章 水溶液中的离子平衡热点专题五四大平衡常数的重要应用.docx(35页珍藏版)》请在冰豆网上搜索。
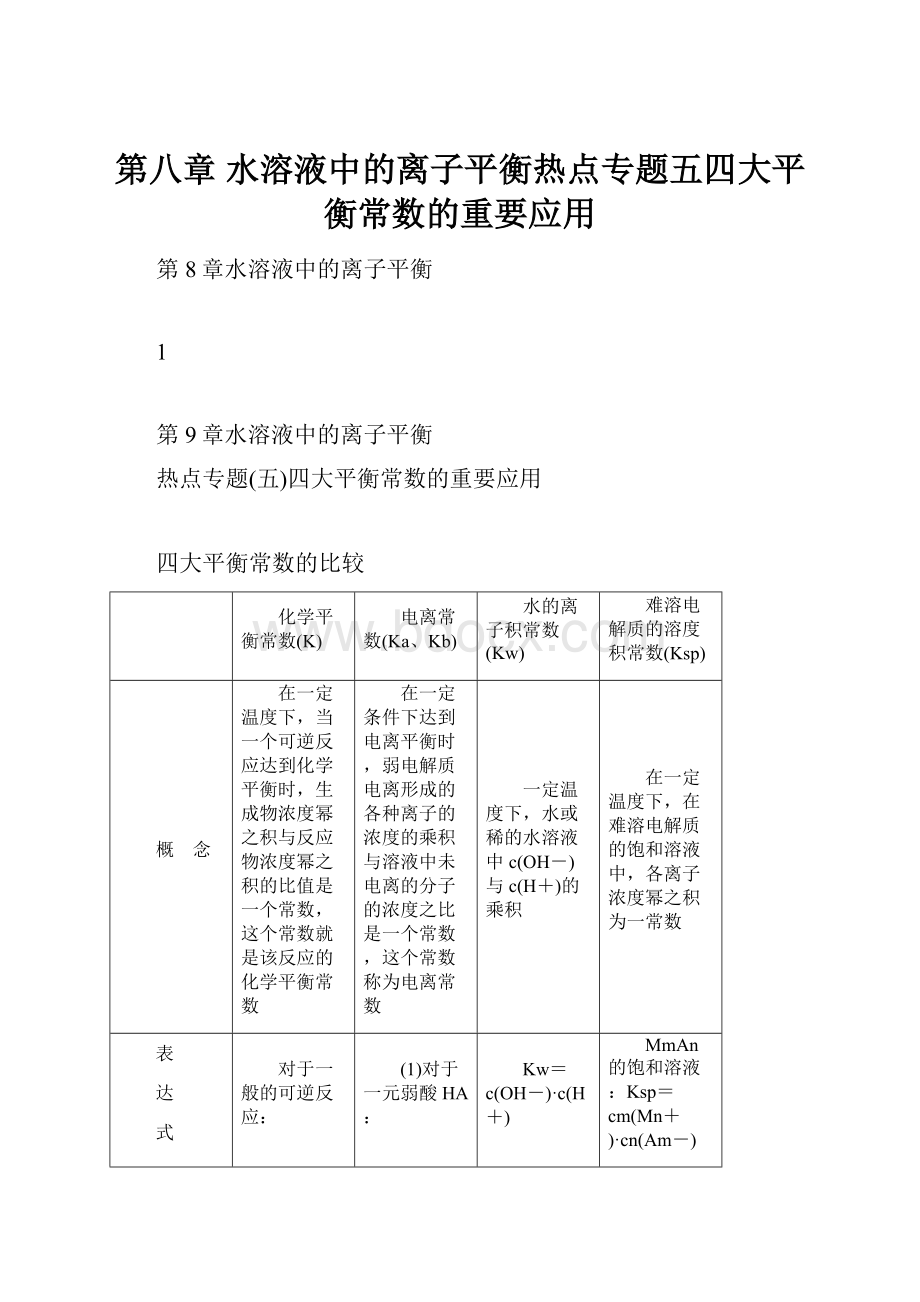
第八章水溶液中的离子平衡热点专题五四大平衡常数的重要应用
第8章水溶液中的离子平衡
1
第9章水溶液中的离子平衡
热点专题(五)四大平衡常数的重要应用
四大平衡常数的比较
化学平衡常数(K)
电离常数(Ka、Kb)
水的离子积常数(Kw)
难溶电解质的溶度积常数(Ksp)
概 念
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数
在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离常数
一定温度下,水或稀的水溶液中c(OH-)与c(H+)的乘积
在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数
表
达
式
对于一般的可逆反应:
mA(g)+nB(g)pC(g)+qD(g),
在一定温度下达到平衡时:
K=
(1)对于一元弱酸HA:
HAH++A-,电离常数
Ka=
(2)对于一元弱碱BOH:
BOHB++OH-,电离常数
Kb=
Kw=c(OH-)·c(H+)
MmAn的饱和溶液:
Ksp=cm(Mn+)·cn(Am-)
影响因素
只与温度有关
只与温度有关,升高温度,K值增大
只与温度有关,升高温度,Kw增大
只与难溶电解质的性质和温度有关
考点一 化学平衡常数
常考题型
1.求解平衡常数;
2.由平衡常数计算初始(或平衡)浓度;
3.计算转化率(或产率);
4.应用平衡常数K判断平衡移动的方向(或放热、吸热等情况)。
对 策
从基础的地方入手,如速率计算、¡°三阶段式¡±的运用、阿伏加德罗定律及其推论的应用、计算转化率等,这些都与化学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶解平衡也是化学平衡,只是在溶液中进行的特定类型的反应而已),要在练习中多反思,提高应试能力。
1.高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g)
Fe(s)+CO2(g)。
已知该反应在不同温度下的平衡常数如下:
温度/℃
1000
1150
1300
平衡常数
4.0
3.7
3.5
请回答下列问题:
(1)该反应的平衡常数表达式K=________,¦¤H________0(填¡°>”“<”或¡°=¡±);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。
求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率=________。
解析:
(1)因Fe和Fe2O3都为固体,不能代入平衡常数的表达式,所以K=
,由表中数据知,升高温度,平衡常数减小,说明平衡向左移动,故¦¤H<0。
(2)
Fe2O3(s)+CO(g)¯ð¯ñ
Fe(s)+CO2(g)
起始(mol·L-1) 0.1 0.1
转化(mol·L-1)xx
平衡(mol·L-1)0.1-x0.1+x
由题意得K=
=4.0,解得x=0.06。
所以¦Á(CO)=
¡Á100%=60%,v(CO2)=
=
=0.006mol·L-1¡¤min-1。
答案:
(1)
<
(2)0.006mol·L-1¡¤min-1 60%
2.已知可逆反应:
M(g)+N(g)P(g)+Q(g) ¦¤H>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:
c(M)=1mol/L,
c(N)=2.4mol/L;达到平衡后,M的转化率为60%,此时N的转化率为________。
(2)若反应温度升高,M的转化率________(填¡°增大¡±¡°减小¡±或¡°不变¡±)。
(3)若反应温度不变,反应物的起始浓度分别为:
c(M)=4mol/L,c(N)=amol/L;达到平衡后,c(P)=2mol/L,a=________。
(4)若反应温度不变,反应物的起始浓度为:
c(M)=c(N)=bmol/L,达到平衡后,M的转化率为________。
解析:
解答本题需从平衡建立的过程¡°三段式¡±和化学平衡常数不随着温度的变化而变化入手求解。
(1)由方程式知反应消耗的N与M物质的量相等,则N的转化率为:
¡Á100%=25%。
(2)由于该反应正反应吸热,温度升高,平衡右移,则M的转化率增大。
(3)若反应温度不变,则平衡常数不变。
K=
=
,则
=
,解得a=6。
(4)根据(3)的结果,解得M的转化率为41%。
答案:
(1)25%
(2)增大 (3)6 (4)41%
考点二 电离常数
常考题型
1.直接求电离平衡常数;
2.由电离平衡常数求弱酸(或弱碱)的浓度;
3.由Ka或Kb求pH。
对 策
试题一般难度不大,是在化学平衡基础上派生出来的。
注意平衡体系中同种离子的浓度是同一个浓度,当两个量相加或相减时,若相差100倍以上,要舍弃小的等一些基本的近似处理能力。
1.(2014·山东高考)已知某温度下CH3COOH和NH3¡¤H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.c(NH
)/c(NH3¡¤H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH
)=c(CH3COO-)
解析:
选D 由CH3COOH和NH3¡¤H2O的电离常数相等可知当二者恰好完全反应时,溶液呈中性,结合电荷守恒知c(CH3COO-)+c(OH-)=c(NH
)+c(H+),则c(CH3COO-)=c(NH
),D项正确;开始滴加氨水时,水的电离程度增大,二者恰好完全反应时,水的电离程度最大,再继续滴加氨水时,水的电离程度减小,A项错误;向醋酸中滴加氨水,溶液的酸性减弱,碱性增强,c(OH-)增大,由NH3¡¤H2ONH
+OH-可知K=
,故
减小,B项错误;根据原子守恒知n(CH3COO-)与n(CH3COOH)之和不变,但滴加氨水过程中,溶液体积不断增大,故c(CH3COO-)与c(CH3COOH)之和减小,C项错误。
2.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差不大。
以下是某温度下这四种酸在冰醋酸中的电离常数:
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
从以上表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
解析:
选C 由电离常数的数据可知四种酸在冰醋酸中均未完全电离,酸性最强的是HClO4,最弱的是HNO3,由此可知C项中的电离方程式应用¡°¯ð¯ñ¡±号表示。
考点三 水的离子积常数
常考
题型
1.计算温度高于室温时的Kw;
2.通过Kw的大小比较相应温度的高低;
3.溶液中c(H+)与c(OH-)相互换算;
4.酸、碱、能水解的盐溶液中水电离出的c(H+)或c(OH-)的计算。
对 策
Kw只与温度有关,升高温度,Kw增大;在稀溶液中,c(H+)·c(OH-)=Kw,其中c(H+)、c(OH-)是溶液中的H+、OH-浓度;水电离出的H+数目与OH-数目相等。
1.(2015·哈师大附中模拟)某温度下,水的离子积常数Kw=10-12。
该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
A.1∶10 B.9∶1
C.10∶1D.99∶21
解析:
选B 该温度下,pH=7时溶液呈碱性,NaOH过量,pOH=5,
=10-5,V(H2SO4)∶V(NaOH)=9∶1。
2.(2013·大纲卷)下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
解析:
选D 根据水的离子积定义可知A项正确;XZ线上任意点都存在c(H+)=c(OH-),所以M区域内任意点均有c(H+)<c(OH-),所以B项正确;因为图像显示T1时水的离子积小于T2时水的离子积,而水的电离程度随温度升高而增大,所以C项正确;XZ线上只有X点的pH=7,所以D项错误。
考点四 难溶电解质的溶度积常数
常考题型
1.溶解度与Ksp的相关转化与比较;
2.沉淀先后的计算与判断;
3.沉淀转化相关计算;
4.金属阳离子沉淀完全的pH及沉淀分离的相关计算;
5.与其他平衡(如氧化还原平衡、配位平衡)综合的计算;
6.数形结合的相关计算等。
对策
应用Ksp数值大小比较物质的溶解度大小时,一定是在组成上属于同一类型的难溶电解质才能进行比较,否则,不能比较;在判断沉淀的生成或转化时,把离子浓度数值代入Ksp表达式,若数值大于Ksp,沉淀可生成或转化为相应难溶物质;利用Ksp可计算某些沉淀转化反应的化学平衡常数。
1.(2015·常州模拟)已知25℃时,Ka(HF)=6.0×10-4,Ksp(MgF2)=5.0×10-11。
现向1L0.2mol/LHF溶液中加入1L0.2mol/LMgCl2溶液。
下列说法中正确的是( )
A.25℃时,0.1mol/LHF溶液中pH=1
B.0.2mol/LMgCl2溶液中离子浓度关系为2c(Mg2+)=c(Cl-)>c(H+)=c(OH-)
C.2HF(aq)+Mg2+(aq)MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
D.该反应体系中有MgF2沉淀生成
解析:
选D A项,HF是弱酸,25℃时,0.1mol/LHF溶液中pH>1,错误;B项,MgCl2属于强酸弱碱盐,离子浓度关系为c(Cl-)>2c(Mg2+)>c(H+)>c(OH-),错误,C项,2HF(aq)+Mg2+(aq)MgF2(s)+2H+(aq),该反应的平衡常数K=K
(HF)/Ksp(MgF2)=7.2×103,错误;D项,该反应体系中c(Mg2+)·c2(F-)>Ksp(MgF2),有MgF2沉淀生成,正确。
2.常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:
Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17。
下列有关说法中,错误的是( )
A.常温下,Ag2SO4、AgCl、AgI在水中的溶解能力依次减弱
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
解析:
选C 由数据可知A选项正确;Ksp(AgI)<Ksp(AgCl),说明AgI更难溶,B选项正确;Ksp(Ag2SO4)=c2(Ag+)×c(SO
),Ksp(AgCl)=c(Ag+)×c(Cl-),Ksp(AgI)=c(Ag+)×c(I-),显然C选项错误;Ag2SO4饱和溶液中存在沉溶解平衡:
Ag2SO4(s)2Ag+(aq)+SO
(aq),加入NaSO5固体,SO
的浓度增大,平衡逆向移动,有Ag2SO4固体析出,D选项正确。
1.化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。
下列关于这些常数的说法中,正确的是( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)===AgI(s)+Cl-(aq)能够发生
D.Ka(HCN)解析:
选C 平衡常数的大小与温度有关,与浓度、压强、催化剂无关,A不正确;电离是吸热的,加热促进电离,电离常数增大,B不正确;酸的电离常数越大,酸性越强,D不正确。
2.已知常温下反应,¢ÙNH3+H+¯ð¯ñNH
(平衡常数为K1),¢ÚAg++Cl-¯ð¯ñAgCl(平衡常数为K2),¢ÛAg++2NH3¯ð¯ñAg(NH3)
(平衡常数为K3)。
¢Ù、¢Ú、¢Û的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是( )
A.氯化银不溶于氨水
B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀
D.银氨溶液可在酸性条件下稳定存在
解析:
选C 因为K3>K2,所以Ag+与NH3的结合能力大于Ag+与Cl-之间的沉淀能力,AgCl溶于氨水,A、B错误;由于K1>K3,所以在Ag(NH3)
¯ð¯ñAg++2NH3中加入HCl,有H++NH3¯ð¯ñNH
,致使平衡右移,c(Ag+)增大,Ag++Cl-===AgCl↓,D错误,C正确。
3.T℃时,将6molA和8molB充入2L密闭容器中,发生反应:
A(g)+3B(g)C(g)+D(g),容器中B的物质的量随时间变化如图中实线所示。
图中虚线表示仅改变某一反应条件时,B的物质的量随时间的变化。
下列说法正确的是( )
A.反应开始至a点时v(A)=1mol·L-1¡¤min-1
B.若曲线¢ñ对应的条件改变是升温,则该反应的¦¤H>0
C.曲线¢ò对应的条件改变是增大压强
D.T℃时,该反应的化学平衡常数为0.125
解析:
选C 由图像可知,反应开始至a点时v(B)=1mol·L-1¡¤min-1,则v(A)=1/3mol·L-1¡¤min-1,A项错误;曲线¢ñ相对于实线先达到平衡,但B的转化率减小,则该反应¦¤H<0,B项错误;曲线¢ò相对于实线先达到平衡,B的转化率增大。
若增大压强,平衡右移,B的转化率增大,C项正确;根据b点的数据计算可知:
T℃时,该反应的化学平衡常数为0.5,D项错误。
4.(2013·上海高考改编)部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ki=1.77×10-4
Ki=4.9×10-10
Ki1=4.3×10-7
Ki2=5.6×10-11
下列选项错误的是( )
①2CN-+H2O+CO2===2HCN+CO
¢Ú2HCOOH+CO
===2HCOO-+H2O+CO2¡ü
¢Û中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
¢Ü等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
A.¢Ù¢Ú B.¢Ú¢Û
C.¢Û¢ÜD.¢Ù¢Ü
解析选D 根据电离平衡常数,HCN的电离程度介于H2CO3的一级电离和二级电离之间,因此¢Ù中反应错误,应为CN-+H2O+CO2===HCN+HCO
。
HCOOH的电离程度大于H2CO3的一级电离,¢Ú正确。
等pH的HCOOH和HCN,HCN溶液的浓度大,中和等体积、等pH的HCOOH和HCN,后者消耗NaOH的量大,¢Û正确。
在HCOONa和NaCN中存在电荷守恒:
c(Na+)+c(H+)=c(HCOO-)+c(OH-),c(Na+)+c(H+)=c(CN-)+c(OH-)。
等浓度的HCOONa和NaCN溶液,NaCN水解程度大,溶液中OH¨D浓度大,H+浓度小。
根据电荷守恒,两溶液中离子总浓度为2[c(Na+)+c(H+)],而Na+浓度相同,H+浓度后者小,因此等体积、等浓度的两溶液中离子总数前者大于后者,¢Ü错误。
5.已知FeCl3溶液与KSCN溶液混合后发生反应FeCl3+3KSCNFe(SCN)3+3KCl,达到平衡后,改变条件,则下列说法正确的是( )
A.向溶液中加入少许KCl固体,溶液颜色变浅
B.升高温度,平衡一定发生移动
C.加入少许KCl固体或者加入少许FeCl3固体平衡常数均发生变化,且变化方向相反
D.平衡常数表达式为K=
解析:
选B 该反应的本质是Fe3+与SCN-之间的反应,即Fe3++3SCN-¯ð¯ñFe(SCN)3,与其他离子无关,故加入KCl固体对平衡无影响,A项错误;其平衡常数表达式为K=
,D项错误;只要温度不变,平衡常数就不会发生变化,C项错误;任何反应都伴随着温度的变化,故改变温度,平衡一定发生移动,B项正确。
6.(2015·廊坊模拟)水的电离平衡曲线如图所示,下列说法不正确的是( )
A.图中四点Kw间的关系:
A=D<C<B
B.若从A点到D点,可采用:
温度不变在水中加入少量酸
C.若从A点到C点,可采用:
温度不变在水中加入少量NH4Cl固体
D.若从A点到D点,可采用:
温度不变在水中加入少量NH4Cl固体
解析:
选C Kw是温度的函数,随温度升高而增大,A、D点温度相同,B点温度高于C点温度,A正确;从A点到D点,温度不变,酸性增强,B、D正确;A、C点温度不同,C错误。
7.(2015·浙江五校联考)氯碱工业电解所用的氯化钠溶液需精制。
除去有影响的Ca2+、Mg2+、NH
、SO
及泥沙,其精制流程如下:
已知:
¢ÙCa2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
Ca(OH)2
Mg(OH)2
pH
≥11.5
≥4.2
¢ÚKsp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
下列说法正确的是( )
A.盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2
B.过程¢ñ中将NH
转化为N2的离子方程式是3ClO-+2NH
===3Cl-+N2¡ü+3H2O+2H+
C.过程¢ò中通入CO2有利于除SO
D.过程¢ô调pH可以使用硝酸
解析:
选C 盐泥a是在pH=11的条件下得到的,由题给条件,得不到Ca(OH)2,A错;过程¢ñ是在碱性条件下进行的,得不到H+,B错;过程¢ô调pH不可以使用硝酸,会引入NO
杂质,D错。
8.运用化学反应原理研究卤族元素的性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填写字母)。
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25℃时有关弱酸的电离平衡常数:
弱酸化学式
HClO
H2CO3
电离平衡常数
4.7×10-8
K1=4.3×10-7 K2=5.6×10-11
写出84消毒液露置在空气中发生反应的离子方程式___________________________
________________________________________________________________________。
(3)电解饱和食盐水可得到溶质为M的碱溶液,常温下将浓度为c1的M溶液与0.1mol·L-1的一元酸HA等体积混合,所得溶液pH=7,则c1________0.1mol·L-1(填¡°¡Ý¡±、¡°=¡±或¡°¡Ü¡±),溶液中离子浓度的大小关系为______________________________。
若将上述¡°0.1mol·L-1的一元酸HA”改为¡°pH=1的一元酸HA”,所得溶液pH仍为7,则c1________0.1mol·L-1。
(4)牙釉质对牙齿起着保护作用,其主要成分为羟基磷灰石[Ca5(PO4)3OH],研究证实氟磷灰石[Ca5(PO4)3F]比它更能抵抗酸的侵蚀,故含氟牙膏已使全世界千百万人较少龋齿,请写出羟基磷灰石的溶度积常数表达式Ksp=____________,氟离子与之反应转化的离子方程式为
________________________________________________________________________
________________________________________________________________________。
解析:
(1)氯水中存在次氯酸的电离和水的电离两种平衡;向氯水中通入SO2,二者反应生成硫酸和盐酸,其漂白性减弱;当氯水饱和时再通氯气,c(H+)/c(ClO-)不变,若氯水不饱和再通氯气,酸性增强会抑制次氯酸的电离,故比值增大;加水稀释氯水,溶液中的OH-浓度增大;加水稀释氯水,酸性减弱,对水的电离抑制作用减弱,故水的电离平衡向正反应方向移动;向氯水中加入少量固体NaOH,当溶液呈中性时,根据电荷守恒可推导出:
c(Na+)=c(Cl-)+c(ClO-)。
(2)由于次氯酸的酸性介于碳酸的两级电离常数之间,因此84消毒液露置在空气中与二氧化碳反应只能生成碳酸氢钠。
(3)当HA为强酸时二者浓度相等,为弱酸时由于生成的盐因水解显碱性,则酸要稍过量。
离子浓度大小比较时可根据电荷守恒进行推导。
(4)沉淀转化的实质是由难溶的物质转化为更难溶的物质。
答案:
(1)aef
(2)ClO-+CO2+H2O===HClO+HCO
2HClO
2H++2Cl-+O2¡ü
(3)≤ c(Na+)=c(A-)>c(OH-)=c(H+) ¡Ý
(4)c5(Ca2+)c3(PO
)c(OH-) Ca5(PO4)3OH+F-===Ca5(PO4)3F+OH-
9.(2013·山东高考)化学反应原理在科研和生产中有广泛应用。
(1)利用¡°化学蒸气转移法¡±制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g) ¦¤H>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1molI2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填¡°>¡±¡°<¡±或¡°=¡±)。
上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。
做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为
________________________________________________________________________
_________________________________________________________________